
取材レポート
「浜松医科大学 共同研究・研究倫理セミナー」参加レポート

平成29年6月16日(金)、TKP浜松アクトタワーにて「浜松医科大学 共同研究・研究倫理セミナー」が開催されました。
浜松市は自動車・オートバイ産業をはじめ、楽器や光技術関連、繊維など多くの企業が集まる、世界に誇る「ものづくり」の地域です。JSTの「産官学共同研究拠点事業」に「はままつ次世代光・健康医療産業創出拠点(以下、はままつ医工連)」が採択され、浜松医科大学を中心に拠点を整備し、さまざまな成果を上げています。
産と学の共同研究上の注意点や、そこで求められる倫理教育について多くの示唆を得ることが出来るセミナーをレポートします。
産学連携の増加と、求められる倫理教育
 今日、共同研究の数が増加するとともに、産学横断的なケースが増えています。このため大学・研究機関と企業の間での各種法務や規程、研究倫理について、その基本的な考えを共有する必要性が増しています。大学や研究機関では教職員を対象に研究倫理教育が行われていますが、民間企業と連携を開始するときはどのような形になるでしょうか?
今日、共同研究の数が増加するとともに、産学横断的なケースが増えています。このため大学・研究機関と企業の間での各種法務や規程、研究倫理について、その基本的な考えを共有する必要性が増しています。大学や研究機関では教職員を対象に研究倫理教育が行われていますが、民間企業と連携を開始するときはどのような形になるでしょうか?
今回のセミナーの対象は、誰でも参加可能な広く門戸が開かれたものでした。高い技術を持ちながらも医工連携の経験がない企業を対象に、「大学と企業が双方で周辺情報を把握する」ために、
- ①「大学等との共同研究において留意すべき点」
- ②「データや結果の捏造、改ざん及び他者の研究成果などの盗用・不正行為」
の二つの観点についてわかりやすく紹介する企画となっていました。
企業が初めて医工連携を実現していく過程で、研究倫理教育がどのようになされていくのかという例を見ることも出来ました。
共同研究を始めるにあたって
 セミナー前半は、浜松医科大学 山本清二理事(教育・産学連携担当)・副学長より、『医療系の研究者とうまく共同研究するために』と題した講演でした。
セミナー前半は、浜松医科大学 山本清二理事(教育・産学連携担当)・副学長より、『医療系の研究者とうまく共同研究するために』と題した講演でした。
山本講師がまず確認したのは、共同研究は受託研究と違い、企業と大学は対等な関係にあるということです。受託研究の場合、内容は企業が決定・出資して、大学に研究を委託するため、研究開発を担う大学は研究実施上の制約がありました。一方、共同研究では両者に主従関係はありません。
その上で、産学両者のバックグラウンドが違うため、足並みを揃える必要があります。今回は先述のとおり、基本的なガイダンスと、知っておくべき倫理等の講義が行われました。
ガイダンスは、「はままつ医工連」の紹介と、その概要説明から始まり、スムーズな連携のためワンストップ窓口を整備していること、申込み時の注意点(既に共同研究を行っている場合は必ず先方の了解を得る必要がある)など、スライドを使ってフロー(下図)を示しながら、いつどのような契約を結び、何を行うかについて具体的な説明がありました。
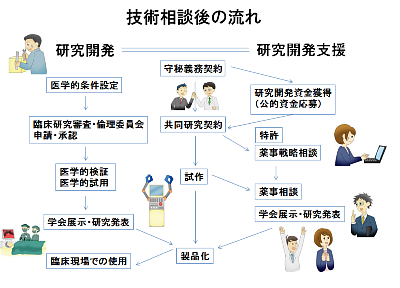
(解説) 産学でまず結ぶのが「守秘義務契約」です。これは医師・企業双方にとって情報漏えいリスクによるトラブルを未然に防ぐためです。
研究開発資金を得て、医学的条件設定(対象となる臓器等の決定)が済み、倫理委員会の承認を得られ次第、産学が対等な立場で「共同研究契約」を結びます。
その後、大学の倫理委員会の承認、医学的試用、薬事相談など、プロセスの解説がありました。
次に技術相談申込書の書き方や、その後のフォロー体制についての説明がありました。申込み後に今後の面接、研修、交流などの流れに乗ること、本セミナー受講は浜松医科大学にて後日開催される「医療現場見学会」への入場パスポートとリンクしており、これらを経た後、医療現場に入っていくことが出来るようになること、各診療科にいる医療連携サポーターや相談員による連携制度も整えたこと、が紹介されました。
課題についての説明も二つありました。
一つ目は、医療現場で真に役立つニーズの価値判断をどのように行うかについてです。現場のニーズから外れないための対策案がいくつか挙げられました。
二つ目は、医工連携における知的財産権の帰属の問題点について取り上げられました。
最後に、文部科学省・経済産業省合同で作成されたガイドラインを紹介し、その中で産学官連携を推進していること、日本の産学共同研究は欧米に比して小規模だと指摘されているが、小さくても持っている「強み」を訴えたい、とよびかけられ、ガイダンスのパートが終了しました。
共同研究企業における研究倫理教育の必要性
 セミナーの後半は、浜松医科大学 蓑島伸生副学長(研究担当)より『研究倫理について』の講演でした。
セミナーの後半は、浜松医科大学 蓑島伸生副学長(研究担当)より『研究倫理について』の講演でした。
始めに浜松医科大学内の関連規程の紹介があり、次に研究倫理の対象として、下記の3つがあると紹介されました。
I. 研究対象に関する倫理(臨床倫理、環境倫理、動物実験倫理など)
II. 研究データに関する倫理(いわゆる不正防止)
III. 研究費に関する倫理
Iの研究対象に関する倫理では、「臨床研究とは」という初歩的な説明と、知っておくべき法規類の紹介がありました。
また本年度改正された「個人情報の保護に関する法律」及び「人を対象とする医学系研究に関する倫理指針」のポイントについても触れられました。そして、浜松医科大学での倫理審査の手続きについて、丁寧な説明がありました。
IIの「研究データに関する倫理」では、研究不正(ねつ造、改ざん、盗用)や、違反に対する措置等がとりあげられました。「論文で嘘を書くと共同研究にもかかわる」と警鐘を鳴らす蓑島講師。文部科学省の「研究活動における不正行為への対応等に関するガイドライン(以下、ガイドライン)」の概要が説明され、守らない場合は「違反に対する措置」がある旨、注意喚起がなされました。
浜松医科大学ではガイドラインに対応する為に、規程や体制を組み直し、研究倫理教育を徹底するなど学内整備を進めており、eラーニング教材の一つである、CITI Japanプログラムを履修していないと研究者はもちろんのこと、大学院生も臨床研究に参加できない仕組みにあり、企業に対しても、共同研究に先立ち研究倫理教育を履修することを求める方向性にあることが説明されました。
また、データ保存期間についても、論文発表から起算して、研究データは10年間、資料及び標本などの有体物は5年間保存が義務付けられている旨説明されました。
さらに近年の不正事例(高血圧患者データに製薬会社が関与した件、腎不全ラットの実験でデータの二重使用がされた件、STAP細胞事件 等)。について、具体的に列挙し説明が行われました。
最後にIIIの研究費不正では、不正の具体例(預け金、流用、カラ出張など) を挙げて、「公的研究費の管理・監査のガイドライン」で求められている必要事項について解説し、浜松医科大学における体制や、研究倫理教育プログラム(例: CITI Japanプロジェクト)について細かく説明されました。
研究費の申請・獲得については大学側が行うため、企業側で研究費不正が発生する可能性は少ないと思われるが、共同で研究している以上、企業側でも無関係ではなく、大学の不正防止対策について理解してほしい旨、述べられました。
蓑島講師は、医工連携の共同研究では、臨床、研究データ及び研究費の3つの倫理が相互に関係するため、全体の理解に努める必要性があること、共同研究を活発に行うためにもあらかじめこれらの倫理について理解してほしいと講演を締めくくりました。
セミナーの最後に山本講師から、本日紹介した手続きは煩雑に見えるかもしれないが、共同研究をスムーズにするためのものであり、患者への還元という最終目標を実現するためにも、倫理規程に則り、適正な評価を行うことが肝要である、と語られました。
患者のために、着実に共同研究に向けた拠点整備を進める浜松において、これから更に多くの成果が生み出されることが期待されます。
参考URL: http://www.ikollabo.jp/public/topic/120
JST地域産学官共同研究拠点整備事業
はままつ次世代光・健康医療産業創出拠点


