ポイント
- 病原性を保ちつつ、蛍光波長の異なる蛍光たんぱく質を安定的に発現するウイルスの作製に成功した。
- 蛍光を利用して生体内におけるウイルス感染の画像解析が可能。
- インフルエンザウイルスに対する生体防御や気道炎症のメカニズムの解明が期待される。
JST 戦略的創造研究推進事業において、東京大学 医科学研究所の河岡 義裕 教授と福山 聡 特任准教授らは、4種類の蛍光たんぱく質を発現するインフルエンザウイルス「Color-flu(カラフル)」の作製に成功しました。Color-fluは、蛍光たんぱく質を利用して感染細胞を光らせるので、インフルエンザウイルスの感染によって起こる炎症など、生体内でウイルス感染が広がる様子をさまざまな手法で画像分析することが可能になります。
本研究では、ウイルス本来の病原性を保ち、かつ挿入した蛍光たんぱく質の発現をほぼ完全に維持できるウイルス株を樹立することに成功し、「Color-flu」と名付けました。インフルエンザウイルスの存在を示すレポーターとして、蛍光波長の異なる4種類の蛍光たんぱく質eCFP(青緑)、eGFP(緑)、Venus(黄)、mCherry(深赤)注1)を用いました。
本研究ではColor-fluがさまざまな画像解析手法に応用できることを実証しました。深部の組織が観察できる2光子レーザー顕微鏡注2)を用いて、マウスの肺組織におけるウイルス感染細胞とマクロファージ注3)のタイムラプス撮影注4)に初めて成功し、インフルエンザウイルスの感染により炎症が生じる様子を詳細に確認できました。さらに、Venusを発現する高病原性鳥インフルエンザウイルスを作製し、肺での感染の広がり方を高病原性ウイルスとインフルエンザウイルス(PR8株注5))とで比較することができました。本研究で作製した病原性を維持したまま蛍光たんぱく質を発現するインフルエンザウイルスは、ウイルスに対する生体防御や気道炎症のメカニズムの解明に役立つことが期待されます。
なお、本研究グループでは、革新的先端研究開発支援事業における「インフルエンザ制圧を目指した次世代ワクチンと新規抗ウイルス薬の開発」プロジェクトが昨年より開始されており、本研究成果は革新的なインフルエンザ治療薬の開発などに役立つことが期待されます。本研究は、東京大学、米国ウィスコンシン大学、鹿児島大学と共同で行ったものです。本研究成果は、2015年3月25日(英国時間)、英国科学雑誌「Nature Communications」のオンライン速報版で公開されます。
<研究の背景と経緯>
毎シーズン、国内だけでも約1千万人が感染する季節性インフルエンザウイルスは、医学・公衆衛生上、最も対策が必要な病原体の1つです。ワクチンは、インフルエンザの予防法として最も有効ですが、発症を完全に予防することはできません。治療薬として、体内でのウイルス増殖を抑える抗インフルエンザ薬が開発されていますが、近年は抗インフルエンザ薬に耐性を持つウイルスが流行するようになりました。2013年に中国で発生した新型H7N9ウイルスや、東南アジアやエジプトで散発的にヒト感染例が報告される高病原性鳥H5N1ウイルスは、ヒトに対して高い病原性を持ち、肺で強い炎症を起こしますが、肺炎の重症化メカニズムの解明はいまだに不十分です。このように、インフルエンザウイルスを制圧するための課題は山積みで、精力的な研究・開発が必要です。
インフルエンザウイルスの研究において、生体内でウイルスがどの細胞に感染しているか、感染細胞を判別することは、最も重要で基本となる情報の1つです。これまでは免疫組織化学的な手法が一般的で、感染動物から摘出した臓器をホルマリンなどで固定し、感染細胞を同定していました。しかし、この方法では細胞を固定してしまうので、感染細胞を生きたまま解析することができません。そこで、生きた感染細胞を検出するために、インフルエンザウイルスの遺伝子にレポーター遺伝子(ある遺伝子が発現しているかどうかを容易に判別するために、その遺伝子に組み換える別の遺伝子)を挿入する試みがなされてきました。蛍光たんぱく質など、さまざまなレポーター遺伝子が試されましたが、レポーター遺伝子を挿入することでウイルスの病原性が低下し、ウイルスが増殖を繰り返す間にレポーター遺伝子がウイルスゲノムから脱落してしまうため、実験動物の感染実験に用いることは困難とされてきました。
このような背景の下、本研究ではウイルス本来の病原性を損なわず、蛍光たんぱく質を安定的に発現するインフルエンザウイルス株を作製し、このウイルス株を用いて、インフルエンザウイルスの新たな画像解析を行うことを目指しました。
<研究の内容>
1.ウイルスの病原性を保ったままで蛍光たんぱく質を発現するウイルス株を作製
インフルエンザウイルス(PR8株)のゲノム分節注6)であるNSセグメントに、蛍光たんぱく質のレポーターとしてVenus遺伝子(黄)を挿入し、リバースジェネティクス法注7)を用いてVenus—PR8株を作製しました。ところが、Venus遺伝子を挿入したことにより、マウスに対するVenus—PR8株の病原性は著しく低下しました。そのため、Venus—PR8株をマウスに繰り返し感染させて、マウスに対する病原性を回復したマウス馴化Venus—PR8株を作製することに成功しました。次いで、このマウス馴化Venus—PR8株が培養細胞やマウスの肺で安定的にVenus遺伝子を発現することを確認しました。
次に、ウイルスの病原性維持と挿入したVenus遺伝子の安定性に関与するウイルス遺伝子を同定するために、マウス馴化Venus—PR8株の遺伝子の塩基配列を解析しました。その結果、ウイルス遺伝子の中に2つの変異を同定しました。
さらに、さまざまな画像解析手法に対応できるように、マウス馴化株を基盤にして、Venusのほか、蛍光波長の異なるeCFP(青緑)、eGFP(緑)、mCherry(深赤)の遺伝子を挿入したウイルス株を作製しました。このように短波長域から長波長域まで蛍光を発することにより可視化することのできるウイルス株「Color-flu(カラフル)」の作製に成功しました(図1)。
次いで、Color-fluに感染したマウスの肺を透明にした後、蛍光実体顕微鏡で観察したところ、4つのそれぞれの蛍光たんぱく質を発現する感染細胞が気管支に沿って広がっていることが確認できました(図2)。
さらに、高病原性鳥インフルエンザウイルス(H5N1株)の生体内での画像解析を行うためにPR8株と同様の手法を用いてVenus-H5N1ウイルス株を作製することにも成功しました。
2.マウスの肺でインフルエンザウイルスの感染がどのように起こるかを観察
インフルエンザウイルスに感染すると、マクロファージがウイルスに感染した細胞を見つけて、免疫細胞に伝えます。マウスの肺の内部におけるインフルエンザウイルス感染細胞とマクロファージの相互作用を解析するために、2光子レーザー顕微鏡を用いてColor-flu(マウス馴化eGFP—PR8株)感染マウスの肺を観察しました。その結果、アポトーシス様の形態注8)を示すウイルス感染細胞が高い頻度で認められました。また、ウイルス感染細胞に接着している多くのマクロファージが、ほとんど動かないことなどが明らかになりました。セルソーター注9)を用いてマクロファージを分離・回収し、その遺伝子発現を解析したところ、マクロファージは抗ウイルス作用を示す1型インターフェロンを多く産生していました。以上の結果から、感染した肺に移動してきたマクロファージは感染初期の抗ウイルス応答に関与していることが示唆されました。
次に、高病原性鳥H5N1ウイルスの病原性を解析するために、マウスの肺で感染細胞の分布をVenus-H5N1とVenus—PR8との間で経時的に比較しました。感染した肺を透明化処理し、2光子レーザー顕微鏡を用いて観察しました。得られたデータを3次元構築し、肺のどの部分が感染しているのか、感染領域を定量的に解析しました。その結果、Venus-H5N1は、感染から24時間で多くの気管支上皮に感染した後、急速に末梢の肺胞上皮に感染が広がることを明らかにしました。
また、ある個体が複数の異なるインフルエンザウイルス株に同時に感染すると、ゲノム分節が入れ替わること(リアソートメント)によって、新型ウイルスができる場合があります。このリアソートメントは、1つの細胞に複数のウイルスが感染することによって起きる確率が高いと考えられています。そこで、このリアソートメントに寄与している細胞群を明らかにするため、それぞれ異なる蛍光たんぱく質が挿入された4種類のColor-flu株を同時にマウスに感染させ、複数のウイルス株が感染している細胞の分布を組織学的に解析しました。マルチスペクトル画像解析システム注10)を用いた検討の結果、感染2日目の気管支上皮に複数のColor-flu株に感染した細胞が高頻度で存在していることが明らかになり、リアソートメントによる新型ウイルスは気管支上皮で出現している可能性が示唆されました。
<今後の展開>
本研究で新たに樹立したインフルエンザウイルス「Color-flu」によって、さまざまな画像解析が可能となり、インフルエンザウイルスの病原性発現メカニズムや新型ウイルス出現メカニズムの解明に役立ちます。さらに、ワクチンや新規抗ウイルス薬の実験動物における評価にも応用できることから、ウイルス学や免疫学などの基礎的な研究から、ワクチンや薬剤開発まで幅広く利用されることが期待されます。
<参考図>
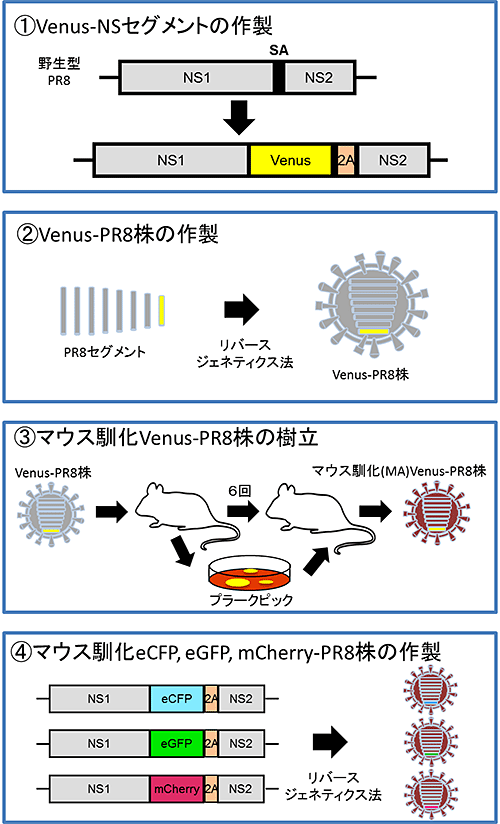
図1 Color-fluの作製方法
- ① VenusをNSセグメントに導入してNS-Venusセグメントを作製しました。
- ② リバースジェネティクス法を用いて①のセグメントを持つVenus—PR8株を作製しました。
- ③ Venus—PR8株をマウスに感染させて繰り返し培養し、Venusを安定的に発現し病原性を回復したマウス馴化Venus—PR8株を樹立しました。
- ④ ①、②、③と同様にeCFP、eGFP、mCherryを挿入したNSセグメントを作製し、リバースジェネティクス法を用いて、マウス馴化PR8株を基にしたマウス馴化eCFP、eGFP、mCherry—PR8株を作製しました。
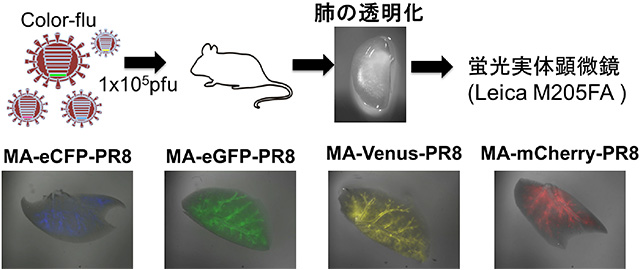
図2 透明化した肺におけるウイルス感染細胞の局在
マウスにそれぞれ異なるColor-fluを感染させて、肺を摘出し、試薬で肺を透明にしました。蛍光実体顕微鏡を用いて蛍光たんぱく質を発現するウイルス感染細胞の分布を観察したところ、それぞれの蛍光たんぱく質を発現する感染細胞が気管支に沿って広がっていることが確認できました。
<用語解説>
- 注1) eCFP(青緑)、eGFP(緑)、Venus(黄)、mCherry(深赤)
- eCFP、eGFP、Venusは、オワンクラゲ由来の蛍光たんぱく質GFPの改良型で、それぞれ青緑、緑、黄の蛍光を発する。Venusは理化学研究所 脳科学総合研究センター 宮脇 敦史 博士(グループディレクター)らが開発した新規GFP変異体で、改変GFPの中でも特に強い蛍光を発する。mCherryは、サンゴ由来の赤色蛍光タンパク質(DsRed)を改変した蛍光タンパク質。
- 注2) 2光子レーザー顕微鏡
- 近赤外レーザーパルス光を用いて2つの光子を1つの蛍光分子に同時に吸収させることで、蛍光分子を励起させる。共焦点レーザー顕微鏡と比べて、長波長の光を使用することから、深部の組織を低浸襲で観察することができる。
- 注3) マクロファージ
- 白血球の一種で、異物や感染細胞などを貪食し、サイトカインなどを産生することで、免疫システムの重要な役割を担っている。
- 注4) タイムラプス撮影
- 一定間隔で撮影し、画像をつなぎ合わせて動画のようにして、細胞などの動きを観察する方法。
- 注5) PR8株(A/Puerto Rico/8/34)
- 1934年にヒトから単離されたA型インフルエンザウイルス。現在、ワクチンの開発やウイルス研究などで最も頻繁に利用させているインフルエンザウイルス株の1つである。
- 注6) ゲノム分節
- A型インフルエンザウイルスでは、ウイルス粒子の中でゲノムが8本の分節(セグメント)(HA、NA、M、PB1、PB2、PA、NP、NS)に分かれている。
- 注7) リバースジェネティクス法
- 遺伝子情報をもとにウイルスを人工合成する方法。1999年に河岡 義裕 博士らによってインフルエンザウイルスのリバースジェネティクス法が開発された。
- 注8) アポトーシス様の形態
- 細胞死の1種であるアポトーシスを起こす細胞では、細胞膜の構造が不安定になり、小胞化や断片化がみられる。
- 注9) セルソーター
- 細胞を蛍光色素などで標識し、特定の蛍光パターンを示す細胞集団を分離、回収する装置。
- 注10) マルチスペクトル画像解析システム
- 各種蛍光たんぱく質は、それぞれ波長パターン(蛍光スペクトル)の異なる蛍光を発する。蛍光スペクトルを分析することで、複数の蛍光たんぱく質が発現する試料で各蛍光シグナルの発現レベルを高い感度で解析することができる。
<論文タイトル>
“Multi-spectral fluorescent reporter influenza viruses (Color-flu) as powerful tools for in vivo studies”
(Color-flu:個体レベルの研究に有用なマルチスペクトル蛍光たんぱく質をレポーターにしたインフルエンザウイルス)
doi: 10.1038/ncomms7600
<お問い合わせ先>
<研究に関すること>
河岡 義裕(カワオカ ヨシヒロ)
東京大学 医科学研究所 感染・免疫部門 ウイルス感染分野 教授
〒108-8639 東京都港区白金台4-6-1
Tel:03-5449-5310 Fax:03-5449-5408
E-mail:
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: