ポイント
- 免疫の老化は司令塔のT細胞の機能的な劣化によると考えられている。
- ヘルパーT細胞の老化を制御する経路と分子を同定。
- 老化に伴う感染症やアレルギー、炎症疾患の発症防止や治療法確立に期待。
JST 課題達成型基礎研究の一環として、愛媛大学 大学院医学系研究科の山下 政克 教授は、同医学部附属病院 先端医療創生センターの桑原 誠 助教らと共同で、老化に伴う免疫機能異常のメカニズムの一端を明らかにしました。
老化によって、病原体などに対する獲得免疫応答注1)が著しく低下するとともに、過剰な炎症反応が引き起こされます。それにより慢性的な炎症状態が誘導され、最終的に加齢に伴う慢性炎症疾患(関節リウマチなどの自己免疫疾患)の発症増加につながると考えられています。この現象は、免疫老化と呼ばれ、免疫系の司令塔であるヘルパーT細胞注2)の機能的な劣化が一因だと考えられていましたが、そのメカニズムは不明でした。
山下教授らは、マウスでメニン(Menin)注3)というたんぱく質が、ヘルパーT細胞の老化を制御する鍵分子として働くことを明らかにしました。次に、Meninの下流で働いて老化に伴う過剰な炎症反応の誘導を抑える分子として、バック2(Bach2)注4)というたんぱく質を同定しました。今回の研究から、ヘルパーT細胞の老化に伴ってMeninの機能が弱まり、MeninがBach2の発現を誘導できなくなることが、炎症状態につながる可能性が示唆されました。
今後、この仕組みをさらに詳細に解析し、制御法を見つけることで、老化に伴う慢性炎症疾患の発症や感染症の増加の予防・治療へとつながることが期待されます。
本研究は、千葉大学 大学院医学研究院の中山 俊憲 教授、かずさDNA研究所 ヒトゲノム研究部 小原 収 部長、理研 統合医科学研究センター 分化制御研究グループ 黒崎 知博 グループディレクターらのグループの協力を得て行いました。
本研究成果は、2014年4月2日(英国時間)に英国科学誌「Nature Communications」でオンライン公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「T細胞記憶のエピジェネティク調節による慢性炎症性御」 |
| 研究者 |
山下 政克(愛媛大学 大学院医学系研究科 教授) |
| 研究期間 |
平成23年3月~平成26年3月 |
JSTはこの領域で、炎症の慢性化機構という現象の実体解明に向けた研究を行い、それに基づき、がん・動脈硬化性疾患・アレルギー・自己免疫疾患などの炎症の慢性化が関与するさまざまな疾患の予防や治療、創薬につながる新たな医療基盤の創出を目指しています。
<研究の背景と経緯>
日本では高齢化社会のさらなる進行により、免疫システムの老化が引き金となる慢性炎症疾患、がんや感染症などの疾患の増加が危惧されており、対策が急がれています。
免疫機能は、自然免疫と獲得免疫の大きく2つに分けることができます。老化に伴って、特に獲得免疫の応答が低下・劣化します。この現象は「免疫老化」と呼ばれ、この免疫老化が、高齢者における慢性炎症疾患(関節リウマチなどの自己免疫疾患)や発がんの増加、易感染性の誘発、ワクチン効率の低下につながると考えられています。
獲得免疫に関わる細胞の中でも、T細胞の機能は個体の老化に大きく影響を受けることが知られています。T細胞は胸腺でつくられますが、胸腺は加齢とともに退縮するので、老齢期においては新たなT細胞の供給が減少します。そのため、老化した個体では以前につくられたT細胞を増殖させることでT細胞の数を維持します。しかし、T細胞は限られた回数しか分裂・増殖することができず、限界近くまで分裂した状態である細胞老化注5)が誘導されます。さらに、慢性ウイルス感染によって誘導される過剰なT細胞増殖によっても、T細胞の老化が引き起こされることが報告されています。つまり、免疫老化の原因は主としてT細胞自身の過剰な分裂・増殖によって誘導される細胞老化だと考えられます。
T細胞の一種であるヘルパーT細胞は、免疫系の司令塔であり、免疫老化に伴うその機能的な劣化は、免疫システム全体の機能不全につながります。しかし、免疫老化におけるヘルパーT細胞の細胞老化とそれに伴った機能異常のメカニズムはほとんど分かっていませんでした。そこで、本研究グループは、ヘルパーT細胞の細胞老化とそれに伴う機能異常のメカニズムを明らかにし、その対処法を確立することを目的に研究を行いました。
<研究の内容>
細胞の老化は、エピジェネティックな機構注6)で調節されていると考えられています。山下教授らは、エピジェネティック調節因子の1つであるMeninに着目してヘルパーT細胞の細胞老化研究を行いました。全てのT細胞がMeninを持たないマウスを解析し、抗原の感作や感染実験を行い、獲得免疫の応答が上手く誘導されないことを見いだしました。その原因について調べたところ、Meninを欠損したヘルパーT細胞は、活性化した後、極めて早い時期に、細胞分裂の回数が少ないにも関わらず細胞老化を起こしていることが分かりました(図1)。
細胞老化をきたした多くの細胞は、さまざまな炎症性のたんぱく質を作り出して周囲に分泌し、周辺組織の炎症を引き起こし慢性化させることが知られています。細胞老化により生じるこのような現象はSASP注7)と呼ばれ、それによって誘導される慢性的な前炎症状態は、加齢とともに増加する自己免疫疾患や代謝性疾患の発症、発がんや感染症の増加と密接に関係していると考えられています。
今回、MeninがないヘルパーT細胞が、早期に細胞老化し、SASP現象を起こしていることが認められました(図2)。また、Menin欠損ヘルパーT細胞では、通常、ヘルパーT細胞の細胞老化とともに産生が増加するエフェクター・サイトカイン(IFN-γやIL-4)などの産生が、分裂回数が少ないにも関わらず増加していることも分かりました。このことは、ヘルパーT細胞におけるSASPの誘導やエフェクター・サイトカインの産生が、Meninによって抑制されていることを示唆しています。
次に、老化ヘルパーT細胞を人為的に作製する実験系注8)を確立し、Bach2というたんぱく質をMenin下流の制御因子として同定しました。正常なヘルパーT細胞では、Bach2の発現はMeninにより維持されていますが、細胞老化したヘルパーT細胞ではMeninの機能が低下しており、それがBach2たんぱく量の減少につながっていることを突き止めました。
Bach2をMenin欠損ヘルパーT細胞に導入すると、細胞老化でみられるSASP誘導やエフェクター・サイトカイン(IFN-γやIL-4)の産生が抑制されたこと、逆にBach2欠損ヘルパーT細胞では、Menin欠損ヘルパーT細胞と同様にSASPの誘導とエフェクター・サイトカインの産生増加が認められたことで、Bach2の関与が確認できました。
さらに解析を進めたところ、Meninは、Bach2遺伝子の転写・発現を維持していることが分かりました(図3)。
以上、今回の一連の研究でヘルパーT細胞の細胞老化に伴って、MeninによるBach2の発現誘導が低下することが、SASPやエフェクター・サイトカイン産生上昇を誘導し、老化に伴った免疫機能異常を誘発し、炎症疾患の増加を引き起こす可能性が示唆されました(図4)。
<今後の展開>
本研究により、免疫老化に伴う炎症反応誘導の鍵となる分子としてMeninとBach2が同定されました。最近、ほかの複数のグループからBach2欠損マウスでは、気道や腸管の炎症が自然発症するという報告がされました。それらの論文では、Bach2が制御性T(Treg)細胞の恒常性維持に必要だと報告されています。また、山下教授らもBach2欠損ヘルパーT細胞で、Treg細胞分化に障害があることを確認しています(図4)。さらに、ヒトでは、BACH2の遺伝子の変異と、気管支喘息、関節リウマチ、多発性硬化症、クローン病、セリアック病やI型糖尿病など、多くの自己免疫疾患・慢性炎症疾患との関連も報告されています。よって、今後Menin-Bach2経路による免疫システムの調節の仕組みをさらに詳細に解析し、その制御法を見つける研究を進めることで、「加齢に伴った易感染性、アレルギーや自己免疫疾患などの慢性炎症疾患の発症を予防・治療法」を確立できる可能性があります。
<参考図>
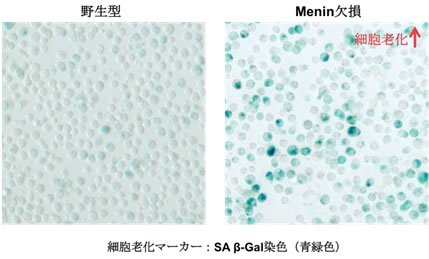
図1 Menin欠損ヘルパーT細胞は、活性化後ごく早期に細胞老化をきたす
培養皿の上で活性化して7日目のヘルパーT細胞の細胞老化の状態を評価した。緑色は、細胞老化のマーカーであるSAβ-Gal(senescence-associated beta-galactosidase)。Menin欠損ヘルパーT細胞では、野生型に比べSAβ-Gal活性が上昇していることが分かる。
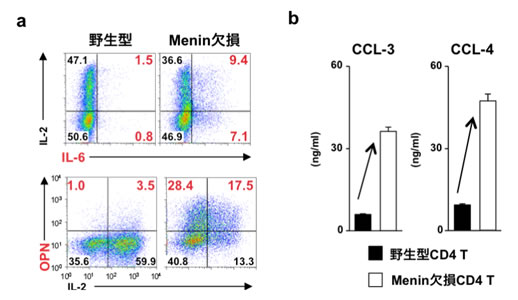
図2 Menin欠損ヘルパーT細胞では炎症性因子であるサイトカイン・ケモカインの発現が増加するSASPが認められた
- (a)炎症性サイトカイン(IL-6とオステオポンチン:OPN)の細胞内染色を行いフローサイトメトリーにより解析。
- (b)培養上清中の炎症性ケモカイン(CCL-3とCCL-4)量を測定。
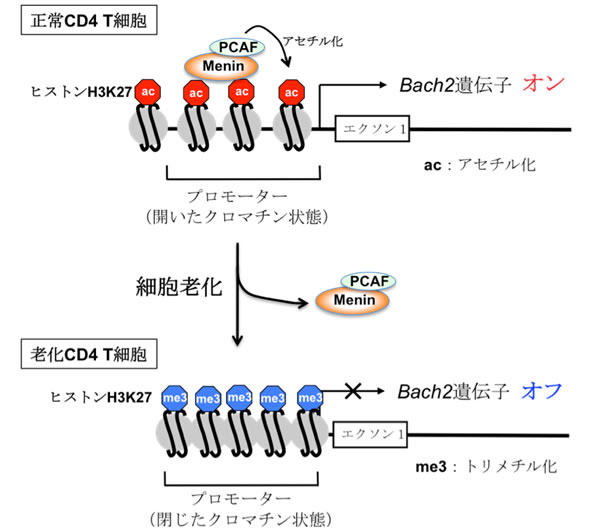
図3 MeninによるBach2発現制御モデル
- (上)正常細胞では、MeninはBach2遺伝子座のプロモーター領域に結合し、ヒストンアセチル化酵素の1つPCAFを呼び寄せ、ヒストンのアセチル化を介してクロマチンを開いた状態に保つことでBach2の発現を維持している。
- (下)細胞老化に伴い、MeninとPCAFは、何らかの理由でBach2遺伝子座のプロモーター領域に結合できなくなり、その結果Bach2の発現が減少すると考えられる。
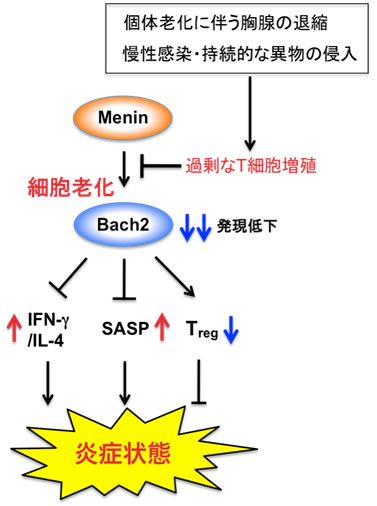
図4 Menin-Bach2経路によるヘルパーT細胞の機能調節
実際のヘルパーT細胞では、胸腺の退縮によるT細胞供給の減少、慢性感染や持続的な異物の侵入により過剰な細胞増殖が誘導されることでMeninの機能が減弱し、それにより細胞老化が起こると考えられます。さらに、Meninの機能の減弱に伴いBach2遺伝子の発現誘導が減少し、炎症が起きやすい状態が形成されると考えられます。
“The Menin-Bach2 axis is critical for regulating CD4 T cell senescence and cytokine homeostasis”
(CD4 T細胞老化とサイトカイン産生の制御におけるMenin-Bach2経路の重要性)
doi: 10.1038/ncomms4555