筋収縮はアクチンでできた細いフィラメントと、ミオシンでできた太いフィラメントの滑り運動によって起こります。具体的には次のような運動が起こっています。ミオシンは生体内のエネルギー供給源である「アデノシン三リン酸」(ATP)を加水分解する酵素で、ATPから得られたエネルギーを使い、太いフィラメントから突き出たクロスブリッジ(ミオシン頭部)を櫂で漕ぐように動かします(参考図を参照)。こうして太いフィラメントが細いフィラメントの上を進み、2つのフィラメント間の滑り運動は起こると考えられています。これは、すべての動物が動くために必要な筋肉の中で働く最も基本的な化学反応であり、最も大きな力を発生するエネルギー変換ですので、その機構の解明が待たれていました。しかし、ミオシン頭部がアクチン分子に出合って結合し、その形を変えて滑り運動を起こすまでの経過を、アクチンとミオシンを構成するアミノ酸残基同士の親和力や反発力、構造変化などの現象で説明することは容易ではありませんでした。
研究チームは、ニワトリの消化管にあり食物を咀嚼する前胃(砂嚢)筋のミオシン頭部だけを、蚕蛾の培養細胞で大量に作る遺伝子工学的方法注1を独自に開発して、アクチンとミオシン間の結合に関係するアミノ酸残基の詳しい相関図を作りました。これを基にして、「弱い結合」と呼ばれるアクチンとミオシンの複合体の原子モデルを作り、既に知られている「強い結合」と呼ばれる複合体のそれとを比較することにより、アクチン上でミオシン頭部がどのように動いて力を発生するのかを、分子レベルで解明することに世界で初めて成功しました。
この成果は単に筋肉運動の機構解明にとどまらず、細胞運動や細胞内輸送を担うミオシン・ファミリー、さらには細胞分裂や神経軸索内輸送を担うキネシン・ファミリーの蛋白質でも極めて類似した機構が働いていることを考えると、多くの生命現象を理解するために重要です。また、これらのファミリーに属する蛋白質の突然変異で起こる遺伝性疾患(家族性心筋症注2など)の病因究明にも寄与するものと期待されます。
本研究は、戦略的創造研究推進事業 ERATO型研究「前田アクチンフィラメント動態プロジェクト」(研究総括:前田雄一郎 名古屋大学大学院理学研究科教授)の尾西裕文技術参事(理研播磨研究所客員研究員)が、米国UCSFのマヌエル・エフ・モラレス名誉教授らと共同で行ったものです。本研究成果は、2007年7月31日発行の米国科学雑誌「米国科学アカデミー紀要」に掲載されるに先立ち、オンライン版(7月16日付、日本時間7月17日)に掲載されました。
<研究の背景と経緯>
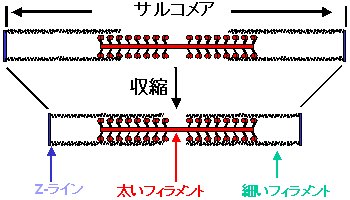
図1 筋収縮の滑り機構
筋肉の細胞には、アクチンでできた細いフィラメントとミオシンでできた太いフィラメントが並行に並んでいて、二つのフィラメントが重なり合った部分で、フィラメント間の滑り運動が起こることにより収縮すると考えられています(図1)。ミオシンはアデノシン三リン酸(ATP)をアデノシン二リン酸(ADP)とリン酸(Pi)に分解する酵素で、この時に発生する化学エネルギーを使ってフィラメント間の滑り運動は起こります。ミオシンで作られた太いフィラメントの所々からはミオシンの頭部が突き出ており、アクチンで作られた細いフィラメントとの間にクロスブリッジを作って、細いフィラメント上を滑る力を発生させます。そのためにミオシン頭部には、ATP(赤丸)を分解する酵素活性中心や、アクチンとの結合と解離を起こす部位、さらにはATPのエネルギーをレバーアームと呼ばれる棒状構造の櫂漕ぎ運動に変える変換装置が備わっています(図2)。
これまでのミオシンとアクチンの生化学的研究、X線結晶構造解析による研究、遺伝子操作による蛋白質人工変異を用いた研究結果から、(1)ミオシン頭部がアクチンフィラメントに近づいた時には最初に弱い結合の複合体ができて、その後に強い結合の複合体に変わること、(2)弱い結合から強い結合に変わるところで、図3に示したミオシン頭部の深い割れ目(アクチン結合クレフト)が閉じること、(3)この構造変化が引き金となって、ATPの分解物であるADPとリン酸がミオシンから離れる速度は速くなり、レバーアームの櫂漕ぎ運動が起こる、と想像されていました。また、アクチンとミオシンの複合体の電子顕微鏡を用いた観察により、強い結合の複合体については原子構造モデルが提出されていましたが、弱い結合の複合体の原子構造が分からなかったために、弱い結合から強い結合に変わる過程の解明はあまり進んでいませんでした。つまり、ミオシン頭部がアクチンと結合して、モータードメインの構造変化を起こす力は何か、どうしてレバーアームの櫂漕ぎ運動は起こるのかと言う問いに、アミノ酸残基同士の親和力や反発力、構造変化という分子の超微細構造の言葉を使って答えることは今までできませんでした。
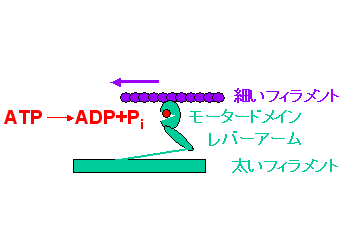 図2 ミオシンの櫂漕ぎ機構ミオシン頭部はモータードメインとレバーアームでできています。モータードメインはATPをADPとPiに分解する時に発生するエネルギーを使って、レバーアームの櫂漕ぎ運動を起こし、アクチンフィラメントを矢印の方向に引っ張る力を生みます。ミオシン頭部には、ATPを加水分解する酵素活性中心、アクチンフィラメントの結合・解離を起こす部位、レバーアームの櫂漕ぎ運動を起こす部位があります。
|
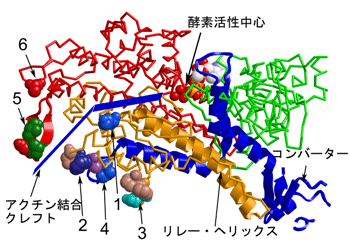 図3 ミオシンのモータードメイン構造モータードメインは緑、赤、オレンジ、青の順序で並んだアミノ酸残基の一続きの鎖でできています。アクチンが結合して、弱い結合から強い結合に変わる時には、赤色で示した(大きな)ドメインとオレンジ色で示した(小さな)ドメインの間が近づいて、アクチン結合クレフトが閉じます。1から6まで番号の球で表現したアミノ酸残基の役割が本研究で明らかになりました(1.弱い結合に関与するリジン残基、2.トリプトファン、フェニルアラニン、プロリンの疎水性トリプレット、3.プロリンに富むループ、4.弱い結合と強い結合の両方に関与するリジン残基、5.心筋症ループ、6.弱い結合に関与するグルタミン酸残基)。
|
<研究の内容>
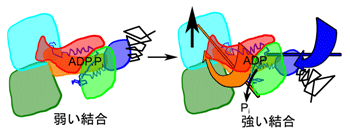
図4 弱い結合から強い結合への変化
ミオシンのモータードメインでアクチンとの接触面にあたる領域のアミノ酸残基を人工的に次々にアラニンに置き換える、いわゆるアラニン・スキャニング注3と呼ばれる蛋白質機能研究法を使って、弱い結合と強い結合にはそれぞれ異なるアミノ酸残基が参加することを本研究チームは発見し、2006年4月に米国科学アカデミー紀要誌で発表しました。この研究により、図3で1~6の番号が付けられた球で表現したアミノ酸残基(ループ)の役割が明らかになりました。具体的には、
本研究ではまず、X線構造解析で得られたミオシンとアクチンの原子構造を使って、アラニン・スキャニングの実験結果を十分説明できる弱い結合の複合体の原子構造モデルを作製しました。このモデルでは、2つのリジンに富むループ領域は2つのアクチンのアスパラギン酸かグルタミン酸残基と結合していて、一つのミオシン頭部が二つのアクチンにまたがって結合していることが分かりました。興味深いことに、この弱い結合で既に疎水性トリプレットはアクチンに近接していることが分かりました。次に、弱い結合と強い結合の複合体を比較することによって、弱い結合から強い結合に変換する時、アクチンとミオシンの接触面に生じた力がミオシン内部の構造にどのような影響を与えるかを考察しました。その結果、トリプレットとプロリンに富む2つの疎水性ループが、アクチン表面にある疎水性アミノ酸残基の並んだレールの上を移動することによって力が発生すること、その力で、図4でオレンジ色に塗られた小さいドメインが矢印方向にねじれて、クレフトを閉じることが明らかになりました。このねじり運動は更に2つの構造変化を引き起こしました。一方では、酵素活性中心の奥の出口を開けるために、先ず閉じこめられていたリン酸が放出され、その後に活性中心全体が開いてADPの放出が続くことが明らかになりました。他方では、ねじり運動の影響は小さいドメインにあるリレー・ヘリックス(図3)に伝わり、コンバーター(図3)を図4の青い矢印の方向に回転するために、レバーアームの櫂漕ぎ運動を起こすことが明らかになりました。以上のように、アクチンの結合で起こるミオシンの力発生の機構が完全に分子レベルで解明されました。
<今後の展開>
ATPをADPとリン酸に分解するミオシンの酵素反応は、少なくとも7つの中間体を経る複雑な過程です。本研究によって、アクチンと結合状態にあるミオシンの反応過程が明らかになって、力発生機構の全容が見渡せるようになりました。その意味で本研究の意義は大きいと考えます。今後は、アクチンとミオシンの複合体のX線構造解析を実現し、分子動力学などコンピューター・シミュレーション技法を使って、分子レベルの機構解明をさらに精密化して行く必要があります。それが完成すれば、初めてエネルギー変換機構が解明されたと言えるでしょう。
生物界には18種類を超えるミオシン・ファミリーが存在しており、筋肉ミオシンと同様に細いフィラメント上を動くことにより機能しています。このファミリーに属するモーターは私達の体のあらゆるところに分布していて、あるミオシンは臓器を形作るための細胞運動や形態形成で重要な役割を担い、また、他のミオシンは細胞内で物の輸送に関係しています。それぞれの機能を対応して部分的に構造は違っているものの、モーター駆動部の構造は非常によく似ており、基本的に同じ機構で動くと考えられます。また、微小管上を動くキネシンもファミリーを形成しており、筋肉ミオシンとよく似た機構で働く分子モーターの1つと考えられます。今後、これらのモーター蛋白質の類似性や相違性の研究が進めば、生命の神秘のひとつである"動き"の本質が解き明かされるでしょう。
心筋ミオシンの突然変異によって、家族性心肥大など重度の遺伝性心疾患が起こります。しかし、それぞれの患者で(突然変異のアミノ酸残基が違うことによって)症状は千差万別であり、治療の難しい病気です。さらに、蝸牛管の繊毛聴覚細胞での繊毛形成や、視覚細胞の形態形成、神経終末に分布して情報伝達物質の放出に関係するモーターなどもミオシン・ファミリーに属していて、このミオシンの突然変異が原因となって聴覚や視覚、発達に障害を起こす疾患が数多く知られています。今回の研究成果は、これらの発症機序の解明や治療方法の開発につながるものと期待できます。
<掲載論文名>
"A Closer Look at Energy Transduction in Muscle"
(筋肉におけるエネルギー変換の微視的観察)
<研究領域等>
この研究テーマが含まれる研究領域、研究期間は以下の通りです。
戦略的創造研究推進事業ERATO型研究
研究領域:「前田アクチンフィラメント動態プロジェクト」
研究総括:前田雄一郎 名古屋大学大学院理学研究科教授/理化学研究所播磨研究所客員主管研究員
研究期間:平成15年度~平成20年度
<用語解説>
バキュロウイルスは昆虫に感染するウイルスです。このウイルスの遺伝子に(外来性の)ニワトリ砂嚢筋ミオシン頭部の遺伝子を挟み込むことにより、これに感染した昆虫細胞の中でミオシン頭部の蛋白質を大量に作らせる方法です。ミオシン頭部のように大きく、しかも複数の鎖で構成されている蛋白質を作りたい時に便利な方法です。
生命を維持するためには心臓は休みなく働き続けなければならない大切な臓器です。しかし、様々な原因で負担がかかると全身に血液を送り届けるために心臓は肥大化を起こします。家族性心筋症は、心臓の蛋白質に突然変異が起こって、収縮・弛緩の機能が低下することが原因となる疾患です。突然変異は子供に遺伝するのでこのように呼ばれます。心筋ミオシンの突然変異は世界で50家系程度見つかっていますが、突然変異のほとんどはミオシン頭部に集中しています。
蛋白質の機能を研究するために、蛋白質を構成する20種類のアミノ酸残基を、遺伝子工学を用いてアラニンに置き換える方法です。特定の残基だけを置換できるので、残基固有の働きを調べたい時に大変に有効です。本研究では、ミオシンの立体構造から狙いを絞ってアミノ酸残基を置換して、1つのミオシン頭部に複数あるアクチン結合ループのそれぞれ固有な役割を調べました。
<お問い合わせ先>
尾西 裕文(おにし ひろふみ)
独立行政法人 科学技術振興機構
ERATO前田アクチンフィラメント動態プロジェクト技術参事
理化学研究所播磨研究所客員研究員
〒679-5148兵庫県佐用郡佐用町1-1-1 独立行政法人理化学研究所内
Tel: 0791-58-1350 Fax: 0791-58-1360
E-mail: 
小林 正(こばやし ただし)
独立行政法人科学技術振興機構
戦略的創造事業本部 研究プロジェクト推進部
〒102-0075 東京都千代田区三番町5 三番町ビル
Tel: 03-3512-3528 Fax: 03-3222-2068
E-mail: 
(報道担当)
独立行政法人科学技術振興機構 広報・ポータル部広報課
TEL:03-5214-8404 FAX:03-5214-8432
独立行政法人理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715