JST 課題達成型基礎研究の一環として、米国のワシントン大学 生物学部の鳥居 啓子 教授(ハワードヒューズ医学研究所 正研究員兼任)らは、異分野融合により新規に技術開発を行い、植物表皮において気孔の数を抑制する機構を分子レベルで明らかにしました。
植物の気孔は、大気中の二酸化炭素を効率よく取り込む通気口で、植物の光合成による物質生産や大気環境に大きな影響を与えています。気孔の形成には「促進」と「抑制」の2つの制御機構があることが知られ、このうち抑制制御に関わる分子として、生体内で情報を伝達する分子「ペプチドホルモン注1)」やその受容体の候補が知られていました。しかし、それらが実際に結合して情報(シグナル)伝達するかどうかは、ペプチドホルモンの構造が複雑なことや、細胞内の転写翻訳機構が複雑であることなどから、全く分かっていませんでした。
鳥居教授らは今回、植物表皮上の実験、特定の受容体を基板の上に固定して並べることができる新開発の「受容体バイオセンサーチップ」を用いた実験から、ペプチドホルモンと受容体が実際に直接結合することを明らかにしました。さらには特定の受容体のシグナル伝達をブロックすることにより、2種類のペプチドホルモンが、それぞれ別の受容体を介して、一方が気孔の発生を、他方が分布を制御することにより、気孔の数を抑制していることを明らかにしました。
本研究成果は、植物の物質生産、地球大気における炭素循環の理解につながります。また将来的には、作物の生産性向上、乾燥地帯などへの環境適応性を制御するペプチド農薬の開発、大気中の二酸化炭素削減などにつながると期待されます。
本研究は、ワシントン大学 生物学部のジンスク・リー 博士研究員ら、および、ワシントン大学 材料科学工学部のメフメット・サリカヤ 教授、ジャンダン・タメルラー 特任教授らとの共同研究で行われ、本研究成果は、2012年1月12日(米国東部時間)に米国科学誌「Genes & Development」のオンライン速報版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「生命システムの動作原理と基盤技術」
(研究総括:中西 重忠 大阪バイオサイエンス研究所 所長) |
| 研究課題名 |
「植物表皮組織における気孔パターン形成の動的ネットワーク」 |
| 研究代表者 |
鳥居 啓子(ワシントン大学 生物学部 教授/ハワードヒューズ医学研究所 正研究員) |
| 研究期間 |
平成20年10月~平成24年3月 |
JSTはこの領域で、 生命システムの動作原理の解明のために新しい視点に立った解析基盤技術を創出し、生体の多様な機能分子の相互作用と作用機序を統合的に解析して、動的な生体情報の発現における基本原理の理解を目指しています。上記研究課題では、生体イメージングやナノ材料工学などの新たな手法を用いて、気孔形成のダイナミクスを明らかにします。
<研究の背景と経緯>
陸上植物の表皮組織、特に葉の裏に多く存在する気孔(図1)は、水や二酸化炭素の通気口であり、気孔口の開閉により植物の光合成や呼吸といった活動を制御しています。このため、気孔のふるまいは陸上植物の繁栄、生存や、地球レベルの大気環境にも大きな影響を与えています。この気孔が正常に開閉するためには、気孔の形成段階において数、密度が適切に制御され、葉の一面に均等に散在するパターンが形成される必要があります。
モデル植物として用いられるシロイヌナズナを含めた双子葉植物では、葉など光合成器官の発生過程において、未分化な表皮細胞の一部が非対称分裂を起こすことにより気孔の形成が開始します。鳥居教授らのこれまでの研究などから、気孔を形成する一連の指令遺伝子(転写因子)や気孔分化を抑制するシグナル伝達因子の存在が明らかになってきました。例えば、気孔を形成する前駆体細胞は2種類のペプチドホルモンEPF注2)とEPF2を分泌していると考えられています。この因子が、隣接する表皮細胞で発現しているERECTAファミリー受容体型キナーゼ(ERECTA受容体、ERL1受容体注3))およびTMM受容体注4)と関連して 気孔の数と分布を調節し、無制限に作られないようにしていると考えられてきました。しかし、ペプチドホルモンにしても受容体にしても、飽くまで気孔形成を抑制する因子の「候補」にしか過ぎず、これらペプチドホルモンが本当に受容体と結合するのか、また結合する場合にはどのペプチドホルモンが受容体に対応するのか、さらには、どのような相互作用により気孔のパターンが生じるのかなど全く分かっていませんでした。これらの解析が遅れていた背景として、EPFホルモンは複雑な立体構造を作るために活性のある状態での大量生産が困難であること、ERECTA受容体、ERL1受容体などのERECTAファミリー受容体型キナーゼ遺伝子は複雑な転写翻訳制御を受けており、植物以外の細胞で安定に作ることが難しいこと、などがありました。
<研究の内容>
鳥居教授らは、まず候補となっているペプチドホルモンと受容体が、生体中で結合するかどうか調べるために、目印を付けた3種類のシロイヌナズナ受容体(ERECTA、ERL1、TMM)および2種類のペプチドホルモン(EPF1、EPF2)をタバコ表皮細胞に導入しました。そして、生化学的手法(免疫共沈降法)注5)により、これらのペプチドホルモンがERECTA受容体とERL1受容体に強く結合すること、その一方でTMM受容体への結合は限られていること発見しました。
次に、詳細な解析を進めるため、鳥居教授らは、大腸菌で生産したペプチドホルモン(EPF1、EPF2)をうまく巻き直す手法の開発に成功し、活性を持つ正しい形のペプチドホルモンが大量に得られるようになりました(ペプチドが生物活性を持つには、細胞内でまずアミノ酸の鎖として作られた後、正しい形に巻かれる必要があります)。この活性EPF1ホルモンとEPF2ホルモンをシロイヌナズナ植物表皮に散布すると、EPF1ホルモンは気孔の前駆体細胞の分化を阻害し、EPF2ホルモンは気孔になる細胞集団を作る最初の細胞分裂を阻害する、という生物活性を示しました(図2)。
次に、ワシントン大学と共同で、ペプチドホルモンと受容体の結合を生体外で詳しく解析するために、植物から精製したERECTA受容体、ERL1受容体、TMM受容体をそれぞれ固層化した「受容体バイオセンサーチップ」を開発しました(図3)。QCM(水晶天秤)注6)、表面プラズモン共鳴(SPR)注7)という2つの解析技術を用いて、各々のチップ上に活性EPF1ホルモンと活性EPF2ホルモンを投与することにより、ERECTAファミリー受容体型キナーゼ(ERECTA、ERL1)がEPF1ホルモンとEPF2ホルモンと高い親和性を持って結合することを明らかにしました。一方、TMM受容体はEPF1ホルモンと結合能はないものの、EPF2ホルモンとは結合可能という結果を得ました。
さらにERECTAファミリー受容体キナーゼは、植物内でホモ2量体およびTMM受容体とのヘテロ2量体を作る一方、TMM受容体はホモ2量体を作らないことを明らかにしました。一般にERECTAファミリー受容体型キナーゼやTMM受容体は、ホモ2量体を形成することで活性化することから、ERECTAファミリー受容体型キナーゼがEPFホルモンの受容体であり、TMM受容体はシグナル受容と伝達を調節する役割を持つことが示唆されました。
これらの結果からEPF1ホルモンとEPF2ホルモンがERECTAファミリー受容体部位に直接結合することが明らかになりましたが、その一方で、生体内で実際にどの受容体がどのペプチドホルモンに結合してシグナルを伝達するのかが分かっていませんでした。そのため、鳥居教授らは、不活性なERECTA受容体とERL1受容体(ドミナントネガティブ型受容体注8))を発現させた植物体を作って植物体内でそれぞれの受容体由来のシグナル伝達を選択的に阻害したところ、ERECTA受容体を阻害した植物は活性EPF2ホルモンを認識できなくなり、ERL1受容体を阻害した植物は、逆に活性EPF1ホルモンを認識できなくなりました。これらの結果から、EPF2-ERECTAそしてEPF1-ERL1というリガンド(ホルモン)-受容体のペアが、気孔形成の開始と気孔前駆体細胞の分化という2つの重要なステップを制御していることが判明しました(図4)。
<今後の展開>
今回の成果により、今までその理解が混迷を極めていた気孔パターン形成のシグナル受容メカニズムが明らかになりました。本成果は、受容体バイオセンサーチップの開発や活性ペプチド大量生産など、植物科学と生化学・ナノバイオマテリアル科学という異分野の融合によってもたらされたものです。今後、気孔形成の2つのステップを制御することが可能になると考えられ、乾燥耐性や二酸化炭素吸収に優れたバイオマス作物を開発できるかもしれません。また、ペプチドホルモンを農薬として安価に大量生産することで、遺伝子組換えを介さない、塗布による作物の生産性、乾燥耐性を制御する技術への応用が期待されます。
<参考図>
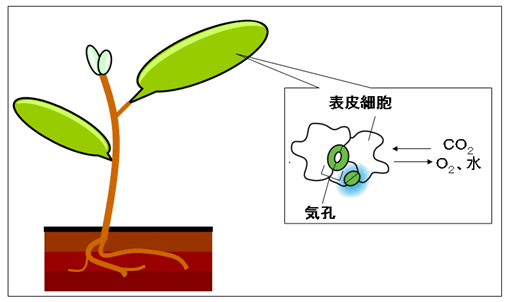
図1 気孔の役割
気孔は、植物体の、特に葉の裏に多く存在する通気口です。気孔を通して、光合成に必要な二酸化炭素(CO2)の取り込み、光合成で生じた酸素(O2)の放出、根から吸収した水分の蒸散が行われます。気孔口は、一対の孔辺細胞(緑)によって開閉が制御されていて、植物の光合成や呼吸といった活動に影響を与えます。正常な開閉には、気孔の形成段階において数、密度が適切に制御され、葉の一面に均等に散在するパターンが形成される必要があります。
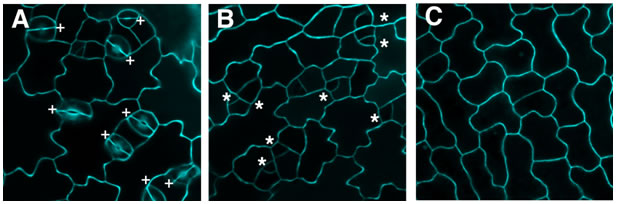
図2 組換え大腸菌を使って生産したEPFホルモンによる気孔の形成阻害作用
シロイヌナズナ芽生え表皮(A-C)にEPF1ホルモンを散布すると、気孔の前駆体細胞(星印)は形成されますが、気孔への分化を停止します(B)。一方、EPF2ホルモンを散布すると、前駆体細胞自体がそもそも発生しません(C)。対照区(A)では、正常に気孔の分化(+印)が認められます。
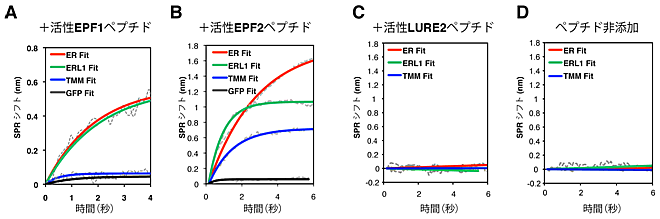
図3 受容体バイオセンサーチップを用いたEPFホルモンの結合動態
受容体(ERECTA(赤)、ERL1(緑)、TMM(青))およびコントロールたんぱく質(黒)をそれぞれチップ表面に結合させ、チップに活性EPF1、2ホルモンを含んだ溶液を通過させることで、受容体との結合様式を明らかにすることができます。例えば、EPF1ホルモン(A)は、ERECTA受容体、ERL1受容体と結合しますが、TMM受容体とは結合しません。気孔形成と全く関係ないペプチドLURE2(C)は、どの受容体とも結合せず、ペプチドを含まない対象区(D)と同じような反応を示します。
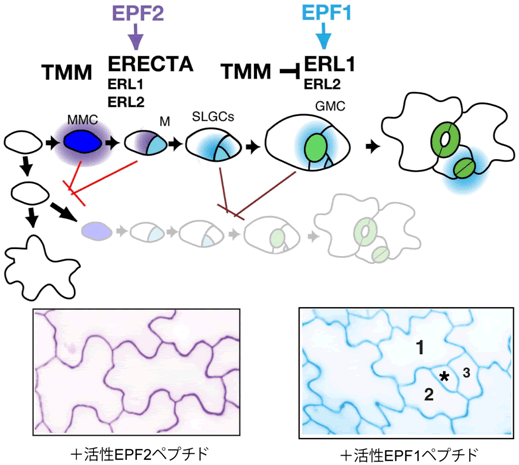
図4 EPFホルモンと受容体による気孔の発生と分布の制御
モデル植物シロイヌナズナでは、気孔の形成は表皮の一部の未分化細胞が気孔への分化能を獲得し、メリステモイド母細胞(MMC:藍)になることにより開始します。この細胞は非対称分裂を起こします。それにより生じた気孔の前駆体幹細胞であるメリステモイド細胞(M:水色)は、非対称分裂を繰り返し、自らを再生するとともにまわりに姉妹細胞(SLGC)を生み出します。その後、メリステモイド細胞は孔辺母細胞(GMC:緑)へと分化します。GMCが均等に分裂することにより一対の孔辺細胞が通気口を囲んだ気孔が完成します(緑:右端)。
本研究によって、気孔の形成は以下の通り抑制されていると分かりました。EPF2ホルモン(紫)は、気孔へと分化し始めた初期の細胞(MMC、M)から分泌され、主にERECTA受容体を介して隣接する細胞が気孔を形成し始めないように制御します(赤線)。一方、EPF1ホルモン(水色)は気孔後期の前駆体細胞(M、GMC)から分泌され、主にERL1受容体を介して気孔が隣接してできないよう、分布を制御します(赤紫線)。活性EPF2ホルモンで処理した植物では、気孔への分化が始まりません(下左)。活性EPF1ホルモン処理した植物では、非対称分裂(順番に1-3)を行いますが、その後、分化を停止します(星印)(下右)。
<用語解説>
- 注1) ペプチドホルモン
- ペプチド性生理活性物質。近年、植物においても動物と同様に、種々のペプチド性生理活性物質が生産・分泌され、植物の発生や生長、ストレス応答などに関わっていることが分かっています。
- 注2) ペプチドホルモンEPF
- EPFはディフェンシン様の分泌性ペプチドで、システイン残基を8もしくは6残基持ち、それらがジスルフィド結合により立体構造を作ることで気孔の数や分布を制御しています。モデル植物シロイヌナズナには、11のEPFファミリー遺伝子が存在し、今回扱ったEPF1ホルモンとEPF2ホルモンは気孔の分化を阻害しますが、逆に、EPF Like9(EPFL9)/Stomagen(ストマジェン)は気孔を作ることが知られています。
- 注3) ERECTA受容体、ERL(ERECTA様)受容体
- 細胞膜貫通型の受容体型セリン・スレオニンキナーゼの一種で、ERECTAファミリーたんぱく質の一種。細胞外には、ロイシンに富む繰り返し配列(LRR領域)からなる受容体部位を持ち、これはヒトの自然免疫受容体と類似した構造をしています。シグナル分子が結合すると、ERECTAならERECTA同士、ERLならERL同士で結合し、シグナルを細胞内に伝達します。キナーゼとはたんぱく質中のアミノ酸にリン酸基を付与する酵素の総称です。
- 注4) TMM受容体
- EPFなど特定のペプチドホルモンと相互作用し、植物の気孔の形成などに関わると考えられている受容体様たんぱく質。TMMはTOO MANY MOUTHS (口が沢山ありすぎ)という英語の略で、気孔が沢山あるためそのように名付けられました。
- 注5) 生化学的手法(免疫共沈降法)
- 細胞内においてあるたんぱく質が別のたんぱく質と複合体を作っているかどうか、抗原抗体反応を利用して調べる方法です。例えば、細胞抽出液に、ビーズなど担体と架橋した抗たんぱく質A抗体を混ぜ、たんぱく質Aを回収(アフィニティー精製)します。もしたんぱく質Bがたんぱく質Aと複合体を作っていた場合、同時にたんぱく質Bも精製されることになります。この手法は、生きた細胞内の環境に近い生理学的に意味のある状態でたんぱく質相互作用を確認できるというメリットがあります。
- 注6) QCM(Quartz Crystal Microbalance)
- 水晶天秤・水晶センサーとも呼ばれます。時計のムーブメントにも使われる水晶は一定条件で安定に振動します。QCMは、水晶振動子の電極の表面において、たんぱく質などの物質が付着することによる微量な質量変化を、振動子の共振周波数の変化(低下)として正確にとらえることができる計測センサーです。本研究では、水晶振動子チップの表面にERECTA受容体、ERL1受容体、TMM受容体をそれぞれ固層化したバイオセンサーを作成し、チップ上に活性EPFホルモン溶液を流し共振周波数の変化をリアルタイムに観測しました。ペプチドホルモンと受容体が相互作用すると、周波数が低下します。
- 注7) 表面プラズモン共鳴(SPR:Surface Plasmon Resonance)
- 金属中の電子密度はダイナミックに変化しており、振動波(プラズマ波)を作ります。金などの薄膜に一定の角度でレーザー照射し、表面プラズモンを共鳴させることにより、高感度な物質相互作用をリアルタイムに計測するセンサーとして使うことができます。本研究では、金粒子をコートしたチップの表面にERECTA受容体、ERL1受容体、TMM受容体をそれぞれ固層化したバイオセンサーを作成し、チップ上に成熟EPFペプチド溶液を流し、表面プラズモン波の変化(リガンド-受容体相互作用)をリアルタイムに計測しました。
- 注8) ドミナントネガティブ型受容体
- 細胞膜貫通型の受容体キナーゼは、本来、細胞外でリガンドと結合することによりシグナルを受け取り、たんぱく質リン酸化を介して細胞内へ情報を伝えています。細胞内のキナーゼ部位のみを欠損させた受容体キナーゼは、シグナルを受け取ることはできるものの、受けた情報を伝達することができません。さらには、正常な受容体キナーゼと不活性な二量体を作ることにより、正常な受容体キナーゼの活性すら阻害します。そのため、優性(ドミナント)に負(ネガティブ)の働きをする受容体となります。
<論文名>
“ Direct Interaction of Ligand-Receptor Pairs Specifying Stomatal Patterning ”
(気孔のパターンを制御するリガンド-受容体ペアの直接相互作用)
doi: 10.1101/gad.179895.111
<お問い合わせ先>
<研究に関すること>
鳥居 啓子(トリイ ケイコ)
ワシントン大学 生物学部 教授(ハワードヒューズ医学研究所 正研究員兼任)
Department of Biology, Hitchcock Hall 544, University of Washington,
Seattle, WA 98195 USA
Tel:+1-206-221-5702 Fax:+1-206-685-1728
E-mail:
<JSTの事業に関すること>
原口 亮治(ハラグチ リョウジ)、木村 文治(キムラ フミハル)、落合 恵子(オチアイ ケイコ)
科学技術振興機構 イノベーション推進本部 研究推進部(研究推進担当)
〒102-0076 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3525 Fax:03-3222-2067
E-mail: