ポイント
- 被験薬のヒトでの副作用・有害事象および効能を、薬の種類を問わずに予測できる、モダリティ・インディペンデントなAIシステムの開発に成功。
- 被験薬を投与したマウスの全身網羅的なトランスクリプトームのみを指標とし、被験薬の構造、標的などの情報を必要としない、バイアス・フリーなシステム。
- 学習データを層別化することで、性別、年齢層ごとの副作用の発生予測が可能。
JST 戦略的創造研究推進事業(ERATO) 佐藤ライブ予測制御プロジェクトの基礎研究成果と基盤技術の実用化を目的とするKarydo TherapeutiX株式会社(代表取締役 佐藤 匠徳)は、株式会社国際電気通信基礎技術研究所(ATR) 佐藤匠徳特別研究所(所長 佐藤 匠徳:奈良県立医科大学 生体5次元インフォマティクス国際統合ハブ(V−iCliniX) 教授(寄付講座))と共同で、医薬品や機能性飲料・食品の副作用・有害事象および効能を、その物質の構造や作用メカニズム、標的などの情報なしで高精度に予測できるAIシステムの開発に成功しました。
AIシステム「hMDB」(humanized Mouse DataBase)は、ある物質を投与したマウスの全身網羅的なトランスクリプトーム注1)データを指標に、その物質がヒトで起こす副作用や効能を予測するシステムです。
またhMDBを発展させ、性別、年齢層別に副作用・有害事象とその発生頻度を予測できる「hMDB−i」(humanized Mouse DataBase, individualized)と、ドラッグ・リポジショニング注2)への活用が期待できる「hMDB/LP法」(hMDB/Link Prediction法)を開発しました。
hMDBとhMDB/LP法の予測能を検証した結果、医薬品開発で主流な予測システムの1つである「LINCS L1000」(提供元:アメリカ国立衛生研究所(NIH))などの複数の既存AI予測システムより高い予測能を示しました。
これらAIシステムは現在、バーチャル創薬、バーチャル治験注3)プラットフォームの1つとして事業化されており(特許出願済)、現在は、「究極のローリスク、ローコストの医薬品開発ツール」を目指した、さらなる開発が進められています。
本研究成果は、2020年1月9日(米国東海岸時間)に、「iScience」(Cell Press)オンライン速報版で公開されます。
本研究成果は、以下の事業における研究の一環として得られました。
- ◆科学技術振興機構(JST) ERATO 「佐藤ライブ予測制御プロジェクト」(JPMJER1303)
- ◆公益財団法人京都産業21 平成30年度次世代地域産業推進事業(「hMDBに基づくインテリジェント医薬品開発プラットフォーム提供事業」)
- ◆公益財団法人中谷医工計測技術振興財団 技術開発研究助成【長期大型研究】(「生体5次元情報」を解読する医工計測技術を創出する「知・もの・人」づくり計画)
<研究の背景と経緯>
医薬品開発の現場では、前臨床・非臨床試験(培養細胞や動物での試験)で副作用の少ないことや効能を確認しますが、それらを検証できた被験薬注4)の約90パーセントが、その後、治験(ヒトにおける試験)で、副作用が生じる、または有効性が認められないなどの理由で開発中止になっています。開発中止による損失は1被験薬あたり150億〜2,000億円程度であるといわれており、昨今の医薬品の価格高騰の一因とされていることから、現在、医薬品開発のローリスク、ローコスト化が急務となっています。
治験で前臨床・非臨床試験と同じ結果を得られない主な原因は、細胞およびヒト以外の動物(マウス、ラット、ブタ、サルなど)とヒトとの「種差」に由来するため、これまでにも種差を解消するための手法注5)が数多く開発されてきました。しかし、いずれも種差に由来するこの問題を根本的に解決するには至っていません。
本研究グループは、2018年に全身網羅的な多臓器連関トランスクリプトーム地図(i−Organs Atlas注6))を完成させました。また、i−Organs Atlasと、新たに計測したマウスの全身網羅的な遺伝子発現パターン(トランスクリプトーム)とを照合することで、疾患の発症・重症化の仕組みや医薬品の作用を鮮明に映し出せることを発見しました(Kozawa, S. et al., iScience, 2:238-269, 2018)。そして今回、i−Organs Atlasを用いた医薬品の作用予測の実現を目的として、humanized Mouse DataBase(hMDB)というAIシステムを確立しました(図1)。
hMDBは、次の手順で、その物質がヒトで起こす副作用や効能を高精度で予測します。マウスなど動物でしか試験せずに、その試験結果として「ヒトにおける試験」での結果を出力させる、という手法です。
<手順>
- (1)現在流通しているさまざまな医薬品を投与したマウスなど動物に起こる全身網羅的な遺伝子発現パターンと、それぞれの医薬品について世の中で実際に報告されているヒトでの副作用および効能の情報(リアルワールドデータ)とを対応づけて計算機に学習させる。
- (2)ヒトへの作用が未知の物質(被験薬など)をマウスなど動物に投与し、全身網羅的な遺伝子発現パターンを計測した情報を、上記(1)の計算機に入力する。(その結果、その物質がヒトで起こす副作用や効能の予測が出力される)(図1)。
このhMDBの有効性を検証したのが本研究です。
<研究の内容>
本研究では、医薬品15種について、hMDBの有効性を検証しました(図2)。
その結果、医薬品の構造やその標的に関係なく、その医薬品をマウスに投与し、全身網羅的な多臓器の遺伝子発現パターンを計測して計算機に入力することで、①副作用・有害事象5,519項目それぞれの発生有無およびその頻度、②世の中に知られている疾患11,312種類への効能の有無を予測できることが示されました。
また、性別、年齢層で層別化した各医薬品のヒトにおける副作用データを計算機に学習させることにより、性別、年齢層別に副作用・有害事象とその発生頻度を予測できることが示されました(図1)。層別化データを用いてhMDBで各層の予測を行う手法を「humanized Mouse DataBase, individualized(hMDB−i)」と命名しました。
効能の予測においては、hMDBに、各医薬品と、その投与により生じることが実社会(リアルワールド)で報告されている有害事象とをリンク予測(Link Prediction)注7)で関連づけることにより(この手法を「hMDB/LP法」と命名しました)、対象医薬品の既知の効能はもとより、これまで報告例のない効能を予測できることが示されました。これは、本手法がドラッグ・リポジショニングに活用できることを示唆しています。
hMDBによる副作用・有害事象の予測においては、AIの思考回路をのぞき見ることで、医薬品のどのような特徴をAIが捉えて予測を出力したのかを紐解くことができ、その特徴を解析することで、各医薬品の予測される副作用、有害事象発生の生物学的メカニズムを推論できることが示されました。
本研究グループが開発したhMDBおよびhMDB/LP法は、予測能の比較において、医薬品開発で主流となっている予測システムの1つである「LINCS L1000」(提供元:アメリカ国立衛生研究所(NIH)、http://lincsproject.org)など複数の既存AI予測システム(医薬品に付随する構造、遺伝子発現、標的、相互作用など多数の特徴をAIで解析して副作用や効能を予測するシステム)より優れた予測能を示しました。
<今後の展開>
今回、hMDB、hMDB/LP法がモダリティ・インディペンデント注8)かつバイアス・フリー注9)で医薬品の副作用・有害事象および効能を高精度に予測できることを実証しましたが、なぜその予測が可能なのかといった仕組みの理解は、まだ十分ではありません。
そこで本研究グループは、全身網羅的な複数臓器の遺伝子発現パターンが、生体およびリアルワールドのさまざまな情報とリンクしており、この遺伝子発現パターンがこれら他の複雑系情報を映し出す「万華鏡」のような役目をしているとの仮説に基づき、その仕組みの解明に取り組んでいます。
また、本研究で開発したhMDBおよびhMDB/LP法を活用したバーチャル創薬、バーチャル治験は、Karydo TherapeutiX株式会社が事業化していますが、さらに「究極のローリスク、ローコストの医薬品開発ツール」の創出を目指して、現在、次世代バージョンのhMDB、hMDB/LP法の開発を進めています。
<参考図>
-
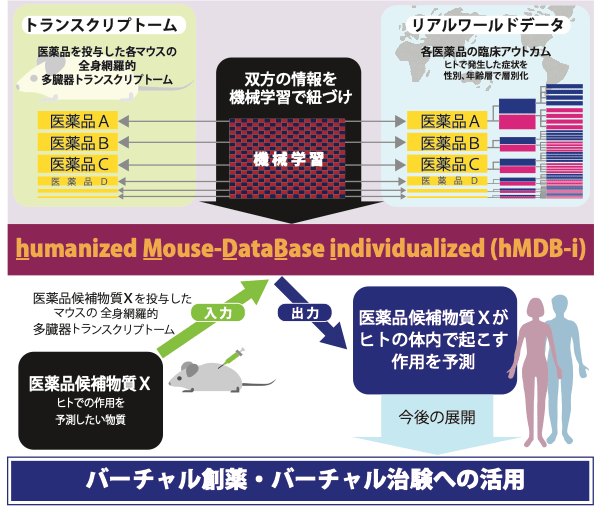
図1 「hMDB−i」(humanized Mouse DataBase, individualized)の仕組み hMDBは、現在市場に流通している医薬品(図中:医薬品A、B、C…)を野生型マウスに投与して得られる全身の24臓器の遺伝子発現パターン(トランスクリプトームデータ)と、各医薬品で実際に報告されている副作用・有害事象および効能の情報(リアルワールドデータ)をAIで紐づけすることで構築される、「ヒト化された状態の、マウスのデータの、データベース」です。このデータベースに、ヒトで何が起こるかまだ不明な研究開発中の被験薬(図中:医薬品候補物質X)を野生型マウスに投与して得られる全身の24臓器のトランスクリプトームデータを入力すると、結果として、医薬品候補物質Xがヒトで引き起こす副作用・有害事象や、ヒトでの効能の予測が出力されます。これを発展させ、性別、年齢層で層別化した形式で副作用・有害事象をAIに学習させることで、層別化されたhMDBを構築できます。これをhumanized Mouse DataBase, individualized(hMDB−i)と呼びます。このhMDB−iに、医薬品候補物質X被投与マウスの24臓器のトランスクリプトームデータを入力することで、例えば、「医薬品候補物質Xの投与によって、20代男性の1パーセントで心毒性が発症するが、50代女性では10パーセントで発症する」というように、層別化された形式で予測が出力されます。
-
分子化合物 Alendronate
Aripiprazole
Cisplatin
Doxycycline
Lemalidomide
Olanzapine
SofosbuvirAcetaminphen
Asenapine
Clozopine
Empagliflozin
Lurasidone
Risedronate
中分子(ペプチド) Teriparatide 抗体医薬
(高分子たんぱく質)Evolocumab(Repatha) 図2
<用語解説>
- 注1)トランスクリプト―ム
- 特定の状況下において細胞中に存在する全てのmRNA(ないしは一次転写産物)の総体。
- 注2)ドラッグ・リポジショニング
- 市販実績があり臨床レベル(ヒトにおける試験)での安全性と体内動態が確認されている既存薬から別の疾患に有効な新しい薬効を見つけだし、その疾患への適用に向けて開発しようする研究手法。大きな利点は、確実性(ヒトでの安全性などが確認済)と、低コスト性・時短性(多くの既存データを再利用できる)にあり、現在、頭打ち状態にある新薬開発の現状を打破する手法と期待されている。
- 注3)治験
- ヒトに対する効果と安全性を調べるための、ヒトにおける試験(「臨床試験」)のうち、国の承認を得るための成績を集めるもの。
- 注4)被験薬
- 治験の実施対象となる、開発中の未承認薬。
- 注5)種差を解消するための手法
- ①ヒトiPS細胞由来の心筋細胞、肝細胞など各種ヒト細胞での試験、②Organ-on-a-chipなどヒトiPS細胞を分化させミニチュア臓器を用いた試験、③ヒト化動物モデルでの試験、④医薬品の構造や作用機序の情報を必要とする(モダリティ・インディペンデント、バイアス・フリーではない)AIなどのin silicoシステム。
- 注6)i−Organs Atlas
- 心臓疾患、腎臓疾患、糖尿病、がん、若年性認知症の発症から悪化までの病態動態を反映するマウスの各種病態モデルにおいて、全身を網羅する13~23種の器官での、初期から後期までの遺伝子発現の変化をゲノム網羅的に計測・解析して、本研究グループが2018年に作成した全身網羅的多器官遺伝子発現地図。
- 注7)リンク予測(Link Prediction)
- 将来的なネットワークの成長を予測するために用いられる、ネットワーク分析の手法の1つ。ネットワークを、ノード(節点)群とノード間のつながりを表すリンク(エッジ)群からなるグラフ構造と捉え、このグラフ構造に対して、ある2ノード間にリンクがあるかどうかを予測する。現在さまざまな目的で応用されており、WEBの検索機能や、SNSでの友達の発見、通販サイトのリコメンデーションシステムへの応用、生物学分野では遺伝子やタンパク質の新たな相互作用ネットワークの予測などに利用されている。
- 注8)モダリティ・インディペンデント
- 低分子化合物、中分子(ペプチドなど)、高分子(抗体医薬など)、核酸医薬、細胞療法などの治療方法や薬のタイプを問わないこと。
- 注9)バイアス・フリー
- 特定の仮説や知見に依存せずに検証・試験を行うこと。
<論文タイトル>
- “Predicting Human Clinical Outcomes Using Mouse Multi−Organ Transcriptome”
(マウスの多臓器トランスクリプトームによる医薬品のヒト臨床アウトカムの予測) - 著者名:Satoshi Kozawa, Fumihiko Sagawa, Satsuki Endo, Glicia Maria De Almeida, Yuto Mitsuishi, Thomas N.Sato
- DOI:10.1016/j.isci.2019.100791
<お問い合わせ先>
-
<研究に関すること>
Karydo TherapeutiX株式会社 研究開発担当
〒619−0288 京都府相楽郡精華町光台二丁目2番地2(けいはんな学研都市)
E-mail:contactkarydo-tx.com
URL:https://karydo-tx.comERATO 佐藤ライブ予測制御プロジェクト
株式会社国際電気通信基礎技術研究所(ATR) 佐藤匠徳特別研究所 担当
〒619-0288 京都府相楽郡精華町光台二丁目2番地2(けいはんな学研都市)
Tel:0774-95-2312 Fax:0774-95-2329
E-mail:ESATOHQatr.jp
-
<JST事業に関すること>
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:eratowwwjst.go.jp
-
<報道担当>
杉坂 恵子(スギサカ ケイコ)
Karydo TherapeutiX株式会社 管理部
〒102-0082 東京都千代田区一番町6
Tel:03-6671-9094
E-mail:sugisakakarydo-tx.com
URL:https://karydo-tx.com株式会社国際電気通信基礎技術研究所(ATR) 経営統括部 企画・広報チーム
〒619-0288 京都府相楽郡精華町光台二丁目2番地2(けいはんな学研都市)
Tel:0774-95-1176 Fax:0774-95-1178
E-mail:pratr.jp
URL:https://www.atr.jp科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkohojst.go.jp
