ポイント
- ヒト細胞の薬物応答を遺伝子レベルで明らかにすることは、創薬の重要課題である。
- 薬物応答を示す遺伝子発現パターンを高精度で予測する機械学習手法を開発した。
- 薬物のメカニズム解明や薬効予測などさまざまな用途への活用が期待できる。
九州工業大学 大学院情報工学研究院の山西 芳裕 教授らの研究グループは、理化学研究所 革新知能統合研究センターのZHAO Qibin ユニットリーダーらの研究グループ、田部井 靖生 ユニットリーダーとの共同研究により、多様なヒト細胞における薬物応答の遺伝子発現パターンを高精度に予測する新たな情報技術を開発しました。
ヒト細胞における薬物応答の遺伝子レベルでの理解は創薬の重要課題ですが、すべての薬物やヒト細胞の組み合わせに対して網羅的に観測することは困難であり、未観測値や欠損値が解析上の障害となっていました。本研究グループは、薬物応答遺伝子発現データを、薬物、遺伝子、細胞、時系列からなるテンソル構造と見なし、新しいテンソル分解アルゴリズムを用いて、さまざまな細胞における未観測の薬物応答を予測する機械学習手法を開発しました。これにより、薬物の効能を高精度に予測することが可能になることを示しました。開発手法は、薬物の作用メカニズムの解明、薬効予測、医薬品候補化合物の探索などに活用できるため、医薬品開発に大きく貢献することが期待されます。
本研究成果は、2019年7月8日(英国時間)に英国科学誌「Bioinformatics」のオンライン版で公開されます。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ「社会と調和した情報基盤技術の構築」研究領域(研究総括:安浦 寛人)における研究課題「エコファーマによる高速かつ省エネ創薬を実現する情報技術の構築」(研究者:山西 芳裕)、および戦略的創造研究推進事業 AIP加速研究(AIP加速PRISM研究*)における研究課題「創薬標的分子の確からしさを検証するツール物質の探索」(研究代表者:山西 芳裕)の研究の一環で行われました。
*本事業は、官民研究開発投資拡大プログラム(PRISM)の一環で行うものです。
<研究の背景と経緯>
ヒト細胞の薬物応答を遺伝子レベルで明らかにすることは、創薬における重要課題です。多くの薬物は、疾患で破綻した生体システムを正常な方向に制御することで、疾患の治療に寄与しています。薬物によって誘導される細胞の状態は、遺伝子の発現パターンによって特徴付けられます。その細胞状態を反映した薬物応答遺伝子発現データ注1)は、薬物の作用メカニズムの解明や薬効の予測などにとって有用であり、さまざまな目的で活用されてきています。
近年、さまざまなヒト細胞における薬物応答遺伝子発現データが測定されるようになってきました。しかしながら、薬物応答遺伝子発現データの取得には、多大のコストと時間を要するため、すべての薬物やヒト細胞の組み合わせに対して網羅的に観測することは困難です。そのため、薬物応答遺伝子発現データは多くの欠損値や未観測値を含んでおり、創薬現場では網羅的な解析を行う上で障害となっていました。
<研究の内容>
九州工業大学 大学院情報工学研究院の山西 芳裕 教授、岩田 通夫 博士研究員らの研究グループは、理化学研究所 革新知能統合研究センターのZHAO Qibin ユニットリーダー、YUAN Longhao 氏、田部井 靖生 ユニットリーダーとの共同研究により、多様なヒト細胞における薬物応答の遺伝子発現パターンを高精度に予測する新たな情報技術を開発しました(図1)。
本研究では、薬物応答遺伝子発現データを、薬物、遺伝子、細胞、時系列からなるテンソル注2)構造と捉え、新規のテンソル分解手法であるTensor-train weighted optimizationアルゴリズムを用いて、さまざまな細胞における未観測の薬物応答を予測する機械学習手法を開発しました。薬物の効能予測に応用し、開発手法が効能予測の性能の向上に大きく寄与することを示しました。
まず、薬物、細胞、遺伝子からなる3階のテンソル構造である薬物応答遺伝子発現データにおける未観測値予測性能を評価するため、観測値を人工的に欠損値と見なし、観測値を正しく再現できるか調べました。その結果、提案手法は、従来手法に比べて最大約1.5倍の精度で欠損値を補完することができることを見いだしました(図2)。また、薬物応答遺伝子発現パターンは時間的にも変化するので、薬物、細胞、遺伝子、時系列からなる4階のテンソルを構築し、同様の性能評価を行いました。その結果、提案手法は、特に高階テンソル構造のデータに対する有効性を示しました(従来手法に比べて最大約2倍の精度向上)。
次に、欠損値を補完した薬物応答遺伝子発現データを、薬物の効能の予測に応用しました。これにより、欠損値が多い細胞ほど、効能予測の性能が大きく向上し、最大約20%性能が向上することを示しました(図3)。さらに、1483個の薬物を16種類のヒト細胞に添加して得られた薬物応答遺伝子発現データに提案手法を適用し、駆虫薬であるニクロサミドの成人T細胞白血病に対する効能など、さまざまな疾患に効能があると期待される薬物を選び出しました。そして、その新しく予測された薬物の効能についての妥当性を、近年の文献や臨床報告で確認することができました。
<今後の展開>
多様なヒト細胞における薬物応答を予測する新たなアプローチを提示することにより、薬物の作用メカニズム解明や薬効予測、ツール化合物の探索など、創薬現場での医薬品開発の促進が期待されます。
今後は、アルゴリズムを改善して予測の信頼性や計算効率を向上させていくとともに、既承認薬だけでなく合成化合物や天然化合物などあらゆる化合物にも解析対象を広げ、さまざまな疾患に対する医薬品候補化合物を探索していく予定です。また、特定の遺伝子を過剰発現またはノックダウンしたときの細胞状態のデータや疾患患者のマルチオミクスデータなど、テンソル構造として解釈することができるさまざまな医薬ビッグデータにも開発手法を適用し、創薬応用や医療応用につなげていく予定です。
<参考図>
-
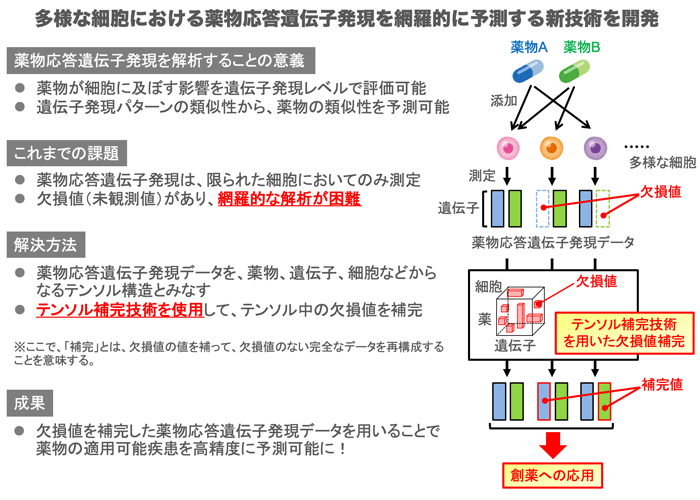
図1 本発表の概要 -
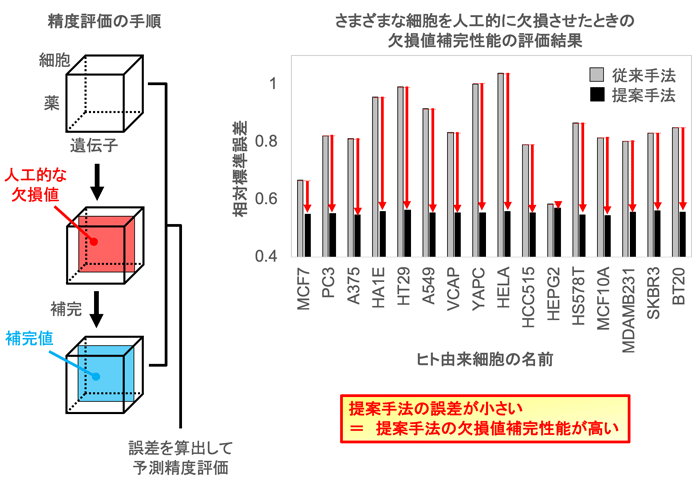
図2 提案手法は、従来の手法に比べて、テンソル中の欠損値補完性能が高い -
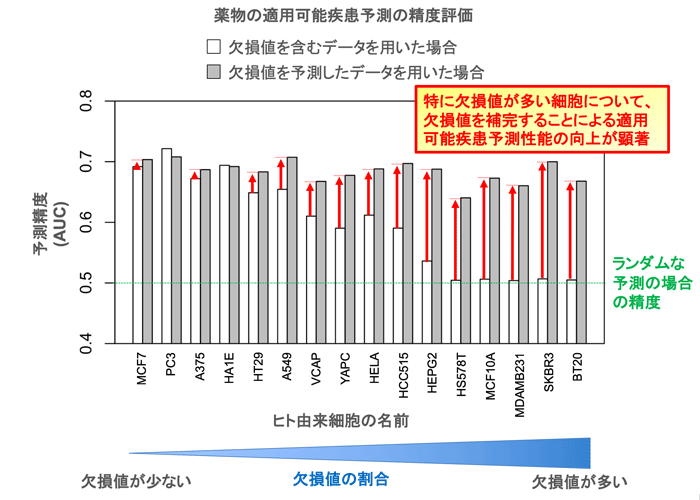
図3 提案手法により欠損値を補完した遺伝子発現データは、創薬においても有用
<用語解説>
- 注1)薬物応答遺伝子発現データ
- 薬物の影響により、遺伝子の発現量がどのように変化したのかを示す実数値からなるデータ。
- 注2)テンソル
- 数値を多次元の配列に配置したもの。例えば、スカラー(1点における数値)は0階のテンソル、ベクトルは1階のテンソル、行列は2階のテンソルとなる。
<論文タイトル>
- “Predicting drug-induced transcriptome responses of a wide range of human cell lines by a novel tensor-train decomposition algorithm”
- 著者名:Iwata. M, Yuan. L, Zhao. Q, Tabei. Y, Berenger. F, Sawada. R, Akiyoshi. S, Hamano. M, and Yamanishi. Y
- DOI:10.1093/bioinformatics/btz313
<お問い合わせ先>
-
<研究に関すること>
山西 芳裕(ヤマニシ ヨシヒロ)
九州工業大学 大学院情報工学研究院 生命化学情報工学研究系 教授
Tel:0948-29-7821 Fax:0948-29-7801
E-mail:yamanibio.kyutech.ac.jp
-
<JST事業に関すること>
舘澤 博子(タテサワ ヒロコ)
科学技術振興機構 戦略研究推進部 ICTグループ
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:prestojst.go.jp
-
<報道担当>
九州工業大学 総務課 広報企画係
Tel:093-884-3008 Fax:093-884-3015
E-mail:sou-kouhoujimu.kyutech.ac.jp
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:ex-pressriken.jp
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkohojst.go.jp
