ポイント
- 雌マウスは、仔マウスの涙液中に含まれるフェロモンESP22(Exocrine gland-Secreting Peptide 22)を受容すると、雄のマウント行動(求愛)を拒否する(雌マウスの性行動が抑制される)ことが明らかになりました。
- ESP22は生後2~3週令において時期特異的に仔マウスの涙液中に発現する幼少フェロモンで、その受容体は、フェロモンを受容する鋤鼻(じょび)神経細胞に発現するV2Rp4(Vmn2r115)であることがわかりました。また、ESP22がV2Rp4に受容されてから雌マウスの性行動を抑制するまでに働く、一連の神経回路機構を明らかにしました。
- これまでにESP22が雄マウスの性行動を抑制することが知られていましたが、本研究で雌マウスの性行動の抑制にも働くことがわかりました。ESP22によって雌雄の成熟マウスの性行動が抑制されることは、仔マウスにとって、自らが十分に成長するまでの間、親マウスからの十分な養育を受け、安全かつ競争の少ない生息環境を維持するために有益であると考えられます。
マウスなどのげっ歯類において、性行動や攻撃行動といったさまざまな社会行動は、フェロモンなど化学感覚シグナルによって制御されています。タンパク性のフェロモンは、マウスの涙液中や尿に存在します。例えば、雄マウスの涙液中に含まれるESP1は、雌マウスの性行動を促進します。また、雄マウスの尿中に含まれるMUP3(Major Urinary Peptide 3)は、雄マウスの攻撃行動を促進する働きを持ちます。フェロモンの中には、発現に性差が存在するものや、発現の時期に特異性があるものも存在します。その中の1つにESP1と同じペプチドファミリーに属するESP22注1)があります。ESP22は生後2~3週令の仔マウスの涙液中において発現がピークとなり、性成熟後は発現が見られなくなります。
ESP22は周囲の雄マウスの性行動を抑制する働きを持つことが知られています。しかしESP22が、フェロモン受容器である鋤鼻器官(Vomeronasal organ, VNO)注2)にあるどの受容体によって感知されるのか、また、ESP22が雌マウスに対してどのような働きがあるかについてはわかっていませんでした。東京大学 大学院農学生命科学研究科/JST ERATO 東原化学感覚シグナルプロジェクトの東原 和成 教授らの研究グループは、ESP22が鋤鼻器官に発現している単一の受容体V2Rp4(Vmn2r115)によって受容されること、また、ESP22が雄マウスだけでなく雌マウスの性行動も抑制し、その結果雌マウスの妊娠が遅れることを明らかにしました。さらに、その行動には脳内の分界条床核(BNST)から視床下部腹内側核の外腹側部(VMHvl)に投射している抑制性の神経細胞が関わっていることを解明しました。この成果は、性行動を制御する神経回路機構についての理解を深めるだけでなく、倉庫や都市部で問題となっているマウスの過繁殖や、それに伴う被害を抑制するための一助となる可能性があります。
本研究成果は、2018年10月26日(米国東部時間)に「Nature Communications」のオンライン版で公開されます。
<発表内容>
生物はライフサイクルの中で、出産後の親の養育行動、テリトリーや個体間の順位を決定づける攻撃行動など、さまざまな社会行動を営みます。マウスなどのげっ歯類において、さまざまな社会行動は、同種の他個体が分泌するフェロモンによって制御されていることが知られています。本研究では、仔マウスが涙液中に分泌するフェロモンESP22に着目し、その受容から雌マウスにおける行動出力までの一連の流れを明らかにしました。
マウスの尿や涙液中に含まれるペプチドの中には、フェロモンとして機能する分子が存在します。雄マウスの涙液中に含まれるESP1もその1つです。ESP1は雄マウスの攻撃行動を促進し、雌マウスの性行動を促進します(Haga et al., Nature 2010, Hattori et al., Current Biology 2016)。ESPペプチドファミリーに含まれる他のフェロモンとして、ESP22があります。ESP22は生後2~3週令に発現のピークが存在し、性成熟後はその発現は見られません。ESP22については、雄マウスの性行動を抑制することが明らかにされています(Ferrero et al., Nature 2013)。しかし、ESP22の受容体や雌マウスに対する機能はこれまでに解明されていませんでした。本研究では、雌マウスにおける幼少フェロモンESP22の脳神経受容機構とそのフェロモンによって引き起こされる行動出力を明らかにすることを目指しました。
まず、ESP22の雌マウスに対する働きを明らかにするため、さまざまな行動実験を行いました。その結果、ESP22をあらかじめ与えて嗅がせた雌マウスでは、雄マウスが交尾のためのマウント行動を仕掛けた際に、立ち上がったり、体をひねることで拒否する行動が、嗅がせていない雌マウスと比較して2~3倍多く観察されました(図1)。本研究グループはこれらの行動を拒否行動(rejection)と定義しました。また、ESP22を雌マウスに約10日間連続して提示しながら雄マウスとの交配を行う実験を行いました。その結果、ESP22を提示した雌マウスでは、交配の開始から出産までに通常より2~3日長くかかる個体や、実験期間中に出産が観察されない個体がそれぞれ2~3倍多くなり、ESP22による性行動の抑制が交配の成功確率を低下させることで雌の妊娠ならびにその後の出産を遅らせることがわかりました。
次にESP22を受容する受容体の同定を試みました。鋤鼻器官には約120種類の鋤鼻2型受容体(V2R)が存在し、不揮発性分子の受容に関わっています。タンパク性のフェロモンであるESP22の受容体を絞り込むために、まずdouble in situ ハイブリダイゼーション注3)を行い、受容体候補V2R遺伝子を3つに絞り込みました。その後、CRISPR/Cas9ゲノム編集システム注4)を利用して作製したノックアウトマウスを用いた実験を行い、単一の鋤鼻2型受容体V2Rp4(Vmn2r115)がESP22の機能的な受容体であることが明らかになりました。V2Rp4はすでに同定されていたESP1の受容体V2Rp5ととても良く似た遺伝子配列を持つ受容体です。雌マウスの性行動を促進するESP1と抑制するESP22が、V2Rp5とV2Rp4という相同性の高い受容体で受容されながらも、雌マウスの性行動に対して正反対の行動をもたらすことは興味深い知見です。
鋤鼻受容体で受容されたシグナルは、鋤鼻神経細胞がその軸索を伸ばしている副嗅球(AOB)へ伝達され、その後は、扁桃体内側核(MeA)や視床下部腹内側核(VMH)といった高次脳領域へと伝達されます。本研究では、ESP22が雌マウスのV2Rp4で受容された後、どのような神経回路を介して性行動が抑制されるのかについて解析を行いました。初期応答遺伝子を指標にした活性化細胞のマッピング注5)や、人工的に合成された受容体分子への作動薬によって神経活動を制御する薬理遺伝学ツール注6)によって、ESP22が雌マウスの性行動を抑制する機構には、MeAや分界条床核(BNST)に分布する神経細胞が関わっていることが明らかになりました。また、ウイルストレーサー注7)や光遺伝学注8)による解析によって、ESP22が雌マウスの性行動の抑制を引き起こす際には、BNSTから視床下部腹内側核の外腹側部(VMHvl)へと投射する抑制性の神経細胞の活性化が重要な役割を担っていることも示されました。本研究によってESP22は雌マウスにおいて、V2Rp4→AOB→MeA/BNST→VMHvlという経路を介して性行動を抑制することが明らかになりました。
本研究グループにおける先行研究によって、ESP1はV2Rp5→AOB→MeA→VMHd(視床下部腹内側核の背側部)という経路を介して雌マウスの性行動を促進することが明らかにされています(Ishii et al., Neuron 2017)。これらの研究成果をあわせて考えると、ESP22とESP1が相同性の高い鋤鼻受容体で受容されながらも、異なった神経回路によってその情報が伝達され、雌マウスの性行動に対して正反対の行動をもたらすということが明らかになりました(図2)。
仔マウスが分泌するフェロモンによって、周囲のマウスの性行動が抑制されることにはどのような生物学的意義があるのでしょうか。アカネズミなどの野生のマウスでは、主に雌マウスが縄張りを形成すること、また、雌マウスにおいて性行動が増加すると攻撃行動のモチベーションが上昇することも知られています。これらのことからESP22が周囲の雌マウスの性行動を抑制することで、母親以外の雌マウスによる自らや母親マウスへの攻撃行動を抑えている可能性が考えられます。また、ESP22が存在することで、周囲の繁殖を抑制し、仔マウスと生息空間や栄養を共有することになる同世代の個体の増加を抑制している可能性も示唆されます。その結果、仔マウスは自らが十分に成長するまでの間、安全な生息環境を維持しつつ、母マウスからの十分な養育を受けることができ、その後の生存につながる有益性を得ているものと考えられます。今後は、野生マウスを使った解析や、広い飼育フィールドを用いた解析を行うことによって、ESP22の自然環境下における意義が明らかにされることが期待されます。幼少フェロモンESP22が雄マウスだけでなく、雌マウスの性行動も抑制すること、また、その際の重要な神経回路基盤を明らかにした本研究の成果は、倉庫や都市部などで問題となっているマウスの過繁殖への対策につながる可能性があります。
<参考図>
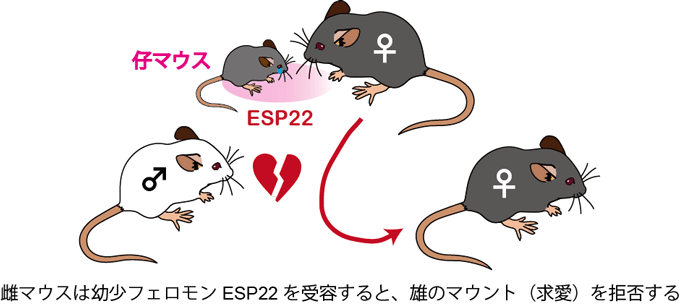
図1 仔マウスの涙液中に含まれる幼少フェロモンESP22は雌マウスの性行動を抑制する
仔マウスが分泌する幼少フェロモンESP22を受容した雌マウスは、雄の求愛(マウント行動)を高い頻度で拒否するようになります。
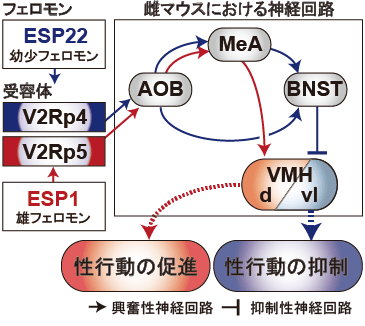
図2 涙液中に含まれるタンパク性のフェロモンが雌マウスの性行動を制御する際の神経回路
幼少フェロモンESP22(青色)は受容体V2Rp4で受容され、雌マウスにおいてAOB→MeA/BNST→VMHvlという神経回路を介して、性行動を抑制させます。一方で、雄フェロモンESP1(赤色)はV2Rp5で受容され、AOB→MeA→VMHdという回路を介して、雌マウスの性行動を促進します(Ishii et al., Neuron 2017)。本研究ならびに、本研究グループにおける先行研究によって、2つのタンパク性のフェロモンが相同性の高い受容体で認識されながらも、異なる神経回路を介して、雌マウスの性行動を正反対に制御していることが明らかになりました。
<用語解説>
- 注1)ESP22
- マウスのゲノム上には38種類のESP(Exocrine gland-Secreting Peptide)遺伝子が存在し、ペプチドファミリーを形成している。一方で、ヒトのゲノム上にはESP遺伝子は存在していない(Kimoto et al., Current Biology 2007)。マウスのESPペプチドの中ではESP1についてその解析が進んでおり、ESP1はV2Rp5(Vmn2r116)を発現する鋤鼻神経細胞で受容され、雌マウスの性行動や雄マウスの攻撃行動を促進する機能を持つ。近年ではESP22についても解析されており、ESP22が生後2~3週令の幼少マウスの涙液中に時期のみに分泌され、雄マウスの性行動を抑制することが2013年に明らかにされた。
- 注2)鋤鼻器官
- 鼻腔下部に存在する管状の感覚器であり、フェロモンをはじめとした化学シグナルの受容に関わる。両生類から哺乳類の多くの動物に存在するが、ヒトなどの高等霊長類においては機能していない。鋤鼻器官で受容されたシグナルの情報は、一次中枢である副嗅球を経由して、扁桃体内側核や視床下部腹内側核といった高次脳領域に伝達される。
- 注3)Double in situ ハイブリダイゼーション
- Double in situ ハイブリダイゼーションは、細胞に発現する特定のmRNAを認識するRNAプローブを同時に複数利用することで異なるmRNAを同時に検出する手法である。本研究では、神経細胞の活性化の指標となる初期応答遺伝子Egr1を認識するRNAプローブと各鋤鼻2型受容体を認識するRNAプローブを利用した。それによって、ESP22によって活性化される鋤鼻神経細胞において発現している鋤鼻2型受容体を3種類に絞り込んだ。
- 注4)CRISPR/Cas9ゲノム編集システム
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)/Cas9(CRISPR associated protein 9)は本来、細菌や古細菌においてウイルスなどの侵入物を標的として、それらを排除するように機能する適応免疫機構である。CRISPR/Cas9を利用すると哺乳類をはじめとしたさまざまな生物種において、ゲノム中の任意の配列を切断できることが明らかにされた。現在では、CRISPR/Cas9ゲノム編集システムを用いることで、さまざまな生物種において、簡便かつ従来の方法と比較すると短時間で、遺伝子ノックアウト個体を作製することが可能となっている。
- 注5)初期応答遺伝子を指標にした活性化細胞のマッピング
- 初期応答遺伝子とは神経細胞の活性化に伴い、短時間で発現が見られる遺伝子のことである。神経科学分野においては、初期応答遺伝子の発現が神経細胞の活性化の指標として使われることが多い。本研究では、初期応答遺伝子の1つであるc-Fosの発現を指標として用い、発現細胞を定量した。それによって、ESP22によって活性化されている神経細胞が多い脳領域の絞り込みを行った。
- 注6)薬理遺伝学ツール
- 薬理遺伝学ツールDREADD(Designer Receptors Exclusively Activated by Designer Drug)は人工的合成リガンドによって特異的に活性化されるように遺伝子変異を加えたGタンパク質共役型受容体である。本研究では、ヒトM4ムスカリン性アセチルコリン受容体を元にして、生体内には存在しない化学物質clozapine-N-oxide(CNO)によって活性化されるよう改変された人工受容体hM4Diを用いた。hM4Diを神経細胞に局在させると、CNOを受容した際にその神経細胞の活動を抑制することができる。
- 注7)ウイルストレーサー
- 脳の中では、神経細胞同士がシナプスと呼ばれる構造を介して情報の伝達を行っている。また、1つの神経細胞の中には情報を受け取る部分と次の神経細胞などに情報を伝達する部分のそれぞれが存在する。すなわち、脳内における神経回路網には方向性が存在する。ウイルストレーサーはそのような性質を持った回路網を可視化する目的で多く利用されている。ウイルストレーサーには起点となる神経細胞に感染した後に、回路の下流へと移行する性質を持つもの(順行性トレーサー)と上流にさかのぼるように移行するもの(逆行性トレーサー)の両方が存在する。
- 注8)光遺伝学
- 光遺伝学(オプトジェネティクス)は、光で活性化されるタンパク質を特定の細胞に導入し、その細胞の機能を光照射によって制御する手法のことである。本研究では、光感受性の非選択的な陽イオンチャネルであるChannelrhodopsin 2(ChR2)を用いた。ChR2を発現する神経細胞に青色光を照射することで、特定の神経細胞の活性化を誘導することができる。
<論文情報>
| タイトル |
“Sexual rejection via a vomeronasal receptor-triggered limbic circuit” |
| 著者 |
Takuya Osakada, Kentaro K. Ishii, Hiromi Mori, Ryo Eguchi, David M. Ferrero, Yoshihiro Yoshihara, Stephen D. Liberles, Kazunari Miyamichi and Kazushige Touhara |
| DOI |
10.1038/s41467-018-07003-5 |
<お問い合わせ先>
<研究に関すること>
東原 和成(トウハラ カズシゲ)
東京大学 大学院農学生命科学研究科 応用生命化学専攻 生物化学研究室 教授
Tel:03-5841-5109 Fax:03-5841-8024
E-mail:
研究室URL:https://www.biochem.ch.a.u-tokyo.ac.jp/
<JST事業に関すること>
内田 信裕(ウチダ ノブヒロ)
科学技術振興機構 研究プロジェクト推進部
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
東京大学 大学院農学生命科学研究科・農学部 総務課総務チーム 広報情報担当
Tel:03-5841-8179 Fax:03-5841-5028
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: