ポイント
- 神経発達障害に関連する細胞接着分子LRRTMとニューレキシン(Nrxn)がカルシウムイオンを介して選択的に結合して神経細胞同士を適切につなぐ仕組みを解明しました。
- Nrxn1βとLRRTM2が結合した状態の立体構造を決定し、Nrxn1βとLRRTM2とのカルシウムイオンを介した選択的な相互作用の詳細を明らかにしました。
- 本成果は、神経回路形成のメカニズムの解明や自閉症などの神経発達障害に関わる今後の研究に役立つ知見になると期待されます。
東京大学 定量生命科学研究所(白髭 克彦 所長)の深井 周也 准教授らのグループは、細胞接着分子Nrxn1β注1)とLRRTM2注2)がカルシウムイオンを介して結合した複合体の立体構造を決定し、神経細胞同士を適切につなぐ仕組みを解明しました。
神経細胞間の接続部であるシナプス注3)の形成と再編は、神経回路の形成や記憶学習の際に起きる重要なステップであり、その調節機構の破綻は自閉症などの神経発達障害の発症と密接に関連することが示唆されています。神経発達障害に関連する細胞接着分子であるNrxnとLRRTMは、それぞれシナプス前終末と後終末(図1)に配置されて選択的に相互作用することで、興奮性シナプスの形成を誘導します。
深井准教授らの研究グループは、Nrxn1βとLRRTM2が結合した状態の立体構造をX線結晶構造解析注4)で決定することによって、これらの分子がカルシウムイオンを介して選択的に相互作用する分子機構を明らかにしました。本成果は、神経回路形成のメカニズムの解明や自閉症などの神経発達障害に関わる今後の研究に役立つ知見になると期待されます。
本研究成果は2018年9月27日付(英国時間)の英国科学雑誌「Nature Communications」のオンライン版に掲載されます。
本研究成果は、科学技術振興機構(JST)の戦略的創造研究推進事業 チーム型研究(CREST) 「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域(田中 啓二 研究総括)における研究課題「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」(研究代表者:深井 周也)の一環として行われました。
<研究の背景>
神経細胞間の接続部であるシナプスの形成と再編は、脳の発達に伴い神経回路が作られる際や記憶学習の際に起こる重要なステップであり、その調節機構の破綻は自閉症、知的障害などの神経発達障害の発症と深く関わることが示唆されています。シナプスを介して神経細胞間で信号の授受が行われますが、出力側をシナプス前終末、入力側をシナプス後終末と呼び、シナプス前終末と後終末の両方もしくは片方を分化誘導する能力を持つ細胞接着分子をシナプスオーガナイザーと呼びます(図1)。LRRTMはシナプス後終末側のシナプスオーガナイザー分子ファミリーであり、ヒトやマウスではLRRTM1からLRRMT4までの4種類が知られています。4種類のうちLRRTM1とLRRTM2は、シナプス前終末側のシナプスオーガナイザー分子ファミリーであるNrxnと結合して興奮性シナプスの形成を誘導することが明らかになっていましたが、LRRTM3やLRRTM4がNrxnと結合してシナプス形成を誘導するかどうかは明確な結論が得られていませんでした。また、LRRTMは、S4と呼ばれる挿入部位のないNrxn(–S4)とのみ結合することが分かっていましたが、その分子機構の詳細は不明でした。
<研究の内容>
本研究グループは、Nrxn1βがLRRTM2と結合した複合体の結晶を作製し、大型放射光施設SPring-8(兵庫県佐用郡)やPhoton Factory(茨城県つくば市)の高輝度X線を利用したX線結晶構造解析により、Nrxn1β–LRRTM2複合体とLRRTM2単体の立体構造を決定しました。Nrxn1β–LRRTM2複合体の立体構造により、Nrxn1βとLRRTM2との選択的な相互作用の詳細が明らかになりました(図2)。相互作用に関与する部位を変異させたタンパク質を作製して結合活性とシナプス誘導活性を測定することで、立体構造から明らかになった相互作用部位が機能的にも重要であることを裏付けました。Nrxn1βとの相互作用に関与するLRRTM2の部位はLRRTM1でも保存されており、LRRTM1とLRRTM2がNrxn1βの結合パートナーである事実と合致していましたが、LRRTM3やLRRTM4では一部の部位が異なっており、Nrxn1βとの結合も確認できませんでした。他の研究グループの報告と合わせると、LRRTM3やLRRTM4ではヘパラン硫酸プロテオグリカンが主要な結合パートナーであることが示唆されました。
<社会的意義と今後の予定>
本研究グループは、シナプスオーガナイザー分子同士の選択的相互作用の分子機構の解明を通じて、中枢シナプス形成の特異性を保証する基本原理を理解してきました。今回、新たな選択的相互作用メカニズムを明らかにしたことで、基本原理の理解がさらに進みました。ヒトにおいてNrxnやLRRTMは自閉症などの神経発達障害と関連することが報告されており、今回の研究結果は、神経発達障害の病態解明や治療・創薬標的の提示に役立つことが期待されます。
<参考図>
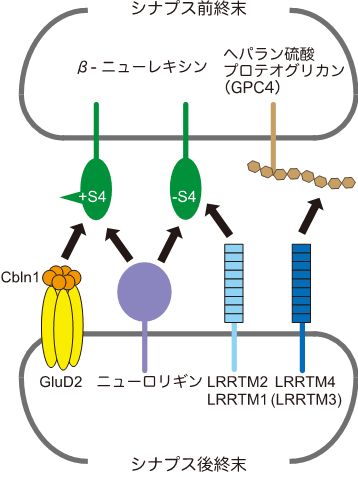
図1 NrxnとLRRTMが関わるシナプスオーガナイザー間の選択的な相互作用
Nrxnにはαとβの2種類があるが、ここではβだけを示してある。S4と呼ばれる挿入部位の有無(+S4および–S4)の違いで相互作用する分子が選択される。
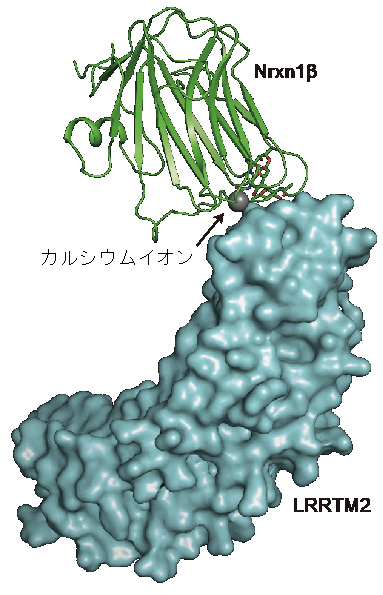
図2 今回の解析で明らかになったNrxn1β–LRRTM2複合体の立体構造
<用語解説>
- 注1)ニューレキシン(Neurexin、Nrxn)
- 細胞接着タンパク質の1つ。神経細胞のシナプス形成を誘導する活性を持つ。一回膜貫通型の膜タンパク質で、細胞外領域が大きなα-Nrxnと小さなβ-Nrxnの2つの型が存在する。Nrxn1βはβ-Nrxnの1つ。シナプス前終末に局在するNrxnがシナプス後終末に局在するLRRTMやニューロリギン、Cbln1-GluD2と相互作用することで、シナプス形成が誘導される。
- 注2)LRRTM
- 細胞接着タンパク質の1つ。Nrxnと相互作用することで興奮性のシナプス形成を誘導する活性を持つ。
- 注3)シナプス
- 神経細胞の軸索(シナプス前終末)が他の神経細胞(シナプス後細胞)に入力する部位に形成される、神経細胞間の信号伝達を担う構造。シナプス前終末と後細胞の間に隙間があり、シナプス前終末からの神経伝達物質の放出を介して信号を伝える。
- 注4)X線結晶構造解析
- 分子の三次元構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶にX線を照射すると回折という現象が起きる。回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
<論文情報>
| タイトル |
“Structural insights into modulation and selectivity of transsynaptic neurexin–LRRTM interaction” |
| 著者名 |
Atsushi Yamagata, Sakurako Goto-Ito, Yusuke Sato, Tomoko Shiroshima, Asami Maeda, Masahiko Watanabe, Takashi Saitoh, Katsumi Maenaka, Tohru Terada, Tomoyuki Yoshida, Takeshi Uemura, and Shuya Fukai |
| DOI |
10.1038/s41467-018-06333-8 |
<お問い合わせ先>
<研究に関すること>
深井 周也(フカイ シュウヤ)
東京大学 定量生命科学研究所 准教授
Tel:03-5841-7807
E-mail:
植村 健(ウエムラ タケシ)
信州大学 基盤研究支援センター 准教授
Tel:0263-37-3108
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: