理化学研究所(理研)環境資源科学研究センター 統合メタボロミクス研究グループの東 泰弘 研究員、斉藤 和季 グループディレクターらの研究グループは、高温ストレス環境下の植物の葉で脂質代謝に関与し、植物が高温ストレスを緩和する応答反応に必須である新しいリパーゼ注1)遺伝子を発見しました。
近年の地球温暖化による気候変動により、植物がより頻繁に高温ストレスを受ける可能性が高まっています。本研究成果は、作物の高温ストレス耐性を向上させる技術開発に貢献すると期待できます。
今回研究グループは、シロイヌナズナ注2)を用いて、高温ストレスで発現が誘導される遺伝子の中から、脂質組成変化に寄与する候補として、葉緑体に局在するリパーゼ遺伝子に着目しました。この高温ストレス誘導性リパーゼ遺伝子(HIL1)が欠損した植物体(hil1変異体)を調べたところ、HIL1遺伝子が植物の熱ショックストレス応答に必須であることが分かりました。さらに、hil1変異体の脂質メタボローム解析注3)と、HIL1の基質特異性の検討から、HIL1遺伝子が不飽和脂肪酸注4)を含む葉緑体脂質のリモデリング注5)(再編成)において重要な役割を果たすことが示されました。
本成果は、米国の科学雑誌「The Plant Cell」の掲載に先立ち、オンライン版(2018年7月2日付け:日本時間7月2日)に掲載されました。
本研究の一部は、科学技術振興機構 戦略的国際共同研究プログラム(SICORP)日本-アメリカ共同研究「低炭素社会のためのメタボロミクス」(支援期間:平成23年度~平成28年度、プロジェクト名:「メタボロミクス:低炭素社会に向けた植物特異的代謝解明に資する基盤研究推進」、日本側研究代表者:斉藤 和季)による支援を受けて実施されました。
<背景>
近年の地球温暖化による気候変動の影響で、日中の最高気温の上昇などに伴う作物への高温ストレスがより頻繁に引き起こされる可能性が高まっています。植物は温度、水分量、光強度、塩濃度などによる環境ストレスを受けると、生体膜の脂質組成を変化させます。そのため、植物の脂質を詳細に分析することは、生育環境変化への適応を理解する上で重要です。
植物の葉に含まれる葉緑体膜や細胞膜のグリセロ脂質注6)はさまざまな分子種から構成されており、環境ストレスに応答して、親水基で分類される脂質クラスの存在比率と脂肪酸不飽和度(脂肪酸中の二重結合の数)が変化します。厳しい環境ストレス条件下では、植物は貯蔵脂質を蓄積することが知られています。
植物で最初に全ゲノムが解読されたシロイヌナズナは、植物研究のモデル生物として幅広く使われており、シロイヌナズナのグリセロ脂質生合成に関わる遺伝子についてもこれまで広く報告されてきました。東研究員らは、高温ストレスがシロイヌナズナの葉のグリセロ脂質組成に及ぼす影響を調べるために、脂質メタボローム解析(リピドミクス)とトランスクリプトーム解析注7)を行い、その結果を2015年に報告しました※)。しかし、環境ストレス緩和に寄与する脂質代謝酵素遺伝子の理解と、詳しい脂質分子種の機能解析はまだ十分になされていませんでした。
今回、研究グループは、高温ストレスで発現が誘導される遺伝子の中から、葉緑体に局在するタンパク質をコードし、脂質組成変化に寄与すると考えられる遺伝子について機能解析を試みました。
<研究の内容>
(1) 高温ストレスに応答したシロイヌナズナ葉に含まれるグリセロ脂質の解析
研究グループは2015年の報告後も引き続き、高温ストレスがシロイヌナズナの葉のグリセロ脂質組成に及ぼす影響を調べるために、高速液体クロマトグラフ質量分析計注8)を用いた脂質メタボローム解析を行ってきました。
まず、ロゼット状態(短い茎に多数の葉が放射状に開いた状態)の野生型シロイヌナズナを通常(22℃)より高い温度(38℃)で1日間栽培し、葉におけるグリセロ脂質の蓄積量の変化を測定しました。その結果、葉緑体膜を構成する糖脂質のうち、不飽和脂肪酸18:3(炭素原子18個と二重結合を3個持つ)と16:3(炭素原子16個と二重結合を3個持つ)を含む分子種は、高温ストレスで速やかに減少することが分かりました。また、高温ストレス処理後に蓄積する貯蔵脂質であるトリアシルグリセロール(TAG)のうち、18:3が3つ結合した分子種(54:9-TAG)は、相対的に多く蓄積される傾向が見られました。これらのことから、ストレスで減少する葉緑体膜脂質の不飽和脂肪酸がTAGを生合成する基質になることが示唆されました。
(2) 熱ショックストレス応答に必須な遺伝子「HIL1」の同定とその機能の解明
次に、同じ高温ストレス条件に置かれた葉のトランスクリプトームデータを用いて、高温ストレスで発現が誘導される遺伝子の中から、脂質組成変化に寄与する候補として、葉緑体に局在するリパーゼ(グリセロ脂質を加水分解する酵素)をコードする遺伝子に注目しました。この高温ストレス誘導性リパーゼ遺伝子(Heat Inducible Lipase 1:HIL1)の働きを明らかにするために、HIL1遺伝子の機能を欠損させたT-DNAタグ挿入変異体注9)(hil1変異体)を収集し、その変異体の脂質メタボローム解析を行いました。
その結果、高温ストレス条件下で見られた、18:3不飽和脂肪酸を含む脂質分子種の蓄積量変化が、hil1変異体では若干異なることが分かりました。すなわち、hil1変異体では、葉緑体膜を構成する糖脂質である34:6-モノガラクトシルジアシルグリセロール(MGDG)の高温ストレスで見られる蓄積量減少が部分的に阻害される一方、貯蔵脂質である54:9-TAGの蓄積量増加も部分的に阻害されました(図1)。
また、hil1変異体の表現型は、野生型と比較して、通常温度の栽培条件下の生育に差は見られませんでしたが、葉への熱ショックストレスに対して感受性を示しました(図2)。さらに、HIL1遺伝子のゲノム配列をhil1変異体に導入した遺伝子相補体注10)hil1/HIL1では、hil1変異体で見られた蓄積量変化と熱ショック時の感受性表現型は回復しました(図2)。
以上のことは、HIL1遺伝子の機能が高温ストレスに応答しストレスを緩和した結果であり、HIL1遺伝子が植物の熱ショックストレスを緩和する応答に必須であることを示しています。
最後に、大腸菌の遺伝子発現系を用いて、HIL1遺伝子の酵素機能を解析しました。その結果、HIL1タンパク質は不飽和脂肪酸を含むMGDG(葉緑体膜を構成する糖脂質)の分解反応の触媒活性を顕著に示しました。一方で、TAG(貯蔵脂質)や他の脂質クラスでは分解反応を起こしにくいことも分かりました。以上の結果より、HIL1遺伝子はリパーゼ活性を持つタンパク質をコードし、高温ストレス条件下のシロイヌナズナの葉において、不飽和脂肪酸を含む葉緑体膜脂質MGDGのリモデリング(再編成)に寄与することが示されました(図3)。
<今後の期待>
今回、シロイヌナズナで同定されたHIL1リパーゼ遺伝子は、高温ストレス条件下で葉緑体膜の脂質組成を変化させることに関与し、植物が熱ショックストレスを緩和する応答反応に必須であることが分かりました。また、本遺伝子と同じような配列をした遺伝子はシロイヌナズナに限らずダイズなど主要作物を含む他の植物種にも広く存在しており、これらがHIL1リパーゼ遺伝子と同じように高温ストレスの緩和に関与していると考えられます。本研究成果に基づき、将来、HIL1遺伝子の機能を強化するなどの改良や育種を行うことで、地球温暖化によって増悪する高温ストレスに耐性を持つ植物や作物の品種作出につながると期待できます。
また本研究は、国際連合が2016年に発効した17項目の「持続可能な開発目標(SDGs)」注11)のうち「13.気候変動に具体的な対策を」「2.飢餓をゼロに」に大きく貢献するものと考えます。
<参考図>
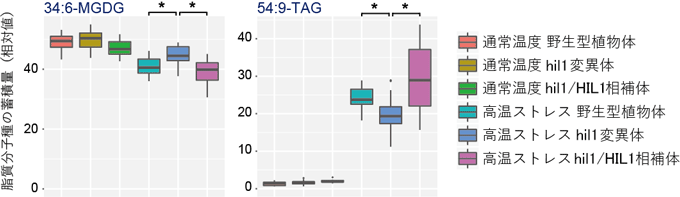
図1 HIL1遺伝子変異体の脂質メタボローム解析
葉緑体の膜を構成する脂質分子種34:6-MGDG(左)は、通常温度の植物体と比較して高温ストレス条件下では蓄積量が減少する。この減少は、HIL1遺伝子の機能を欠損させたhil1変異体では部分的に阻害されることが分かる。一方、貯蔵脂質である54:9-TAG(右)は、通常温度の植物体と比較して高温ストレス条件下では蓄積量が著しく増加する。しかし、hil1変異体では、この増加が部分的に阻害される。反面、HIL1遺伝子のゲノム配列をhil1変異体に導入したhil1/HIL1相補体では、蓄積量の変化が野生型に戻ることが分かる。このことより、高温ストレス条件下で見られる脂質組成の変化の一部が、HIL1遺伝子の機能により生じると考えられる。
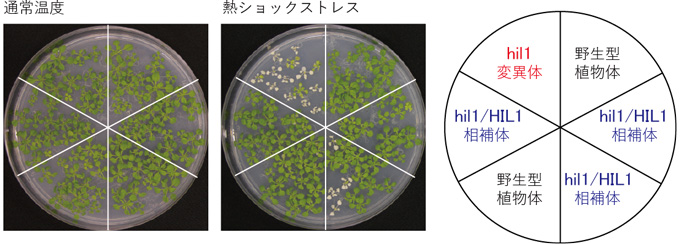
図2 HIL1遺伝子変異体における熱ショックストレス耐性解析
HIL1遺伝子の機能を欠損させたhil1変異体は、通常温度(コントロール)では正常に生育するが、熱ショックストレス処理後に栽培を続けると、大部分が白く枯れる。一方、HIL1遺伝子のゲノム配列をhil1変異体に導入したhil1/HIL1相補体では、熱ショックストレス処理後でも正常に生育する。このことより、植物の熱ショックストレスを緩和する応答にとって、HIL1遺伝子が必須であることが分かる。
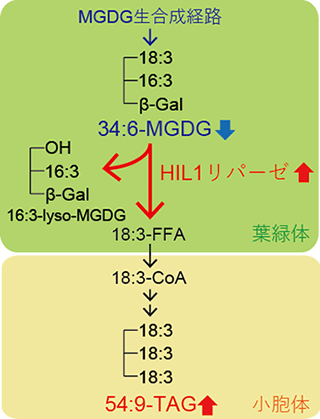
図3 高温ストレス条件下の葉におけるHIL1によるMGDGのリモデリング
糖脂質の1つであるMGDGは、葉の葉緑体において生合成され、不飽和化酵素によって不飽和脂肪酸18:3と16:3を含む脂質分子種「34:6-MGDG」に変換され、葉緑体膜の一部を構成する。高温ストレス誘導性リパーゼHIL1は、高温ストレス条件下において発現が誘導され、34:6-MGDGの一部を分解し、リゾ脂質16:3-lyso-MGDGと遊離脂肪酸18:3-FFAを生産する。18:3-FFAは、葉緑体から、別の細胞内小器官である小胞体膜上に輸送され、18:3を3つ含む貯蔵脂質「54:9-TAG」に変換され、一時的に保存されると考えられる。高温ストレスにより、赤字で示した反応経路および代謝物は増加し、青字で示したものは減少する。
<用語解説>
- 注1)リパーゼ
- 脂質分解酵素の一種。特に本研究では、グリセロ脂質を加水分解して遊離脂肪酸を生成する反応を触媒するタンパク質(酵素)をリパーゼと呼ぶ。
- 注2)シロイヌナズナ
- 2000年に植物として初めて全ゲノムが解読され、モデル生物として幅広く植物研究の材料として使われている。
- 注3)メタボローム解析
- ある植物や生体組織に含まれる代謝物の総体をメタボロームという。植物における総代謝物質は20万~100万種と考えられている。メタボローム解析では、このメタボロームを網羅的に測定・解析を行う。
- 注4)不飽和脂肪酸
- 二重結合を持たない飽和型の脂肪酸は、生体内で不飽和化酵素の働きにより、二重結合を複数持つ不飽和脂肪酸に変換される。不飽和脂肪酸は生体膜の流動性を高めるなど、生体機能に重要な役割を果たすと考えられている。また、例えば、不飽和脂肪酸18:3は炭素原子を18個と二重結合を3個持つ分子を示す。
- 注5)リモデリング
- 細胞や個体を取り巻く環境が変化した際に、それに対応するために生体膜の組成が変化する。これが膜脂質のリモデリング(再編成)であり、植物の葉緑体膜の場合、高温ストレス環境下では、不飽和脂肪酸を含む糖脂質が減少することが知られている。
- 注6)グリセロ脂質
- 水に溶けない脂溶性代謝物のうち、グリセロール骨格に主に脂肪酸がエステル結合したものをグリセロ脂質と呼ぶ。植物の生体膜は主にグリセロ脂質によって構成されている。グリセロ脂質に関しては、葉緑体は糖脂質の生合成を行い、小胞体膜は、リン脂質や貯蔵脂質の生合成などを行う。葉緑体では糖脂質が多く、それ以外の細胞内小器官ではリン脂質が多い。種子には、大量の貯蔵脂質が蓄積される。脂質メタボローム解析では、グリセロール骨格に脂肪酸がいくつか結合している場合、総炭素原子数と総二重結合数を数字で表す。例えば、不飽和脂肪酸18:3と16:3を1つずつ持つモノガラクトシルジアシルグリセロール(MGDG)は、34:6-MGDG脂質分子種と表す。
- 注7)トランスクリプトーム解析
- DNAから転写されるメッセンジャーRNA(mRNA)として発現する遺伝子転写産物の量を網羅的に解析すること。生体内における遺伝子の発現量をサンプル間で比較するために用いる。
- 注8)高速液体クロマトグラフ質量分析計
- 脂質代謝物の分離に優れた高速液体クロマトグラフと、その質量を精密に測定する質量分析装置を組み合わせた機器。
- 注9)T-DNAタグ挿入変体
- アグロバクテリウム細菌が植物に感染すると、T-DNA領域のDNA断片を植物ゲノムの中に組み込むことが知られている。T-DNAタグ挿入植物体は、DNA断片が植物ゲノムの特定の遺伝子内に挿入した場合には、その遺伝子の機能を欠損された変異体となる。
- 注10)遺伝子相補体
- 対象遺伝子の機能を欠損させた変異体植物体を、アグロバクテリウム細菌に感染させ、正常な対象遺伝子の配列を加えたT-DNA領域を、改めて植物ゲノムに導入することで、対象遺伝子の機能を相補した植物体。
- 注11)持続可能な開発目標(SDGs)
- 持続可能な開発目標(SDGs)とは、2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴールから構成され、地球上の誰一人として取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省のホームページから一部改変して転載)
<論文情報>
| タイトル |
“HEAT INDUCIBLE LIPASE1 remodels chloroplastic monogalactosyldiacylglycerol by liberating α-linolenic acid in Arabidopsis leaves under heat stress” |
| DOI |
10.1105/tpc.18.00347 |
<参考文献>
- ※)Higashi Y, Okazaki Y, Myouga F, Shinozaki K, Saito K (2015) Landscape of the lipidome and transcriptome under heat stress in Arabidopsis thaliana. Sci. Rep. 5: 10533
<お問い合わせ先>
<研究に関すること>
東 泰弘(ヒガシ ヤスヒロ) 研究員
斉藤 和季(サイトウ カズキ) グループディレクター
理化学研究所 環境資源科学研究センター 統合メタボロミクス研究グループ
E-mail:
<JST事業に関すること>
科学技術振興機構 国際部
Tel:03-5214-7375 Fax:03-5214-7379
E-mail:
<報道担当>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: