ポイント
- 安定なC–H結合を室温でC–OH結合に水酸化するメカニズムにおいて、重要な化学種を発見。
- 寿命が短く観測が困難であった高活性な人工酵素の活性種の観測・同定に初めて成功。
- 豊富な天然炭素資源の有用物質への変換に有効な人工酵素や分子触媒・固体触媒への応用に期待。
大阪大学 大学院工学研究科の大洞 光司 助教および林 高史 教授らの研究グループは、兵庫県立大学 大学院生命理学研究科 城 宜嗣 教授および理化学研究所 放射光科学総合研究センター 杉本 宏 専任研究員と共同で、安定なC–H結合注1)を触媒的にC-OH結合に変換するマンガンポルフィセン注2)とミオグロビン注3)を複合化した人工酵素の反応活性種を観測し、マンガン5価オキソ種注4)であることを世界で初めて明らかにしました(図1)。
これまで天然炭素資源などの利用において、炭素と水素の結合(C–H結合)は非常に安定であり、反応性が乏しく有用物質への変換において大きな問題となっていました。この安定なC–H結合を効率的にC-OH結合に変換する水酸化能を有する天然酵素が注目されてきましたが、その高い活性が理由で反応活性種の解明は困難と考えられており、酵素の反応メカニズムの解明やさらなる改良に重要であるにもかかわらず、活性種は非常に限られた系でしか解明されていませんでした。
今回、大洞助教、林教授らの研究グループは、活性種を得るためにストップトフロー法注5)という手法を用いて、安定なC–H結合を効率的にC-OH結合に変換するマンガンを含む人工酵素の活性種がマンガン5価オキソ種であることを世界で初めて同定しました。さらに得られる反応活性種が、天然酵素のような複雑なたんぱく質環境を必要とせずに安定なC–H結合を室温で水酸化可能であることを示しました。これにより、今後の人工酵素の設計が可能になり、複雑な有機化合物の位置・立体選択的な水酸化や、豊富な天然炭素資源の有用物質への効率的変換に貢献します。
本研究成果は、米国科学雑誌「Journal of the American Chemical Society」に、2017年12月14日(米国東部時間)にオンライン公開されました。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業個人型研究(さきがけ)「革新的触媒の科学と創製」および文部科学省 科学研究費補助金新学術領域研究「高難度物質変換反応の開発を指向した精密制御反応場の創出」の支援を受けて行われました。
<研究の背景・内容>
触媒は、通常では進行しない化学反応により原料物質を有用物質に効率的に変換する際に用いられる物質です。さまざまな種類の触媒が存在し、代表的にはたんぱく質から構成される酵素、金属個体の表面などを利用する固体触媒やナノメートル(10-9メートル)サイズの分子触媒が挙げられます。本研究分野において、炭素と水素の安定な結合であるC–H結合の活性化を伴う物質変換は、多様な天然炭素資源から有用物質を生産する上で重要な反応として注目されています。特に天然酵素においては、室温付近の温和な条件下で安定なC–H結合を1つの酸素原子(O)を挟んだC-OH結合に変換するシトクロムP450注6)が広く研究されており、その反応の鍵となる活性種は鉄を含むヘム注7)から電子が引き抜かれた高原子価種注8)であることが知られています。この活性種の反応性は非常に高く、固体触媒や分子触媒の活性種への応用が可能になれば有用ですが、通常は天然酵素の複雑なたんぱく質内部でのみ容易に発現し、人工系への応用は非常に難しい課題です。一方、シトクロムP450と同じヘムを含むたんぱく質であり単純な構造を有するミオグロビンは、同反応に対して触媒活性を全く示さないことが知られています。以前に、大洞助教、林教授らのグループでは、図2に示すように、ミオグロビン中のヘムを人工的に調製された金属錯体であるマンガンポルフィセンに入れ替えた人工酵素を調製したところ、初めて、単純な構造のミオグロビンを用いて同反応が触媒的に進行することを報告しました(J.Am.Chem.Soc.2013,135,17282–17285.)。しかし、ミオグロビンのような単純なたんぱく質の内部で、どのようにして室温で安定なC–H結合の水酸化が可能になっているのか、反応活性種については明らかにされてきませんでした。
今回、大洞助教、林教授らの研究グループでは、ミオグロビンとマンガンポルフィセンを組み合わせた人工酵素について、基質(原料物質)の非存在化で、比較的強い酸化剤であるメタクロロ過安息香酸注9)などの過酸と反応させ各種分光法で観測・同定しました。具体的には、ストップトフロー法を用いて調製したサンプルの紫外可視近赤外光の吸収スペクトル測定と急速凍結法注10)を用いて調製したサンプルの電子スピン共鳴スペクトル測定注11)により、活性メカニズムにおける反応活性種がポルフィセンのマンガン5価オキソ種であることを解明しました。さらに、得られた活性種に基質を添加することで実際に水酸化反応が進行し、確かに触媒機構内の反応活性種であることを示しました。
<今後の展開>
これまで安定なC–H結合を室温付近で選択的に水酸化する手法の1つとして、天然酵素による触媒的な水酸化が挙げられてきました。しかしながら、これらの天然酵素は複雑なたんぱく質の環境が作用して、特定の基質にのみ高い活性を示す特徴があり、他の基質の水酸化に応用することは非常に困難です。一方、ミオグロビンとマンガンポルフィセンを組み合わせた人工酵素はさまざまな基質に対して適応可能であり、本研究成果において、反応活性種がマンガン5価オキソ種であることが実験的に証明されました。この知見は、安定なC–H結合活性化の詳細なメカニズム解明を可能にし、計算化学と組み合わせた合理的な人工酵素の設計に応用でき、今後、単純な分子触媒や固体触媒では不可能な複雑な有機化合物の位置・立体選択的な水酸化や豊富な天然炭素資源の有用物質への効率的な変換に貢献します。また固体触媒や分子触媒の活性種と今回の活性種は類似する部分も多く、今回発見された室温付近で高い活性を示すマンガン5価オキソ種は、天然酵素のような複雑なたんぱく質環境も不要であり、固体触媒や分子触媒の系の発展にも寄与すると期待されます。
<参考図>
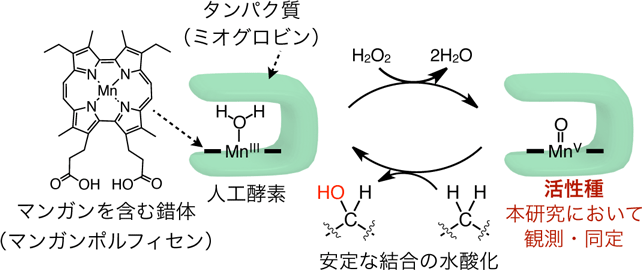
図1 本研究の概念図
マンガンを含む錯体とタンパク質を組み合わせた人工酵素における活性種の観測と同定。
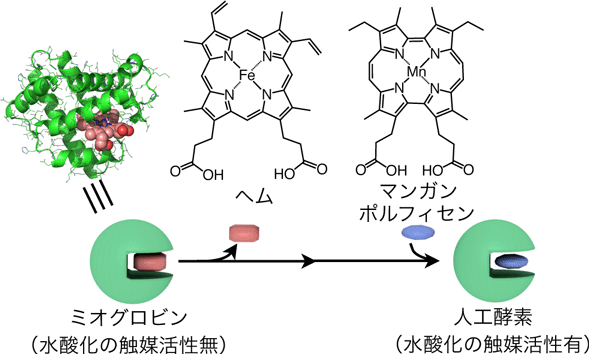
図2 人工酵素調製の概念図
<用語解説>
- 注1) 安定なC–H結合
- 炭素原子と水素原子の結合。開裂には非常に高いエネルギー(95kcal/mol以上)が必要。
- 注2) マンガンポルフィセン
- ポルフィセン分子にマンガンが結合した金属錯体。ポルフィセンは天然色素であるポルフィリンの構造異性体であり、ピロール(窒素を含む五員環化合物)2分子が直結したビピロールが、さらに2分子でエチレン架橋により連結した環状有機化合物。
- 注3) ミオグロビン
- 酸素を貯蔵するたんぱく質。多数の動物の筋肉中に存在し、血液と同じ色素であるヘムを含むため赤く、結晶構造解析の適用で初めて構造が明らかになった単純なたんぱく質。
- 注4) マンガン5価オキソ種
- 原子番号25番の元素であるマンガンから形式的に電子が5個不足したイオンに、酸素原子に形式的に電子が2個付与したイオンが結合した化学種。天然酵素の活性種として鉄や銅の金属オキソ種が同様に確認されており、C–H結合の水酸化に高い活性を示すことが知られている。
- 注5) ストップトフロー法
- 二種以上の溶液を高速混合し、おおむねミリ秒以上を上限とする速い反応を観測する手法。
- 注6) シトクロムP450
- ヘムを含む金属酵素。動物の肝臓中に存在し、脂溶性物質の水酸化をはじめとするさまざまな代謝・生合成の触媒として作用する。
- 注7) ヘム
- ポルフィリンの鉄錯体であり、生物中において多数の金属たんぱく質内で、電子移動、酸素運搬/貯蔵、ガスセンサー、酸化反応触媒などの多数の役割を担う。ポルフィリンはピロール分子が1つの炭素を挟んで4つ環状に連なったテトラピロール化合物である。
- 注8) 高原子価種
- 主に金属原子において、通常よりも電子が少ない状態。
- 注9) メタクロロ過安息香酸
- 過酸の一種であり、有機合成で用いられる酸化剤。ベンゼン環に塩素と過カルボン酸が結合した化合物。
- 注10) 急速凍結法
- 高速混合などにより生じた不安定な化学種を、冷媒により凍結した溶媒に閉じ込め、反応を止める手法。本実験では、反応溶媒が水であるため、冷媒として融点付近のペンタン(約-130ºC)を使用。
- 注11) 電子スピン共鳴スペクトル測定
- 不対電子を検出する分光測定の一種。磁場の影響化で、不対電子を持つ化合物がマイクロ波を共鳴吸収することを利用した測定法であり、金属錯体の電子状態を評価するために用いられる。
<論文情報>
| タイトル |
“Manganese(V) Porphycene Complex Responsible for Inert C–H Bond Hydroxylation in a Myoglobin Matrix” |
| 著者名 |
Koji Oohora, Hiroyuki Meichin, Yushi Kihira, Hiroshi Sugimoto, Yoshitsugu Shiro and Takashi Hayashi |
| doi |
10.1021/jacs.7b11288 |
<お問い合わせ先>
<研究に関すること>
大洞 光司(オオホラ コウジ)
大阪大学 大学院工学研究科 助教
Tel:06-6879-7929 Fax:06-6879-7930
E-mail:
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
Tel: 03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
大阪大学 工学研究科 総務課評価・広報係
〒565-0871 大阪府吹田市山田丘2-1
Tel: 06-6879-7231 Fax:06-6879-7210
E-mail:
兵庫県立大学 播磨理学キャンパス 経営部総務課
Tel:0791-58-0101 Fax:0791-58-0131
E-mail:
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
Tel: 03-5214-8404 Fax:03-5214-8432
E-mail: