ポイント
- 高速原子間力顕微鏡(高速AFM)を用いて、ゲノム編集ツールCRISPR-Cas9によるDNA切断を動画として撮影することに成功した。
- DNA切断の際、Cas9は大きな構造変化を起こすことが明らかになった。
- 本研究結果は、CRISPR-Cas9を利用したゲノム編集技術の高度化の基盤となることが期待される。
近年、生命の設計図であるゲノム情報(DNAの塩基配列)を書き換える「ゲノム編集」注1)技術が注目されています。細菌のもつDNA切断酵素CRISPR-Cas9注2)を応用したゲノム編集技術は、基礎研究から臨床応用に至る多岐にわたる生命科学分野において広く利用されています。今回、東京大学 大学院理学系研究科の西増 弘志 助教、濡木 理 教授、金沢大学 新学術創成研究機構の柴田 幹大 准教授、金沢大学 理工研究域バイオAFM先端研究センターの古寺 哲幸 准教授、安藤 敏夫 特任教授、名古屋大学 大学院理学研究科の内橋 貴之 教授らは、高速AFM注3)を用いることにより、CRISPR-Cas9がDNAを切断する一連の様子を動画として撮影することに成功しました。本研究結果は、CRISPR-Cas9によるDNA切断メカニズムの深い理解につながるとともにゲノム編集技術の高度化の基盤となることも期待されます。
本研究成果は、2017年11月10日(米国東部時間)に「Nature Communications」誌オンライン版で公開される予定です。
本研究は、日本学術振興会 科学研究費助成事業、金沢大学 新学術創成研究機構 ユニット研究推進経費、花王芸術・科学財団 花王科学奨励賞、ブレインサイエンス振興財団 研究助成(研究代表者:柴田 幹大)、科学技術振興機構(JST) 戦略的創造研究推進事業 さきがけ「立体構造にもとづく次世代ゲノム編集ツールの創出」(研究者:西増 弘志)、科学技術振興機構 戦略的創造研究推進事業 さきがけ「新規高速原子間力顕微鏡で解き明かすミオシンVの化学-力学エネルギー変換機構」(研究者:古寺 哲幸)、科学技術振興機構 戦略的創造研究推進事業 CREST「ATP/GTPが駆動するタンパク質マシナリーの動的構造生命科学」(研究代表者:安藤 敏夫)、科学研究費助成事業、新学術領域「理論と実験の協奏による柔らかな分子系の機能の科学」、「生命システムにおける動的秩序形成と高次機能発現」(研究代表者:内橋 貴之)、文部科学省(2014年度)・日本医療研究開発機構(AMED)(2015年度以降)革新的バイオ医薬品創出基盤技術開発事業「新規CRISPR-Cas9システムセットの開発とその医療応用」(研究代表者:濡木 理)の一環として行われました。
<発表内容>
近年、生命の設計図であるゲノム情報を書き換える「ゲノム編集」とよばれる技術が脚光を浴びています。ゲノム編集は、生命科学の基礎研究から動植物の品種改良や疾患の治療にいたる幅広い分野において利用されている革新的な技術です。ゲノム編集にはCas9とよばれるDNA切断酵素が用いられます。Cas9はガイドRNAと結合し、ガイドRNAの一部(ガイド配列)と相補的なDNAを選択的に切断するはたらきをもちます(図1)。すなわち、Cas9はDNAを切る「ハサミ」としてはたらく一方、ガイドRNAは「案内役」としてCas9を標的となるDNAへと導きます。20塩基のガイド配列は自由に設計し交換できるため、Cas9と人為的に作製したRNAを用いることにより、ゲノムDNAのさまざまな部位を選択的に切断することが可能です。ゲノム編集技術では、Cas9によって切断された部位が修復される過程において生じる塩基配列の変化を利用します。
これまでに本研究グループや海外の研究グループによってCRISPR-Cas9の結晶構造が決定され、DNA切断メカニズムの理解が進んできました。Cas9単体、ガイドRNAと結合した状態(Cas9-RNA複合体)、ガイドRNAおよび標的DNAと結合した状態(Cas9-RNA-DNA複合体)の結晶構造の比較から、RNAやDNAの結合に伴い、Cas9は構造を大きく変化させることが示唆されていました(図2)。しかし、結晶構造は分子のある一状態を捉えた「スナップショット」であるため、実際にCas9がどのような構造変化を起こすのかは不明でした。
今回、本研究グループは高速AFMを用いることにより、CRISPR-Cas9がはたらく一連の様子を動画撮影することに成功しました。高速AFMは、金沢大学が世界にさきがけて開発してきた顕微鏡技術で、水溶液中の生体分子をナノメートル(10億分の1メートル)の空間分解能で、かつ、リアルタイムに撮影することができます。高速AFMを用いて、これまでにさまざまなタンパク質や生きた細胞のダイナミックな動きが明らかにされてきました。そこで、結晶構造から明らかになっている「スナップショット」に加え、水溶液中での「ダイナミクス」を明らかにすることにより、CRISPR-Cas9のはたらく仕組みの深い理解を目指し研究を行いました。
まず、高速AFMを用いてCas9単体を観察したところ、時間とともに次々にダイナミックに形を変える様子が捉えられました(図3)。これは、結晶構造では明らかになっていなかった予想外の発見でした。その一方、高速AFM動画において、Cas9-RNA複合体は、結晶構造と一致した安定な構造をとっていました(図4)。これらの結果から、Cas9単体の柔軟な構造はRNAとの結合に重要であること、および、RNAはCas9の立体構造の安定化に貢献していることが示唆されました。次に、標的配列を1つだけ含むDNAとCas9-RNA複合体を混合し高速AFM観察をしたところ、Cas9-RNA複合体はDNAと衝突を繰り返すことにより標的配列を見つけ出し、安定に結合する様子が明らかになりました(図5)。これまでCas9-RNA複合体がどのようにDNAの標的配列を探索するのか議論されてきましたが、高速AFM動画から、Cas9-RNA複合体はDNA上をスライドするのではなく、3次元方向への拡散を利用したDNAへの衝突により標的配列を探索することが直接的に示されました。さらに、DNAに結合したCas9-RNA複合体を詳細に観察すると、DNAを切断する「ハサミ」としてはたらく部分(HNHドメイン)が大きく揺らいだ構造をとることがわかりました。さらに、Cas9-RNA-DNA複合体を高速AFM観察している間に、切断反応に必要なマグネシウムイオンを添加したところ、HNHドメインがDNAの切断部位に移動したのち、切断されたDNAがCas9から離れる様子を撮影することに成功しました(図6)。これまでに、生化学的解析や結晶構造解析、蛍光プローブを用いた1分子観察の結果から、DNA切断の際にHNHドメインが“動く”ことが示唆されていましたが、どのように動くのかは不明でした。したがって、今回の高速AFM動画は、Cas9の「ハサミ」の動きをリアルスペースかつリアルタイムで可視化した画期的な研究成果といえます。
以上のように、Cas9単体、Cas9-RNA複合体、および、Cas9-RNA複合体によるDNAの探索と切断といった一連の過程を撮影した高速AFM動画から、CRISPR-Cas9によるDNA切断のダイナミクスが明らかになりました(図7)。本研究により得られた動的な構造情報は、より高効率・高精度なゲノム編集ツールの開発の基盤となることが期待されます。
<参考図>
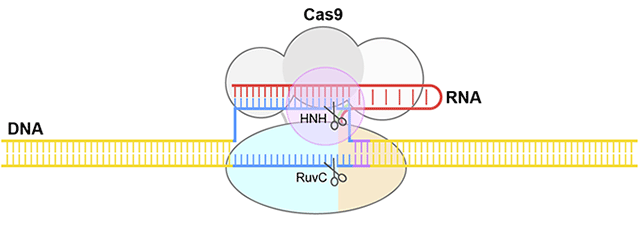
図1 CRISPR-Cas9によるDNA切断メカニズム
Cas9はいくつかの部分(ドメイン)から構成される。HNHおよびRuvCとよばれるドメインが「ハサミ」としてはたらき二本鎖DNAを切断する。
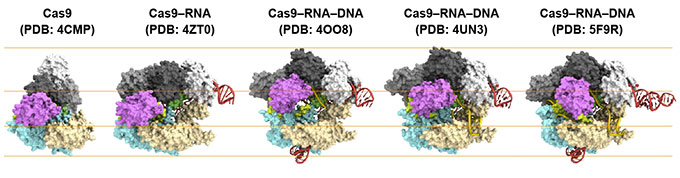
図2 CRISPR-Cas9の結晶構造

図3 Cas9単体の高速AFM動画

図4 Cas9-RNA複合体の高速AFM動画
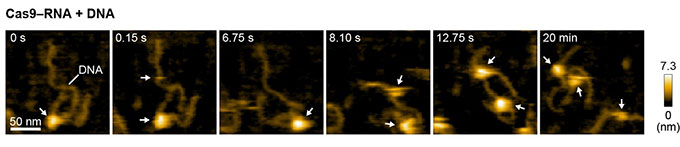
図5 Cas9-RNA複合体によるDNAの探索
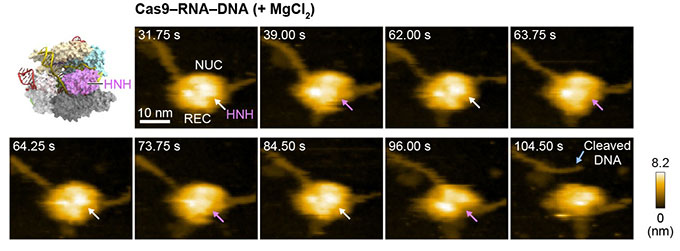
図6 Cas9-RNA複合体によるDNAの切断
DNAの切断部位に近い状態のHNHドメインをピンク色の矢印で示した。
※図3~図6の動画は、以下のURLよりご覧いただけます。
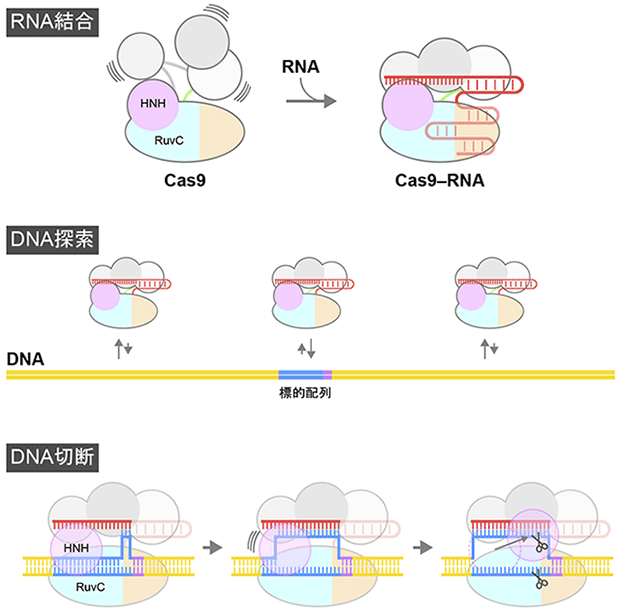
図7 CRISPR-Cas9によるDNA切断のダイナミクス
Cas9はガイドRNAと結合しCas9-RNA複合体を形成する。Cas9-RNA複合体はDNAと衝突を繰り返すことにより、ガイドRNAと相補的な標的配列を見つけ出し強固に結合する。Cas9-RNA複合体が標的配列に結合すると、DNAの巻き戻しが起こり、HNHドメインはDNAの近傍に移動し、相補鎖DNAを切断する。一方、RuvCドメインは一本鎖となった非相補鎖DNAを切断する。
<用語解説>
- 注1) ゲノム編集
- 生命の設計図であるゲノムDNAの塩基配列を改変する技術。CRISPR-Cas9(clustered regularly interspaced short palindromic repeats/CRISPR associated proteins)を利用することにより効率的なゲノム編集が可能になった。
- 注2) CRISPR-Cas9
- 微生物のもつ獲得免疫機構の1つ。CRISPR-Cas系において、Cas9はガイドRNAと結合し、ガイドRNAの一部(20塩基のガイド配列)と相補的なDNAを選択的に切断する。ガイド配列を変更することにより、さまざまな塩基配列をもつDNAを選択的に切断することができる。Cas9-RNA複合体をCRISPR-Cas9とよぶこともある。
- 注3) 高速AFM(高速原子間力顕微鏡)
- 柔らかい板バネの先に付いた針の先端で試料に触れ、試料の表面形状を可視化する顕微鏡。針と試料の水平方向の相対位置を変えながら試料表面の高さを計測することにより、試料の表面形状を可視化する。試料の表面を高速(最速33フレーム/秒)にスキャンすることにより試料の動きを可視化することができる。
<論文情報>
| タイトル |
“Real-space and real-time dynamics of CRISPR-Cas9 visualized by high-speed atomic force microscopy” |
| 著者名 |
Mikihiro Shibata, Hiroshi Nishimasu, Noriyuki Kodera, Seiichi Hirano, Toshio Ando, Takayuki Uchihashi, and Osamu Nureki |
| doi |
10.1038/s41467-017-01466-8 |
<お問い合わせ先>
<研究に関すること>
濡木 理(ヌレキ オサム)
東京大学 大学院理学系研究科 生物科学専攻 教授
Tel:03-5841-4392
E-mail:
柴田 幹大(シバタ ミキヒロ)
金沢大学 新学術創成研究機構 准教授
Tel:076-264-5927
E-mail:
<AMEDの事業に関すること>
日本医療研究開発機構 創薬戦略部 医薬品研究課 革新的バイオ医薬品創出基盤技術開発事業担当
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2219 Fax:03-6870-2244
<JST事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2067
E-mail:
<報道担当>
東京大学 大学院理学系研究科・理学部
武田 加奈子 特任専門職員、谷合 純子 学術支援職員、大越 慎一 教授・広報室長
Tel:03-5841-0654
E-mail:
金沢大学 総務部 広報室 戦略企画係
舘 正裕樹
Tel:076-264-5024
E-mail: 
金沢大学 研究推進部 研究推進課 機構支援係
髙田 将史
Tel:076-264-6186
E-mail: 
日本医療研究開発機構 経営企画部 企画・広報グループ
〒100-0004 東京都千代田区大手町1-7-1
Tel:03-6870-2245
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: