ポイント
- 脳への薬剤の送達を妨げる「血液脳関門(Blood-brain barrier:BBB)」を、既存の技術と比較して桁違いに高い効率で通過し、脳内の神経細胞へ送達できる「BBB通過型ナノマシン」の開発に成功しました。
- BBB通過型ナノマシンは、外部刺激(グルコース濃度の変化)に応答して能動的にBBBを通過するスマートな機能を有しています。食事などによって血糖値が変化することに伴うBBBの生理的な反応を利用した点が特徴であり、空腹時にナノマシンを注射してその後に食事をするという簡単な方法だけで脳内に薬を効率良く運ぶことができます。
- 医工連携の体制で開発されたBBB通過型ナノマシンは、様々な薬を脳内に運ぶことができます。特に、抗体医薬や核酸医薬など従来神経疾患には適応困難であった高分子医薬の脳への送達を初めて可能にする画期的な基盤技術であり、根本治療法が確立されていないアルツハイマー病などの難治性脳神経系疾患の治療薬開発を大幅に推進することが期待されます。
ナノ医療イノベーションセンターの片岡 一則 センター長(東京大学 政策ビジョン研究センター 特任教授)と安楽 泰孝 客員研究員(東京大学 大学院工学系研究科 特任助教)、東京医科歯科大学の横田 隆徳 教授、桑原 宏哉 特任助教らは、脳への薬剤送達を妨げる「血液脳関門(Blood-brain barrier:BBB)注1)」を、血中グルコース濃度(血糖値)の変化に応答して高効率で通過し、脳内へ集積する「BBB通過型ナノマシン注2)」の開発に成功しました。BBBを通過できる低分子薬剤でもその通過効率は必ずしも十分でなく、抗体や核酸医薬など、高分子物質でできている先端医薬はほとんど脳内移行できないために、アルツハイマー病などに代表される脳神経系疾患の治療薬開発の大きな障害となっています。研究チームが開発したBBB通過型ナノマシンは、外部刺激(グルコース)に応答してBBBを通過するスマートな機能を有しており、既存の技術と比較して桁違いに高い効率で脳に集積しました。さらに、BBBを通過したナノマシンは、多くの脳神経系疾患において治療標的となる神経細胞へと取り込まれることも明らかになりました。医工連携の体制で開発されたBBB通過型ナノマシンは、様々な薬剤を脳に送達するための基盤技術であり、真に有効な治療法が確立されていないアルツハイマー病などの難治性脳神経系疾患に対する、画期的な治療薬開発へと展開されることが期待されます。
本研究成果は、2017年10月17日(英国時間)に「Nature Communications」に掲載されました。
<発表内容>
先進国を中心に高齢化が進行し、アルツハイマー病に代表される難治性の脳神経系疾患は深刻な社会問題となっています。さらに今後も高齢者人口の増加に伴う大幅な有病率の増加が予想されています。脳神経系疾患治療を困難にしている最大の障壁が、血液脳関門(Blood-brain barrier:BBB)と呼ばれる生体内バリア機構です。BBBは脳血管内皮細胞を主体として、循環血液と脳神経系の物質輸送を制御する機能を担っており、脳の活動に必須な栄養素を選択的に取り込む反面、薬剤の脳への送達を著しく制限しています(図1)。現在、アルツハイマー病の対症療法として臨床で用いられている低分子薬剤であるドネペジルであっても、脳への集積量は投与量の0.1%に満たないのが現状です。そのため、薬剤がBBBを効率的に通過するための技術開発が世界中で行われています。このような背景において、研究チームは、血糖値の変化という簡単な刺激に応答して、既存技術と比較して著しく高い効率でBBBを通過し、さらに脳内の神経細胞へと集積する「BBB通過型ナノマシン」の開発に成功しました。
BBBを構築する脳血管内皮細胞には、脳のエネルギー源であるグルコース(ブドウ糖)を輸送するためのグルコーストランスポーター1(GLUT1)が他のトランスポーターと比べ桁違いに多く存在していることから、薬剤またはそのキャリアにグルコースを結合させて脳へ送達させようという試みが世界中でなされてきましたが、脳内に十分に送達させることはできませんでした。研究チームは、GLUT1の脳血管内皮細胞における細胞内の局在部位が血糖値の変化に伴って変わることに着目し、グルコースを外部刺激として与えるという生物学的手法を導入することにより、スムーズにBBBを通過できる薬剤送達が実現できるのではないかと考えました。
そこで、生体への安全性が担保された高分子を構成分子とするナノ粒子の表層にグルコースを適切に導入し、脳血管内皮細胞に局在するGLUT1を的確に認識する直径30nmのナノマシンを構築しました(図2)。ナノマシンを空腹状態のマウスに静脈投与し、その30分後にグルコース溶液を投与することで、最大で投与量の約6%が脳へ集積することが確認されました。これはグルコース非結合ナノマシンと比べ、100倍以上高い集積量となります(図3)。一方、食事を自由にさせたマウスでは、ナノマシンを注射しても脳にほとんど集積しませんでした。また脳内でのナノマシンの挙動を顕微鏡で観察したところ、グルコースに応答してBBBを通過するスマートな機能を有していることをリアルタイムに確認し(図3)、さらに脳の深部に至るまで一様に分布することを確認しました(図4)。またBBBを通過したナノマシンは、脳内の神経細胞へと取り込まれることを明らかにしました(図4)。神経細胞への薬剤送達は、多くの脳神経系疾患の治療を実現するうえで大変重要です。
これまでの脳神経系疾患の治療薬の開発では、高分子医薬はBBBを通過できず、低分子薬剤でもBBBを効率的に通過できない場合が少なくないことから、十分な治療効果が得られず、治療薬開発の大きな制限になっていました。ナノマシンは、あらゆる薬剤のBBB通過能を著しく高め、抗体医薬や核酸医薬などのこれからの先端医療を担うバイオ医薬の薬剤を封入することを可能にして、脳神経系疾患の治療薬の開発に大きなイノベーションとして、計り知れないインパクトを学術分野、医療並びに社会にもたらすことが期待されます。
なお、本研究は、日本学術振興会(JSPS) 科学研究費助成事業の「特別推進研究(JP25000006)」、国立研究開発法人 科学技術振興機構(JST)の研究成果展開事業「センター・オブ・イノベーション(COI)プログラム」、国立研究開発法人 日本医療研究開発機構(AMED)の「脳科学研究戦略推進プログラム」の支援によって行われました。
<参考図>
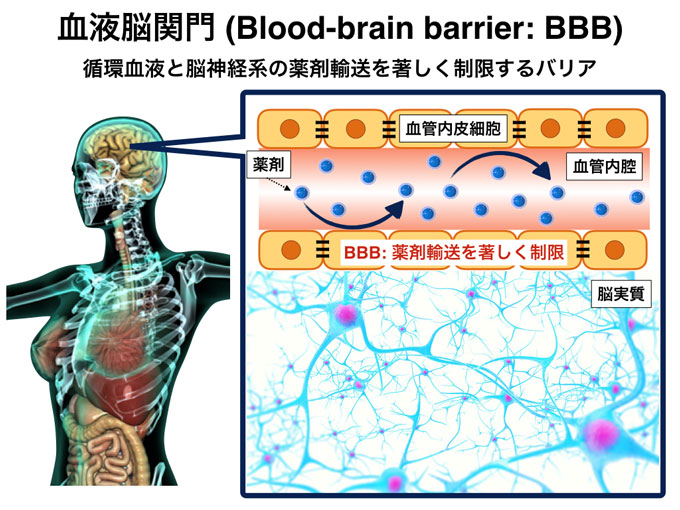
図1 血液脳関門概念図
脳血管内皮細胞を主体として、循環血液と脳神経系の物質輸送を制御する機能を担っており、脳の活動に必須な栄養素を選択的に取り込む反面、薬剤の脳への送達を著しく制限する生体内バリアです。
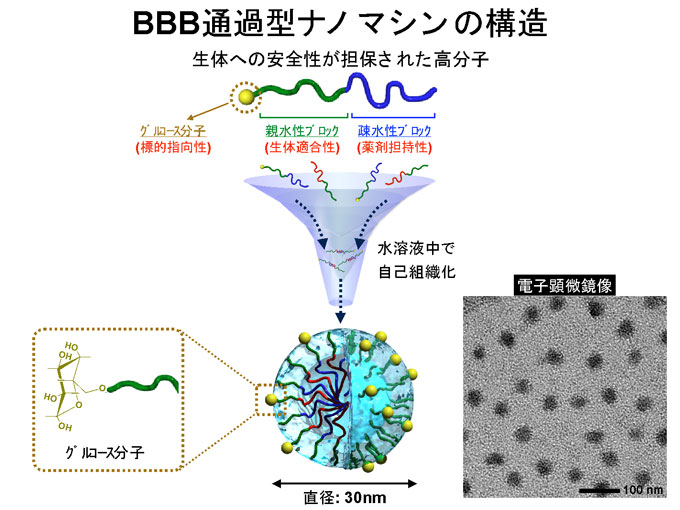
図2 BBB通過型ナノマシンの構造
生体への安全性が担保された高分子が水溶液中で自己組織化することで構築されます。表層にはGLUT1を認識するためにグルコース分子を複数個搭載しており、大きさは直径30nmほどです。(Nature Communications誌Fig.1)
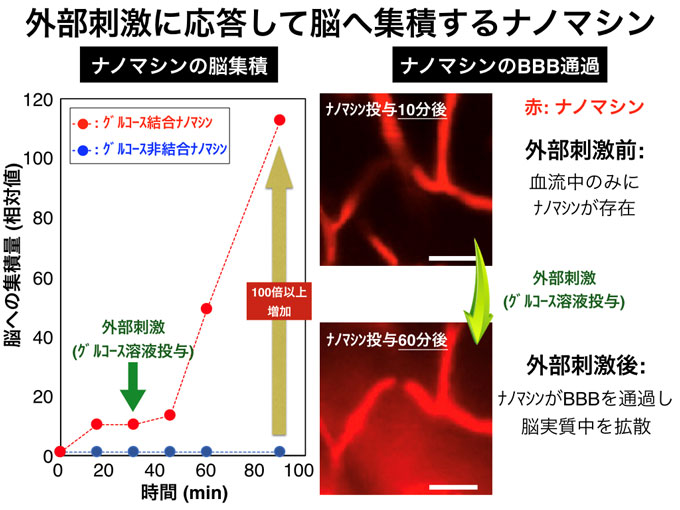
図3 外部刺激(グルコース投与)に応答して脳へ集積するナノマシン
グルコース結合ナノマシンは、外部刺激に応答してグルコース非結合ナノマシンと比べ100倍以上(投与量の6%)が脳へ集積することを確認しました。これは、現在対症的に用いられているアルツハイマー病の治療薬と比較すると約100倍高い効率になります。また脳内におけるナノマシン(赤色)の挙動をリアルタイム観察したところ、外部刺激に応答してBBBを通過し、脳実質中を拡散する様子を観察することに成功しました。(Nature Communications誌Fig.3a)
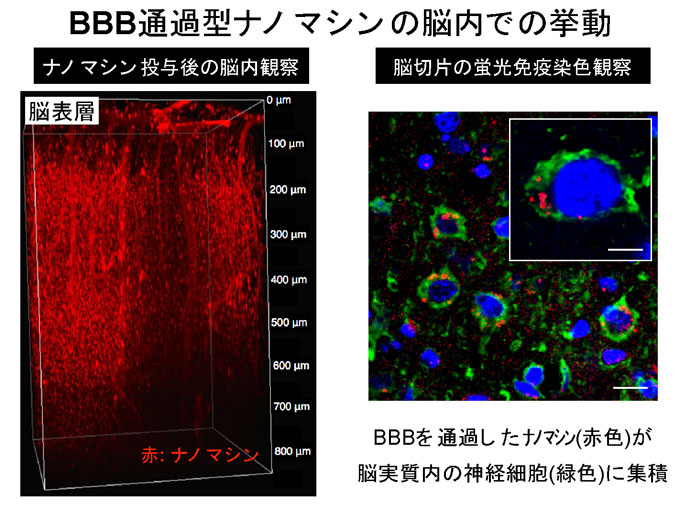
図4 BBB通過型ナノマシンの脳内での挙動
BBBを通過したナノマシン(赤色)は、脳の深部に至るまで一様に分布することを確認しました。また脳実質部において、特に神経細胞へと取り込まれることを明らかにしました。(Nature Communications誌Fig.3c、4b)
<用語解説>
- 注1) 血液脳関門(Blood-brain barrier:BBB)
- BBBは、脳血管内皮細胞を主体として、循環血液と脳神経系の物質輸送を制御する機能を担っており、脳の活動に必須な栄養素を選択的に取り込む反面、薬剤の脳への送達を著しく制限する生体内バリアです。アルツハイマー病に代表される脳神経系疾患が難治性である原因の一つとなっています。実際に現在、アルツハイマー病の対症療法として臨床で用いられている薬剤であっても、脳への集積量は投与量の0.1%に満たないのが現状です。こうしたことから、BBBを効率的に通過して、薬剤を脳へ送り届ける技術の開発は非常に重要です。
- 注2) BBB通過型ナノマシン
- BBB通過型ナノマシンは、生体への安全性が担保された合成高分子を構成分子とするナノ粒子の表層にグルコースを適切に導入し、脳血管内皮細胞に局在するグルコーストランスポーター1(GLUT1)を的確に認識し、外部刺激(グルコース)に応答してBBBを通過するというスマートな機能を有しているナノマシンです。このナノマシンは、生体適合性に優れた高分子材料の外殻で覆われているために、生体内で異物認識されることなく、安定に血中を循環することが可能です。ナノマシンを構成する高分子の構造を変えることで、多種多様な薬剤を封入することが可能であることから、本技術は様々な脳神経系疾患治療へと展開可能な汎用性の高いナノマシンだと期待できます。
<論文情報>
| タイトル |
“Glycaemic control boosts glucosylated nanocarrier crossing the BBB into the brain” |
| 著者名 |
Yasutaka Anraku, Hiroya Kuwahara, Yu Fukusato, Akihiro Mizoguchi, Takehiko Ishii, Keiko Nitta, Yu Matsumoto, Kazuko Toh, Kanjiro Miyata, Satoshi Uchida, Kazutaka Nishina, Kensuke Osada, Keiji Itaka, Nobuhiro Nishiyama, Hidehiro Mizusawa, Tatsuya Yamasoba, Takanori Yokota and Kazunori Kataoka |
| 掲載誌 |
Nature Communications |
| doi |
10.1038/s41467-017-00952-3 |
<お問い合わせ先>
<研究に関すること>
片岡 一則(カタオカ カズノリ)
川崎市産業振興財団 ナノ医療イノベーションセンター センター長
Tel: 044-589-5812
E-mail:
横田 隆徳(ヨコタ タカノリ)
東京医科歯科大学 医歯学総合研究科 脳神経病態学分野(神経内科) 教授
Tel:03-5803-5233
E-mail:
<ナノマシンに関すること>
安楽 泰孝(アンラク ヤスタカ)
東京大学 大学院工学系研究科 バイオエンジニアリング専攻 特任助教
Tel:03-5841-7138
E-mail:
<生物学的機能解析に関すること>
桑原 宏哉(クワハラ ヒロヤ)
東京医科歯科大学 医歯学総合研究科 脳神経病態学分野(神経内科) 特任助教
Tel:03-5803-5234
E-mail:
<AMED事業に関すること>
日本医療研究開発機構 戦略推進部 脳と心の研究課
Tel:03-6870-2222 Fax:03-6870-2244
E-mail:
<JSTの事業に関すること>
酒井 重樹(サカイ シゲキ)
科学技術振興機構 イノベーション拠点推進部 COIグループ
Tel:03-5214-7997
E-mail:
<報道担当>
松枝 温子(マツエダ アツコ)
川崎市産業振興財団 COINS支援事務局
Tel:044-589-5785
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: