ポイント
- パーキンソン病の一因となる不良ミトコンドリアに付けられる目印を切断除去する仕組みは不明であった。
- 目印を切断する酵素USP30が機能している状態の立体構造を高解像度で決定して目印であるユビキチン鎖を切断する仕組みを明らかにした。
- 目印の切断を阻害する化合物はパーキンソン病の治療薬候補であり、その開発につながることが期待される。
JST 戦略的創造研究推進事業の一環として、東京大学の深井 周也 准教授らは、パーキンソン病関連たんぱく質USP30とユビキチン鎖注1)が結合した状態の立体構造を決定し、そのユビキチン鎖切断メカニズムを解明しました。
これまでの研究により、神経変性疾患であるパーキンソン病注2)の原因の1つに、神経細胞における不良ミトコンドリアの蓄積があることが分かっていました。通常の細胞では、健常なミトコンドリア注3)が不良ミトコンドリアになるとユビキチン鎖が付加され、それを目印としてオートファジー注4)による分解が行われます。一方、USP30は常にミトコンドリア外膜上に存在し、ミトコンドリア上のユビキチン鎖を切断除去することで、ミトコンドリアの過剰な分解が起きないように制御していると考えられています。しかし、USP30がどのようにしてユビキチン鎖の切断除去を行うのか、そのメカニズムは全く不明でした。
本研究グループは、USP30とユビキチン鎖との複合体の立体構造を高解像度で決定して切断メカニズムを明らかにしました。さらに、最先端の質量分析法を駆使して、USP30によるミトコンドリア上のユビキチン鎖の切断を解析しました。 USP30の阻害剤はパーキンソン病に対する創薬シーズとして注目されています。本研究で解明したUSP30の高解像度の構造情報は、阻害剤設計の重要な足がかりとなり、パーキンソン病の治療薬開発につながることが期待されます。
本研究は、東京都医学総合研究所の田中 啓二 所長らと共同で行ったものです。
本研究成果は、2017年9月26日(英国時間)に英国科学誌「Nature Structural & Molecular Biology」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長兼所長) |
| 研究課題名 |
「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」 |
| 研究代表者 |
深井 周也(東京大学 分子生物学研究所 准教授) |
| 研究期間 |
平成24年10月~平成30年3月(予定) |
JSTは本領域で、先端的ライフサイエンス領域と構造生物学との融合により、ライフサイエンスの革新に繋がる「構造生命科学」と先端基盤技術の創出を目指します。上記研究課題では、シナプス形成を誘導するたんぱく質複合体を解析することでシナプス形成のメカニズムを原子レベルの解像度で明らかにし、その情報に基づいてシナプス形成を制御する方法を開発します。
<研究の背景と経緯>
酵母からヒトにいたる真核生物の細胞内では、76個のアミノ酸で構成される小さなたんぱく質であるユビキチン注5)が多様な生物プロセスを制御しています。ユビキチンの重要性は広く認知されており、その発見とたんぱく質分解における役割を解明した研究者に対して、2004年にノーベル化学賞が授与されました。多くの場合、ユビキチンは数珠つなぎになった鎖(ユビキチン鎖)として働くことが分かっています。そのつながりかたの違いはユビキチン鎖の多様な役割と関連しています。
共同研究者の田中 啓二 東京都医学総合研究所 所長の研究グループは、神経細胞における不良ミトコンドリアの蓄積が神経変性疾患であるパーキンソン病の原因の1つであることを明らかにしました。通常の細胞では、健常なミトコンドリアがさまざまなストレスにより不良ミトコンドリアになるとユビキチン鎖が付加され、それを目印としてオートファジーによる分解が行われます(図1)。このユビキチン鎖の特徴として、これまでほとんど機能が分かっていなかった鎖(Lys6鎖)が含まれていることがあげられます。
USP30は常にミトコンドリア外膜上に存在し、ミトコンドリア上のユビキチン鎖のうち、特にLys6鎖を切断除去することで、ミトコンドリアの過剰な分解が起きないように制御していると考えられています。したがって、USP30の機能解明はパーキンソン病発症メカニズムの理解につながるものであり、大きな注目を集めていました。しかし、USP30の機能を理解する上で最も重要なユビキチン鎖の切断メカニズムの詳細についてはこれまで一切明らかにされていませんでした。
<研究の内容>
研究グループは、Lys6鎖が結合したUSP30の結晶を作製し、大型放射光施設SPring-8 BL41XUの高輝度X線と高度化した測定装置を利用して、その立体構造を高解像度で決定しました(図2)。この立体構造により、USP30がLys6鎖を選択的に認識して切断する詳細なメカニズムが明らかになりました。これまでにさまざまなユビキチン鎖(Lys48鎖、Lys63鎖、Met1鎖など)の認識メカニズムが明らかにされていましたが、Lys6鎖の認識メカニズムは全く不明でした。本研究において、世界で初めてLys6鎖を認識する仕組みが明らかとなりました。さらに、田中所長らとの共同研究で、最先端の質量分析法を駆使してUSP30によるミトコンドリア上のポリユビキチン鎖の切断を解析し、細胞環境により近い状態におけるUSP30の機能を解析しました。
<今後の展開>
パーキンソン病は高齢になるほど有病率が高くなるため、社会の高齢化に伴って患者数は増加しつづけており、発症メカニズムの解明と根本的な治療法の確立が社会的に強く望まれています。USP30の阻害は不良ミトコンドリアの除去を促進させることから、USP30の阻害剤はパーキンソン病に対する治療薬の候補として注目されています。本研究で解明したUSP30の高解像度の構造情報は、阻害剤設計の重要な足がかりとなり、パーキンソン病の治療薬開発につながることが期待されます。
<参考図>
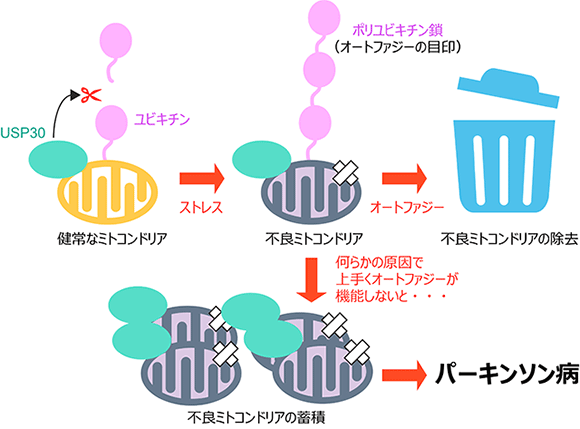
図1 不良ミトコンドリアの蓄積を原因とするパーキンソン病とUSP30との関係
健常なミトコンドリアでは、USP30が余分なユビキチン鎖を切断することでミトコンドリアが過剰に分解されないように調節しているが、ストレスによって傷ついた不良ミトコンドリアでは、USP30が切断できる能力を超えたユビキチン鎖が付加される。さらに、付加されたユビキチン鎖を目印としてオートファジーによる不良ミトコンドリアの分解が起きることで不良ミトコンドリアが細胞内に蓄積して神経細胞が破壊され、パーキンソン病の発症につながる。
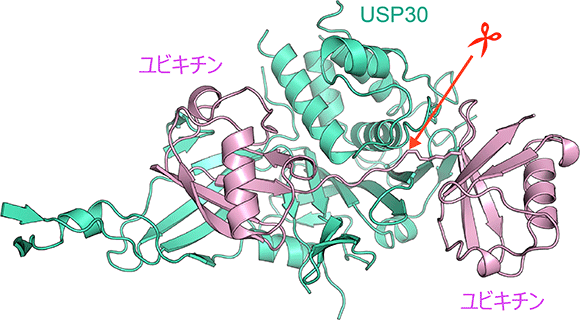
図2 Lys6鎖が結合したUSP30の立体構造
連結した2つのユビキチンをUSP30が同時につかみ、連結部分を切断する様子を高解像度で捉えることに成功した。
<用語解説>
- 注1) ユビキチン鎖
- 複数のユビキチンがメチオニン、もしくはリジン残基で数珠状につながったたんぱく質。つながりかたが異なるユビキチン鎖が8種類存在し、つながりかたによって機能と構造が異なる。
- 注2) パーキンソン病
- 国内だけでも約15万人もの患者がいる、進行性の神経変性疾患。神経細胞の変性によって神経伝達物質ドーパミンが減少し、安静時の手足の震え、歩行障害、動作緩慢などの運動障害に加え、さまざまな全身症状や精神症状がおこる。複数のタイプがあり、発症要因の1つとして不良ミトコンドリアの蓄積がある。
- 注3) ミトコンドリア
- 真核生物の細胞中に含まれる小器官で、酸素呼吸の場として働く。機能が低下した不良ミトコンドリアが細胞内に蓄積すると、活性酸素が細胞質内に漏れ出し細胞にとって有害である。
- 注4) オートファジー
- 細胞内の大規模な分解システムで、大小問わずさまざまな細胞内成分をオートファゴソームと呼ばれる脂質膜の袋で包み込み、細胞内で分解を司るリソソームと融合させて分解する。
- 注5) ユビキチン
- 76個のアミノ酸からなる小さなたんぱく質で、C末端のグリシン残基が標的のたんぱく質と結合することで、細胞内の多様な反応の目印となる。
<論文情報>
| タイトル |
“Structural basis for specific cleavage of Lys6-linked polyubiquitin chains by USP30”
(USP30によるLys6結合型ポリユビキチン鎖特異的な切断の構造基盤) |
| 著者名 |
Yusuke Sato, Kei Okatsu, Yasushi Saeki, Koji Yamano, Noriyuki Matsuda, Ai Kaiho, Atsushi Yamagata, Sakurako Goto-Ito, Minoru Ishikawa, Yuichi Hashimoto, Keiji Tanaka and Shuya Fukai
|
| 掲載誌 |
Nature Structural & Molecular Biology |
| doi |
10.1038/nsmb.3469 |
<お問い合わせ先>
<研究に関すること>
深井 周也(フカイ シュウヤ)
東京大学 分子細胞生物学研究所 准教授
〒113-0032 東京都文京区弥生1-1-1 東京大学 分子細胞生物学研究所 本館306
Tel:03-5841-7807 Fax:03-5841-0706
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: