ポイント
- 染色体構成タンパク質であるヒストンの化学修飾はがん抑制遺伝子などの遺伝子の転写促進に重要な役割を担っている。
- ヒストンを選択的にアセチル化する人工化学触媒システムを開発した。
- 生体機能の解明に有用な実験技術や疾患治療技術への応用が期待される。
科学技術振興機構(JST) 戦略的創造研究推進事業において、東京大学 大学院薬学系研究科の金井 求 教授、川島 茂裕 特任講師、山次 健三 助教らのグループは、染色体に対してアセチル化注1)という化学修飾注2)を選択的に行う人工化学触媒注3)システム(SynCAcシステム)を開発しました。さらに、本触媒システムを用いてヌクレオソーム(染色体の最小単位)をアセチル化することにより、遺伝子の転写注4)を人工的に促進できる可能性が示唆されました。
ヌクレオソームは、ヒストンと呼ばれるタンパク質とDNAの複合体から構成されています。ヒストンは生体内の酵素によって、アセチル化に代表される種々の化学修飾を受けます。これらの化学修飾は遺伝子の転写制御に深く関与しています。
本研究グループは、DNAを認識してヌクレオソームに結合する触媒とアセチル化剤注5)の組み合わせから成る人工化学触媒システムを開発することで、生体内の酵素を介さずにヒストンを人工的にアセチル化修飾することに成功しました。さらに、この人工的な化学修飾がヌクレオソームの性質を変化させ、遺伝子の転写を促進する可能性を見いだしました。また、人工化学触媒システムを適切に変えることで、アセチル化に限らずマロニル化注6)反応も進行できたことから、広く他の化学修飾への応用が示唆されました。
今後、この人工化学触媒システムは、生体内反応の機能を解明するのに有用な実験技術の開発や、生体内酵素による触媒反応との代替により治療効果をもたらす“触媒医療”への応用が期待されます。すなわち、新たな疾患治療ツールとして将来の医療の進歩に貢献することが期待されます。
本研究成果は、2017年6月8日(米国東部標準時間)にCell Pressの「Chem」誌オンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
JST 戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
「金井触媒分子生命プロジェクト」 |
| 研究総括 |
金井 求(東京大学 大学院薬学系研究科 教授) |
| 研究期間 |
平成23年8月~平成29年3月 |
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
<研究の背景と経緯>
生命の遺伝情報は細胞の核内に存在する染色体に記録されており、染色体の最小単位は、ヒストンと呼ばれるタンパク質とDNAの複合体(ヌクレオソーム)から構成されています。DNAに保存されているほとんどの遺伝情報は転写を経て最終的にタンパク質に変換されることで発現しており、遺伝子の転写は生命現象において非常に重要な過程です。ヒストンは酵素によってさまざまな化学修飾を受けており、その修飾によって遺伝子の転写が促進されたり抑制されたりしています。
特に、ヒストンのアセチル化修飾は、がん抑制遺伝子などの遺伝子の転写を促進することが知られており、ある種のがん細胞のヒストンはアセチル化が抑制され、がん抑制遺伝子の転写も抑制された状態にあることが知られています。本研究グループでは、ヒストンの化学修飾反応を促進する人工触媒を用いて、生体内の酵素を介さずにヒストンのアセチル化修飾をすることができれば、例えばがん細胞においてはがん抑制遺伝子を含む遺伝子の転写が活発になり、抗がん活性が発現して疾患の治療につながると考えました。また、この技術はがんだけではなく多様な疾病の治療に発展することが期待されます。そこで、本研究の目的であるヒストン選択的な化学触媒の開発に着手しました (図1)。
<研究の内容>
本研究グループは、DNAに結合する触媒とアセチル化剤を組み合わせてヌクレオソームと反応させることで、ヌクレオソームのヒストン選択的な人工アセチル化修飾ができると考えました。そこでDNAが負の電荷性を帯びている性質を利用し、DNAに親和性を持つ分子として正の電荷性を持つ触媒とアセチル化剤を設計しました。これらを同時に用いる人工化学触媒システム“SynCAcシステム”(SynCAc:Synthetic Chromatin Acetylation)により、さまざまなタンパク質が混在する中でもヒストン選択的にアセチル化が進行することが見いだされました(図2)。
さらにこの人工化学触媒システムによって導入されたアセチル化が、ヌクレオソームの性質を変化させる(図3(a))ことや、染色体再構成因子という生体内に存在するタンパク質の存在下で転写を促進する(図3(b))ことが見いだされました。これは人工の化学触媒システムが生体内の酵素と同等の機能を示し得ることを示唆しています。また、アセチル化剤をマロニル化剤に変えるとマロニル化反応が進行し、この場合はアセチル化の場合よりもヌクレオソームの性質が大きく変化することが分かりました(図3(a))。このように、今回開発した人工化学触媒システムは他の化学修飾に広く一般化できる可能性があります。例えば、天然に存在しない化学修飾を導入して新たな生命現象を引き起こしたり、生体内ヒストン修飾の生物学的機能を解明する手法として活用したりすることができると考えられます。
<今後の展開>
今回開発した人工化学触媒システムは、酵素に代わってヒストンの選択的アセチル化を促進し、遺伝子の転写が起こりやすい構造に変換することができます。人工的なアセチル化修飾が可能になると、目的遺伝子の転写を促進し、さまざまな疾患治療につながることが期待されます。生体内に人工化学触媒システムを導入し、これが化学反応を促進することにより、生体に治療効果をもたらすという概念を本研究グループは、“触媒医療”と呼んでおり、この概念から導かれる疾病治療は特に酵素が失活・欠損している疾患(例えば一部のリンパ腫など)に対して、既存の手法よりも有効であると考えています。さらに、人工化学触媒システムを用いて、人工的に各種の化学修飾を導入できることから、生体内分子の化学修飾の機能やメカニズムの解明に向けた基盤的な技術としても有用であると期待されます。
このように、本研究成果は、基礎研究においては生体内反応の機能を解明するための有用な実験技術として、また臨床においては疾患の新たな治療法の開発として、これら両面から、将来の医療の進歩に貢献することが期待されます。
<参考図>
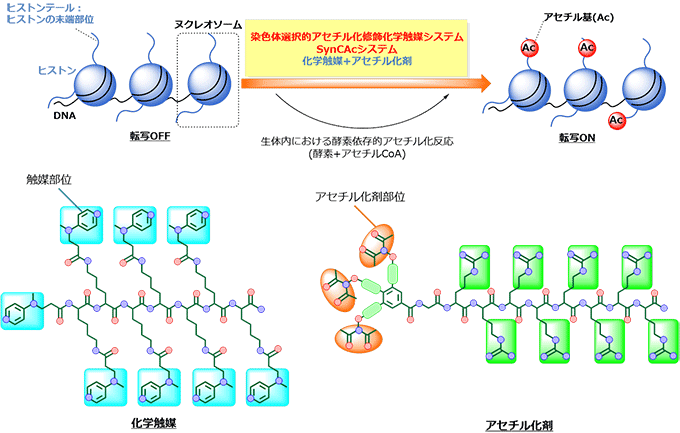
図1 今回開発した触媒系の概要
生体内では酵素によって担われているヒストンのアセチル化修飾を、今回開発した人工化学触媒システム(SynCAcシステム)は酵素に依存せずに触媒とアセチル化剤の組み合わせで人工的に行うことができる。また、アセチル化修飾を受けたヒストンは転写が促進される性質があることが知られている。

図2 SynCAcシステムによるヒストン選択的なアセチル化
ヒストン結合能を持たない化合物を用いた場合①では、ヒストン以外のタンパク質が非選択的にアセチル化されているが、SynCAcシステムを用いた場合②では、ヒストンのアセチル化が選択的に進行する。
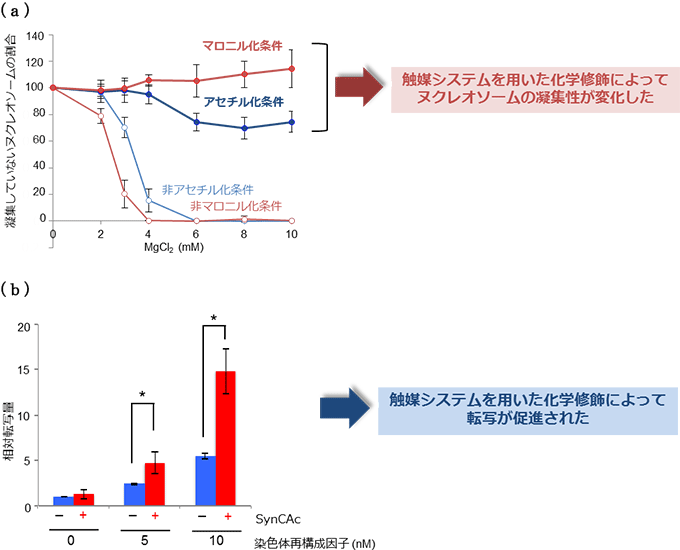
図3 今回開発した触媒系を用いた修飾による生物学的機能の発現
- (a)ヌクレオソームの構造的性質である凝集注7)性の変化
未修飾のヌクレオソームは高濃度のマグネシウムイオン存在下で凝集することが知られているが、今回の触媒系でアセチル化・マロニル化修飾を行ったヌクレオソームは高濃度のマグネシウムイオン存在下でも凝集が抑えられている。
- (b)染色体再構成因子存在下での転写の促進効果
SynCAcシステムによる化学修飾を受けたヌクレオソームでは、染色体再構成因子存在下での転写が未修飾のものと比べて促進されている。染色体再構成因子がアセチル化部位を認識してヌクレオソームに結合しやすくなることが要因であると考えられる。
<用語解説>
- 注1) アセチル化
- アセチル基-C(=O)-CH3を有機化合物(この場合はタンパク質表面の置換基)に導入する反応のこと。
- 注2) 修飾
- タンパク質などの生体高分子や高分子に含まれる特定の置換基を化学反応によって変化させること。化学修飾も同義。
- 注3) 触媒
- 特定の化学反応を進行させやすくする分子。
- 注4) 転写
- 染色体のDNA上の塩基配列を元に、転写産物であるRNAが合成されること。遺伝子が機能するための過程の1つ。
- 注5) アセチル化剤
- アセチル化反応において、アセチル基を供与する反応剤(化合物)のこと。
- 注6) マロニル化
- マロニル基-C(=O)-CH2-C(=O)-OHを有機化合物(この場合はタンパク質表面の置換基)に導入する反応のこと。
- 注7) 凝集
- 溶解している分子同士が相互作用によって近接し、凝り固まること。この場合は、ヌクレオソーム同士が相互作用して凝り固まり、沈殿する。
<論文情報>
| タイトル |
“Synthetic chromatin acylation by an artificial catalyst system” |
| 著者 |
Tadashi Ishiguro, Yoshifumi Amamoto, Kana Tanabe, Jiaan Liu, Hidetoshi Kajino, Akiko Fujimura, Yuki Aoi, Akihisa Osakabe, Naoki Horikoshi, Hitoshi Kurumizaka, Kenzo Yamatsugu, Shigehiro A. Kawashima*, Motomu Kanai*
(*責任著者)
|
| doi |
10.1016/j.chempr.2017.04.002 |
<お問い合わせ先>
<研究に関すること>
金井 求(カナイ モトム)
東京大学 大学院薬学系研究科 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4830 Fax:03-5684-5206
E-mail:
<JSTの事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
東京大学 薬学部・薬学系研究科 庶務チーム
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4719 Fax:03-5841-4711
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: