ポイント
- 生体が持つアセチル化剤を活性化して、染色体構成タンパク質であるヒストンを位置選択的に化学修飾する触媒を開発した。
- 染色体を構成するヒストンの特定の位置に化学修飾を導入することにより、染色体の物性を変化させる効果があることを明らかにした。
- 生体内酵素の代替により疾患の治療を行う“触媒医療”への応用が期待される。
科学技術振興機構(JST) 戦略的創造研究推進事業において、東京大学 大学院薬学系研究科の金井 求 教授、川島 茂裕 特任講師、山次 健三 助教らのグループは、細胞が用いるアセチル化剤注1)(アセチルCoA)を活性化して、標的とするタンパク質の狙った部位に対して、アセチル化注2)という化学修飾注3)を選択的に導入する触媒注4)を開発しました。
染色体注5)は、ヒストンと呼ばれるタンパク質とDNAから構成されています。ヒストンは生体内の酵素によって、アセチル化に代表される種々の化学修飾を受けます。化学修飾を受けるヒストンの部位や化学修飾の種類によって、異なる機能が発現することから、ヒストンの化学修飾はさまざまな生命現象の制御に関与していると考えられています。
本研究グループは、アセチル化を導入したいヒストン部位の近くでのみアセチルCoAを活性化する、位置選択的なアセチル化が可能な触媒を開発しました。さらに、この触媒を用いることで、アセチルCoAを介したアセチル化のみならず、ヒストンに対して多様な化学修飾を導入することができました。また、本触媒を用いてヒストンの特定の位置(H2BK120)を位置選択的にアシル化注6)することにより、染色体の物性が変化することを解明しました。このことは、今回開発した触媒を用いることにより遺伝子の転写注7)を人工的に促進できる可能性を示唆しています。
この触媒は、ヒストン化学修飾を介した生命現象を理解するための有用な研究ツールとなるだけでなく、生体内酵素を人工触媒により代替することで疾患を治療する“触媒医療”への応用が期待されます。
本研究成果は、2017年5月23日(米国東部時間)に米国化学会誌「Journal of the American Chemical Society」のオンライン速報版で公開されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
JST 戦略的創造研究推進事業 総括実施型研究(ERATO)
| 研究プロジェクト |
「金井触媒分子生命プロジェクト」 |
| 研究総括 |
金井 求(東京大学 大学院薬学系研究科 教授) |
| 研究期間 |
平成23年8月~平成29年3月 |
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
<研究の背景と経緯>
生命の遺伝情報は細胞の核内に存在する染色体に記録されています。染色体は、ヒストンタンパク質とDNAの複合体(ヌクレオソーム)から構成されており、生体内にある酵素によってヒストンのさまざまな部位に種々の化学修飾を受けます。化学修飾を受けるヒストンの部位や化学修飾の種類によって、異なる機能が発現することから、ヒストンの化学修飾は、遺伝子の転写などさまざまな生命現象の制御に関与していると考えられています。
ヒストンの代表的な化学修飾としてアセチル化が挙げられます。通常、アセチル化修飾は生体内酵素によるアセチルCoAの活性化を介して起こりますが、ある種のがん細胞などでは、このような酵素の機能が失われるなどの要因でアセチル化が抑制され、がん抑制遺伝子の転写も抑制された状態にあります。本研究グループは、人工触媒が生体内酵素によるヒストンのアセチル化反応を代替できれば、失われた酵素の機能を補う疾患治療戦略として有用と考え、研究に着手しました(図1)。
<研究の内容>
ヒストンの特定の位置に選択的な修飾を導入するため、標的部位の近くのみでアセチルCoAが活性化されるような触媒設計を行いました(図2(a))。この触媒を用いることで、アセチルCoA存在下でヒストンに対して位置選択的かつ高収率でアセチル化修飾を導入することができました(図2(b))。また、アセチルCoAの代わりに各種のアシルCoAを用いた場合でも、触媒によるヒストンの位置選択的な修飾反応が進行し、各種アシル化修飾を導入することができました(図3(a))。さらに、本触媒を用いて、細胞から抽出したヒストンの特定の位置(H2BK120)にアセチル化修飾を導入し、この修飾が染色体の構造や物性を遺伝子の転写が起こりやすくなるように変化させることを解明しました(図3(b))。
これらのことから、本触媒を用いてヒストンに対して位置選択的なアシル化修飾を行うことにより、遺伝子の転写を促進できる可能性が示唆されました。
<今後の展開>
今回開発した触媒は、生体内の酵素のようにアセチルCoAを活性化してヒストンの位置選択的なアセチル化修飾を導入し、遺伝子の転写が起こりやすい構造に変換することができます。人工的なアセチル化修飾が可能になると、目的遺伝子の転写を促進することにより、さまざまな疾患治療につながることが期待されます。開発した触媒を導入し、生体内酵素による反応を代替することで疾患への治療効果をもたらすという概念を、本研究グループは“触媒医療”と呼んでおり、特に酵素が失活・欠損している疾患(例えば一部のリンパ腫など)に有効と考えています。さらに、本触媒は、各種の化学修飾をヒストンへと位置選択的に導入できることから、化学修飾を介した生命現象を理解するための研究ツールとしても有用であると期待されます。
本研究成果は、基礎研究においては生体内修飾反応の機能を解明するための有用なツールとして、また臨床応用においては疾患の新たな治療法の開発として、両面から将来の医療の進歩に貢献することが期待されます。
<参考図>
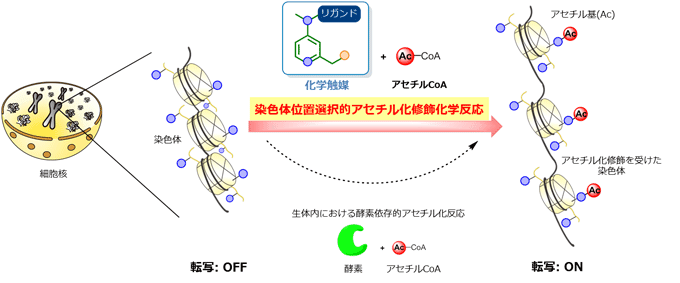
図1 今回開発した触媒の基本概念
細胞内ではヒストンが酵素によってアセチル化修飾を受けると染色体の構造が緩み、遺伝子転写が促進されることが知られている。生体内酵素が担うヒストンのアセチル化反応を代替する触媒を開発することで、ヒストンのアセチル化修飾を人工的に導入し、遺伝子の転写を促進することが可能と考えられる。
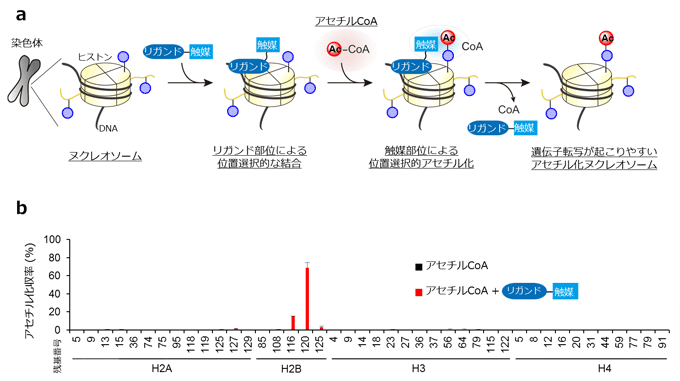
図2 今回開発した触媒によるヒストンの位置選択的なアセチル化反応
- (a)ヒストンに対して位置選択的に反応を進行させる分子設計
触媒部位とヒストンに結合するリガンド注8)部位を併せ持つ分子を用いることにより、分子をヒストンの特定の位置に結合させる分子設計を行った。これにより、ヒストンの特定の位置に選択的にアセチル化修飾を導入することができた。また、このような分子設計戦略により、リガンド部位をつなぎ替えるだけで、ヒストンの別の部位を狙ってアセチル化することもできた。
- (b)開発した触媒分子を用いた試験管内でのヌクレオソームの位置選択的なアセチル化修飾
上述の分子を用いることで、ヒストンの特定の位置(H2BK120)に選択的かつ高収率でアセチル化修飾を行うことができた。
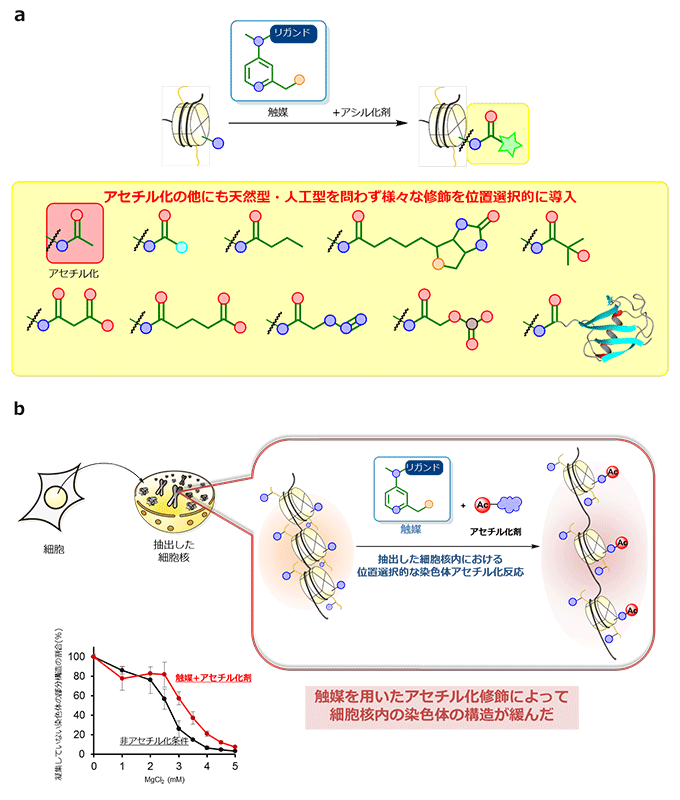
図3 開発した触媒を用いた種々のアシル化修飾への応用と触媒反応による染色体構造への作用
- (a)各種のアシルCoAやアシル化剤を用いることで、開発した触媒の修飾反応をアセチル化だけでなくさまざまな修飾へ展開することができた。展開された修飾は細胞内において存在が確認されている修飾(天然型)、細胞内において存在が確認されていない修飾(人工型)を問わず多岐にわたる。
- (b)細胞から核を抽出して、触媒を用いてアセチル化修飾を導入した。染色体の部分構造は高濃度のマグネシウムイオン存在下で凝集することが知られているが、アセチル化修飾を行った核内の染色体は高濃度のマグネシウムイオン存在下でも凝集が抑えられている。このことから、触媒を用いたアセチル化修飾によって核内の染色体の構造が緩んだことが明らかになった。
<用語解説>
- 注1) アセチル化剤
- アセチル化反応において、アセチル基を提供する反応剤(化合物)のこと。アセチルCoAは、細胞内の代謝によって生成する有機化合物の一種で、細胞内アセチル化反応において、アセチル基を提供する。アセチルCoAは低反応性のため単独ではアセチル基を高い効率でタンパク質に提供することができないが、触媒や酵素によって活性化されることでアセチル基をタンパク質に提供できるようになる。
- 注2) アセチル化
- アセチル基-C(=O)-CH3を有機化合物(この場合はタンパク質表面の置換基)に導入する反応のこと。
- 注3) 修飾
- タンパク質などの生体高分子や高分子に含まれる特定の置換基を化学反応によって変化させること。化学修飾も同義。
- 注4) 触媒
- 特定の化学反応を進行させやすくする分子。
- 注5) 染色体
- 生物の細胞の核の中に含まれている遺伝情報が記録されている構造体。ヒストンと呼ばれるタンパク質と遺伝情報を担うDNAの複合体から構成されている。
- 注6) アシル化
- 有機化合物にアシル基を導入する反応のこと。アシル基とは-C(=O)-R(Rは任意の炭化水素基)で表される置換基一般を指し、アセチル化もアシル化の一種に含まれる。
- 注7) 転写
- 染色体のDNA上の塩基配列を元に、転写産物であるRNAが合成されること。遺伝子が機能するための過程の一つ。
- 注8) リガンド
- 特定のタンパク質の特定の位置に選択的に結合する化合物。
<論文情報>
| タイトル |
“Synthetic posttranslational modifications: Chemical catalyst-drivenregioselective histone acylation of native chromatin” |
| 著者 |
Yoshifumi Amamoto, Yuki Aoi, Nozomu Nagashima, Hiroki Suto, Daisuke Yoshidome, Yasuhiro Arimura, Akihisa Osakabe, Daiki Kato, Hitoshi Kurumizaka, Shigehiro A. Kawashima*, Kenzo Yamatsugu*, and Motomu Kanai*
(*責任著者)
|
| doi |
10.1021/jacs.7b02138 |
<お問い合わせ先>
<研究に関すること>
金井 求(カナイ モトム)
東京大学 大学院薬学系研究科 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4830 Fax:03-5684-5206
E-mail:
<JSTの事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
東京大学 薬学部・薬学系研究科 庶務チーム
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4719 Fax:03-5841-4711
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: