理化学研究所(理研) 脳科学総合研究センター 発生神経生物研究チームの濱田 耕造 研究員と御子柴 克彦 チームリーダーらの共同研究チーム※1)は、記憶や学習などの脳機能に必要なカルシウムチャネル注1)であるIP3受容体(イノシトール三リン酸受容体)注2)の動作原理を、X線結晶構造解析注3)と変異体の機能解析により解明しました。
IP3受容体は小胞体の膜上に局在するタンパク質で、個体の発生や神経のシナプス可塑性注4)を担っています。IP3受容体は4つ組み合わさって中心部にカルシウムイオン(Ca2+)を1つだけ通す小さなイオン透過口を形成し、カルシウムチャネルとして働きます※2)。IP3受容体の遺伝子変異は、家族性脊髄小脳失調症注5)やGillespie(ガレスピー)症候群注6)の原因となります。またこのチャネルは、認知症の主な原因である神経変性にも関与していることが知られています。そのため、IP3受容体の動作原理の解明はこれらの病気の治療薬の開発につながると期待されています。しかし、既知のリガンド作動型イオンチャネル注7)に比べて、IP3受容体のIP3結合部位はチャネル部位から大きく離れているため、リガンドのIP3注2)が物理的にどのようにチャネルを開けるのか不明でした。
今回、共同研究チームは遺伝子工学を用いてIP3結合部位からチャネル部位につながるタンパク質ドメインを昆虫細胞で大量に発現・精製し、2,200個を超えるアミノ酸残基からなるIP3受容体細胞質ドメイン(細胞質側の領域)の巨大タンパク質結晶の作製に成功しました。続いて、この結晶の立体構造をX線結晶構造解析によって決定しました。また、IP3存在下・非存在下と欠失変異体の結晶構造を決定し、IP3が結合して生じる構造変化の経路を見いだしました。さらに、遺伝子操作でこの経路に変異を入れ機能解析を行い、IP3結合部位からチャネル部位までの経路を決定しました。その結果、その経路の中でユニークな小葉型構造(リーフレット)がチャネルを開く伝達部位となることが分かりました。以上の結果から、IP3が受容体に結合してからチャネルを開けるまでの動作原理が解明されました。
今回明らかにした機構は、今後、神経疾患や認知症の治療・予防に役立つ新しい創薬ターゲットとして期待できます。
本成果は、米国の科学雑誌「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」に掲載されるのに先立ち、オンライン版(4月17日の週)に掲載されます。
なお、本研究は科学技術振興機構(JST)戦略的創造研究推進事業 国際共同研究(ICORP)「カルシウム振動プロジェクト」(代表研究者:御子柴 克彦)および発展研究(SORST)「カルシウム振動」(研究代表者:御子柴 克彦)」の一環として行われました。
- ※1) 共同研究チーム
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦(ミコシバ カツヒコ)
研究員 濱田 耕造(ハマダ コウゾウ)
テクニカルスタッフⅠ 寺内 明子(テラウチ アキコ)
伊藤ナノ医工学研究室
専任研究員 宮武 秀行(ミヤタケ ヒデユキ)
- ※2) 2014年9月9日プレスリリース「カルシウムチャネルの新しいアロステリック阻害メカニズム」
http://www.riken.jp/pr/press/2014/20140909_1/
<研究の背景と経緯>
私たちが物を見たり考えたりできるのは、脳の中で受容体タンパク質が活発に働いているからです。この受容体タンパク質が働く仕組みを理解することは、脳活動の分子メカニズムを知り、脳の病気を治すのに役立ちます。IP3受容体(イノシトール三リン酸受容体)は、カルシウムイオン(Ca2+)による細胞内シグナル伝達を制御するカルシウムチャネルです(図1)。IP3受容体タンパク質に異常があると脳の形態やシナプス可塑性に異変が起き、IP3受容体の遺伝子に突然変異が起こると家族性脊髄小脳失調症やGillespie(ガレスピー)症候群を発症します。また、認知症の主な原因とされる神経変性にIP3受容体が関わることも知られており、IP3受容体の動作原理の解明は認知症の治療薬や予防法の開発にもつながると考えられます。
直径が約20ナノメートル(nm、1nmは10億分の1メートル)のIP3受容体は小胞体の膜上に局在し、4つが組み合わさって働きます(四量体構造)。この受容体は、リガンド(受容体に結合する物質)のIP3を特異的に認識し結合させる働きと、細胞内Ca2+貯蔵庫である小胞体からCa2+を放出する2つの働きを持つ精密な分子機械です。刺激により遊離したIP3は、1つだけぴったり適合するIP3結合部位の結合ポケットに、イオン結合を形成します。一方、チャネルの孔領域では、小胞体膜を6回貫通する膜貫通領域(TM1-6)のTM5とTM6の間のループ構造が、Ca2+を1つだけ透過させる孔を形成します。
これまで考えられていたIP3受容体の動作モデルは、チャネル部位に近いIP3結合部位から直接チャネル部位へ、構造変化が伝達されることによりチャネルが開くというものでした。しかし、さまざまな生化学実験やクライオ電子顕微鏡による構造解析注8)により、IP3結合部位はチャネル部位から7nm以上離れていることが分かっています。この距離は、既知のリガンド作動型イオンチャネルよりも長いため、IP3がどのように物理的にチャネルを開けるのかは不明でした。
<研究の内容>
共同研究チームは、IP3受容体のIP3結合部位からチャネル部位へどのように構造変化が伝達されるかを調べるために、遺伝子工学を用いてIP3結合部位からチャネル部位につながる細胞質側の領域を昆虫細胞で大量に発現・精製し、その結晶化を試みました。試行錯誤を重ねた結果、2,217個のアミノ酸残基から構成されるIP3受容体細胞質ドメイン(細胞質側の領域)の巨大タンパク質結晶を作製することに成功しました。
続いて、大型放射光施設「SPring-8」注9)を使って、この結晶のX線結晶構造解析を行いました。その結果、IP3結合部位からチャネル部位に至る立体構造を5.8~7.4オングストローム(Å、1Åは100億分の1メートル)の分解能で決定しました(図2)。図2左下は、IP3受容体細胞質ドメインの立体構造とその四量体構造を示します。既知の結果と同様に、IP3結合部位からチャネル部位までは約7nm離れていることを確認しました(図2右下)。
さらに、IP3存在下・非存在下での結晶化条件を探索し、両方の結晶構造を決定することに成功しました。図3はIP3存在下での結晶構造(灰色)と図2と同様、IP3非存在下での結晶構造(カラー)を重ねて示しています。IP3がIP3結合コア(IP3結合部位が含まれる部分)にあるポケットに結合すると、タンパク質のアミノ末端を基準にしたヘリカルドメイン1(HD1)領域、HD2領域、HD3領域の位置が変化すること(カラーから灰色へ)が明らかになりました。この構造変化の再現性を調べるためHD3領域を除去したタンパク質でも作製しX線結晶構造解析を行ったところ、同様にHD1領域およびHD2領域の位置がIP3結合により変化することが確認されました。
次に、これらの構造解析の結果に基づき、遺伝子操作でIP3結合コアからチャネル部位へ至る3つの構造変化の経路の候補であるHD2領域、HD3領域、カルボキシル末端領域にそれぞれ欠失変異を入れて機能解析を行いました。その結果、HD3領域が機能に必須であることが判明し、特にHD領域のユニークな小葉型構造(リーフレット)が構造変化の伝達を担うことが示唆されました。
さらにこれを確認して詳細な構造変化の経路を決定するため、リーフレット領域にある10~11アミノ酸残基、または5~6アミノ酸残基を全てグリシン残基に置換した6種類の変異体を作製し、小胞体からのCa2+放出活性を調べました(図4上)。その結果、リーフレットがチャネル部位に接していない5b領域のグリシン置換変異体では活性を示しましたが、リーフレットがチャネル部位に接している5a領域をグリシン残基に置換すると、活性が完全に消失しました(図4下)。また、リーフレットがHD3のヘリックスに接する5cおよび6G領域でも活性が消失することから、リーフレットがHD3から5c/6G領域および5a領域を経てチャネル領域へ構造変化を伝達することが判明しました(図5)。
以上の結果より、IP3がIP3受容体に結合して伝達経路に構造変化を起こし、チャネルを開けるという新しいゲート機構が解明されました。
<今後の展開>
IP3受容体は、小胞体ストレス注10)やオートファジー注11)そしてアポトーシス注12)などの重要な細胞内プロセスを制御し、家族性脊髄小脳失調症などの脳疾患や認知症の原因となる神経変性との関与が知られています。また、シャーガス病注13)やアフリカ睡眠病注13)の病原体であるトリパノソーマ原虫注13)でもIP3受容体が機能している報告があります。
従って、本研究で発見したリーフレット部位はこれらの疾病の新しい創薬ターゲットとして期待できます。リーフレット部位に作用する化合物やタンパク質などを解析し、IP3受容体の阻害剤や活性化剤、アロステリック因子注14)を探索することが可能となり、将来的にIP3受容体が関与するさまざまな病気の治療薬の開発に役立つものと考えられます。
<参考図>
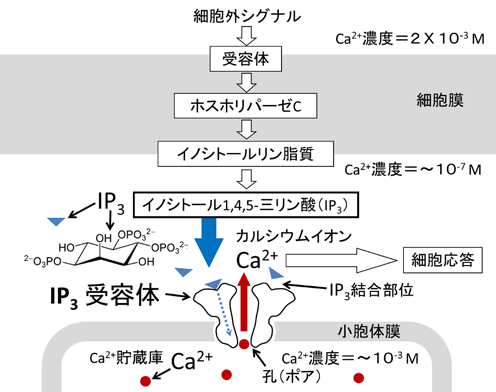
図1 細胞内IP3のCa2+シグナル伝達
神経伝達物質や成長因子などが細胞膜の受容体に結合すると、ホスホリパーゼCが活性化し細胞膜中のイノシトールリン脂質が分解されイノシトール1,4,5-三リン酸(IP3、青三角)を産生する。IP3は小胞体などのカルシウムイオン(Ca2+、赤丸)貯蔵庫の膜に埋め込まれたIP3受容体に特異的に結合し、Ca2+を放出する。Ca2+貯蔵庫内腔ではCa2+濃度が10-3M近く濃縮されており、IP3受容体が開孔すると濃度勾配に依存してCa2+が細胞質に放出され、細胞内Ca2+濃度が上昇する。その結果、Ca2+依存酵素やCa2+結合タンパク質が活性化し細胞応答を引き起こす。
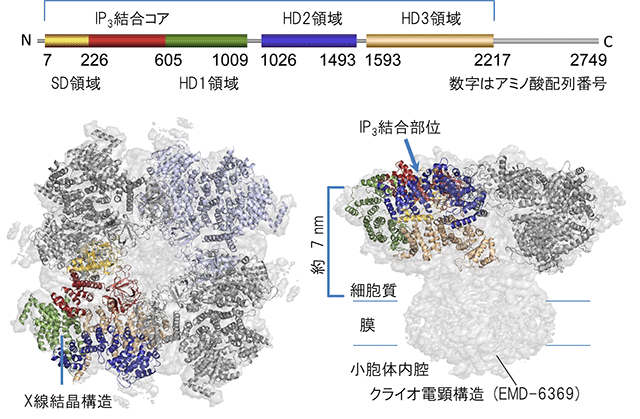
図2 X線結晶構造解析により決定されたIP3受容体の細胞質ドメイン構造
| 上段: |
スキームはIP3受容体の細胞質ドメインの1次構造で、左端はアミノ末端(N)右端はカルボキシル末端(C)を表す。サプレッサードメイン(SD領域、黄色)、IP3結合コア(赤)、ヘリカルドメイン(HD1領域、緑)、ヘリカルドメイン(HD2領域、青)、ヘリカルドメイン(HD3領域、ベージュ)のアミノ酸配列番号は、マウス1型IP3受容体に従う。 |
| 左下: |
決定したX線結晶構造をクライオ電子顕微鏡構造に結合して得られた、四量体IP3受容体の細胞質ドメイン構造。 |
| 右下: |
左下の四量体IP3受容体を横から見た図。IP3結合部位から膜のチャネル部位まで、約7nm離れていることが確認できた。 |
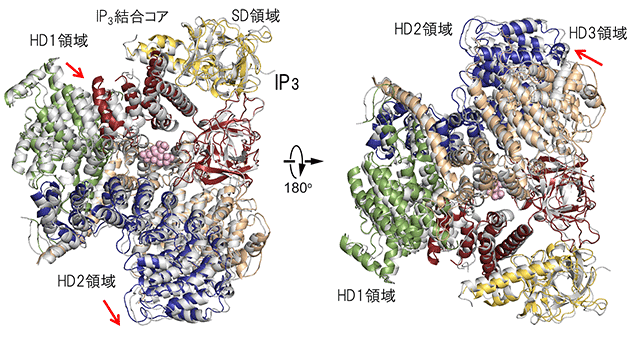
図3 IP3存在下・非存在下の結晶構造
IP3非存在下で作製した結晶から得たサブユニット構造(図2左下カラーモデル)とIP3存在下(灰色)のX線結晶構造をアミノ末端領域(アミノ酸配列番号7~430:図2上段SD領域とIP3結合コアのβドメインに相当)に重ね合わせた図。IP3はピンク、ドメインの色は図2と同じで表している。左はIP3結合コアを上から、右は下から見た図である。赤矢印は、IP3によるHD1領域、HD2領域、HD3領域の移動を示す。
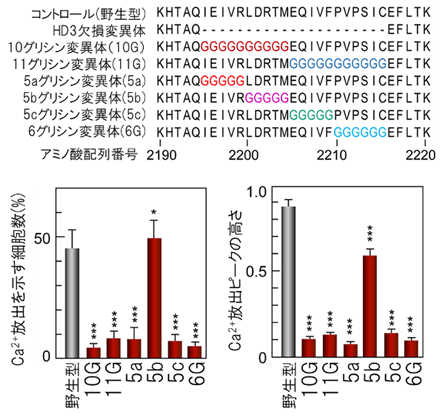
図4 IP3受容体の細胞質ドメインの変異体
| 上: |
HD3領域にある5~11アミノ酸残基をグリシン(G)に置換し、6種類の変異体を作製した。 |
| 下: |
小胞体からのCa2+放出活性を測定した結果。棒グラフ左の縦軸は刺激に応答した細胞の割合、右はCa2+濃度の変化量(ピークの高さ)の平均値を表す。チャネル部位に接していない5bグリシン変異体では活性を示したが、チャネル部位に接している小葉型構造(リーフレット構造)の5aグリシン変異体では活性が消失した。 |
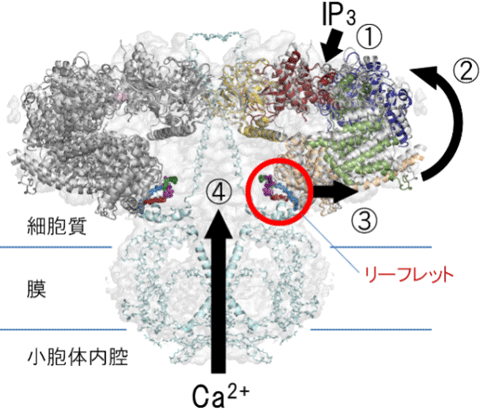
図5 IP3受容体の動作モデル
①IP3が結合すると、②構造変化を起こし、③HD3領域にある小葉型構造(リーフレット)が矢印の向きに動き、チャネルに構造変化を伝達し、④Ca2+チャネルの孔のαヘリックスが移動して孔が開き、小胞体から細胞質へCa2+が放出される。
<用語解説>
- 注1) カルシウムチャネル
- カルシウムイオン(Ca2+)は強い電荷を持つのでリン脂質二重層からなる細胞膜を透過することはできず、タンパク質によって膜に形成される孔(ポア)によって膜を透過する。Ca2+は細胞外液に10-3M含まれるが細胞内は10-7Mと低く、急激な細胞内Ca2+濃度の上昇は細胞内シグナルとして利用される。細胞内Ca2+濃度の上昇はCa2+チャネルの立体構造が変化し孔が開くことにより生じる。
- 注2) IP3(イノシトール三リン酸)、IP3受容体
- 細胞内のシグナル伝達は化学信号が利用され、IP3は細胞内Ca2+シグナリングを誘導する主要な化学信号の1つである。IP3はイノシトール骨格に3つのリン酸基が付加した物質で、神経伝達物質や成長因子などのさまざまな細胞刺激に応答し細胞内に産生される。細胞外刺激に応答するGPCR受容体などが細胞内のホスホリパーゼCを活性化し主に細胞質膜に存在するホスファチジルイノシトール2リン酸を加水分解しIP3が産生される。
- 注3) X線結晶構造解析
- 分子が同じ向きで一律に並び互いに結合し固体になると、結晶と呼ばれる状態を呈する。1つあたり10-20nmのIP3受容体細胞質ドメインの結晶は最大0.3mmに成長するため、結晶中にIP3受容体細胞質ドメインが1兆個以上並んでいる計算になる。結晶にX線を照射すると、ブラッグの法則によりその構成原子の立体構造に依存した回折像が得られ、これを解析し位相決定すると結晶格子中の分子構造が得られる。
- 注4) シナプス可塑性
-
神経細胞間の接点(シナプス)での情報伝達効率が長期的に変化する能力のこと。
- 注5) 家族性脊髄小脳失調症
- 脊髄小脳変性症は運動失調を中核症状とする神経変性疾患の総称であり、そのうち家族性脊髄小脳失調症は、主に常染色体優性遺伝形式の脊髄小脳失調症のことを意味する。現在のところ対処療法に頼るしかない。日本での推定患者数は約3万人。15/16型および29型の原因遺伝子がIP3受容体遺伝子であることが臨床研究により解明されている。
- 注6) Gillespie(ガレスピー)症候群
- 無虹彩、小脳失調、知的障害を伴う稀な疾患。日本では数例の報告があるのみ。原因遺伝子がIP3受容体遺伝子であることが臨床研究により解明されている。
- 注7) リガンド作動型イオンチャネル
- 化学信号となる物質がリガンド結合部位に特異的に結合することで、チャネル部位に構造変化が起こり開孔するタンパク質。既知のリガンド作動型イオンチャネルのうち、ニコチン性アセチルコリン受容体、NMDA受容体、AMPA受容体、GABAA受容体、セロトニン受容体(5-HT3)、ATP受容体(P2X)、リアノジン受容体は、X線結晶構造解析またはクライオ電子顕微鏡解析により立体構造が明らかになっている。これらの受容体に比べ、IP3受容体のリガンド結合部位はチャネル部位から最も離れている。
- 注8) クライオ電子顕微鏡による構造解析
- 液体窒素温度(約-173℃)でタンパク質溶液の電子顕微鏡像を得て、画像解析により数万個のタンパク質粒子の平均像を計算し構造決定する方法。電子直接検出器と画像解析による粒子移動補正が近年開発され、X線結晶構造解析に匹敵する分解能の構造決定が可能になった。タンパク質結晶を作製する必要がないという大きな利点を持つが、構造変化するタンパク質では分解能が上がらず、クライオ電子顕微鏡像はコントラストが低く画像のホワイトノイズの影響を受けやすい弱点を持つ。
- 注9) 大型放射光施設「SPring-8」
- 理研が所有する、兵庫県の播磨科学公園都市にある第三世代放射光施設。SPring-8の名前はSuper Photon ring-8GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
- 注10) 小胞体ストレス
- タンパク質の不良品が小胞体という細胞内小器官の中にたまり、細胞に負荷がかかった状態のこと。タンパク質合成の低下、タンパク質分泌の停止などさまざまな障害を引き起こす。
- 注11) オートファジー(自食作用)
- タンパク質やミトコンドリアなどの細胞内小器官を、タンパク質分解酵素が充填されたリソソームに運ぶメカニズム。オートファジーの機能が低下すると細胞内に不要な物質が蓄積し、神経変性や慢性炎症などさまざまな疾病の原因になると考えられている。
- 注12) アポトーシス
- プログラムされた細胞死を指し、生理的には個体の正常な発生に必要であり、またがん化した細胞などの除去の目的でも積極的に引き起こされる。
- 注13) シャーガス病、アフリカ睡眠病、トリパノソーマ原虫
- シャーガス病もアフリカ睡眠病も、病原体のトリパノソーマ原虫が感染して発症する寄生虫病である。シャーガス病はサシガメという昆虫が媒介し、放置していると突然死に至る場合もある。ラテンアメリカやカリブ諸国で蔓延しており、推定患者は700万~800万人。一方、アフリカ睡眠病はツェツェバエが媒介し、病状が進行すると髄膜脳炎を起こし、最終的には昏睡状態に陥って死に至ることからその名前で呼ばれる。感染リスクはサハラ以南のアフリカ36カ国で6,000万〜7,000万人と推定される。
- 注14) アロステリック因子
- 化合物によって酵素やチャネルなどの活性を調節する方法は、活性の中心となる部位に化合物が直接結合して働く競合的阻害や、活性の中心以外の部位(アロステリック部位)に化合物が結合し調節するアロステリック効果が知られている。アロステリック部位に結合し機能を調節する物質をアロステリック因子と呼び、競合阻害と異なりタンパク質の機能阻害だけでなく活性化することが可能である。
<論文情報>
| タイトル |
“IP3-mediated gating mechanism of the IP3 receptor revealed by mutagenesis and X-ray crystallography” |
| 著者名 |
Kozo Hamada, Hideyuki Miyatake, Akiko Terauchi, and Katsuhiko Mikoshiba |
| doi |
10.1073/pnas.1701420114 |
<お問い合わせ先>
<研究に関すること>
理化学研究所 脳科学総合研究センター 発生神経生物研究チーム
濱田 耕造(ハマダ コウゾウ) 研究員
御子柴 克彦(ミコシバ カツヒコ) チームリーダー
Tel:048-467-9745(御子柴) Fax:048-467-9744
E-mail:
<JST事業に関すること>
科学技術振興機構 研究プロジェクト推進部
大山 健志(オオヤマ タケシ)
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: