ポイント
- 脳梗塞のように病原体が関与しない炎症の収束メカニズムは解明されていなかった。
- 炎症を起こした脳組織で産生される炎症惹起因子を排除する遺伝子群を発見した。
- 炎症の収束を早め、脳梗塞などの病態を改善する治療法の開発につながると期待される。
JST 戦略的創造研究推進事業において、慶應義塾大学 医学部の七田 崇 講師(非常勤)、吉村 昭彦 教授、筑波大学 医学医療系の高橋 智 教授らは、脳梗塞後の炎症反応を収束させる遺伝子群を新たに発見し、これらの遺伝子群を制御することで炎症を早く収束させて、神経症状を改善できることを動物実験で明らかにしました。
脳梗塞は寝たきり状態や重篤な後遺症の主な要因ですが、有効な治療法は限られています。脳梗塞後に起こる炎症は、脳浮腫注1)や神経症状の悪化の原因となるため、炎症を早く収束させる治療法の開発が期待されていますが、炎症収束のメカニズムは明らかではありませんでした。
本研究グループは、炎症の収束に関わる遺伝子群(Msr1、Marco、Mafb)の発見に成功し、これらの遺伝子群が、壊死した脳組織で産生された炎症惹起因子注2)を効率的に排除することを発見しました。さらに白血病治療薬のタミバロテン注3)が、これらの遺伝子群の発現を増加させることを見いだしました。脳梗塞を起こしたマウスにタミバロテンを投与すると炎症の収束が早まり、神経症状が改善されました。
本研究によって、脳梗塞のような病原体が関与しない無菌性炎症注4)を収束させるメカニズムが解明されました。脳梗塞発症後の治療開始可能時間を広げる治療法の開発につながり、脳卒中医療に役立つことが期待されます。
本研究は、東京大学の児玉 龍彦 教授の協力を得て行われました。本研究成果は、2017年4月10日(英国時間)に英国科学誌「Nature Medicine」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題 |
「脳組織傷害後の慢性炎症における免疫制御機構の解明」 |
| 研究者 |
七田 崇(慶應義塾大学 医学部 微生物学・免疫学教室 専任講師) |
| 研究実施場所 |
慶應義塾大学 医学部 |
| 研究期間 |
平成23年10月~平成29年3月 |
<研究の背景と経緯>
わが国は超高齢社会を迎えて、健康寿命を延ばすことが重要課題となっていますが、脳梗塞の患者数の増加が懸念されています。脳梗塞とは、脳の血管が詰まるなど血流が乏しくなることによって、酸素や栄養が不足して脳組織が壊死に陥る病態です。寝たきり状態や手足の不自由など神経症状の後遺症に悩まされる患者が多いのが特徴です。
詰まった血管の再開通(血栓溶解または血栓除去)が現在の主流の治療法ですが、発症後数時間以内でなければ効果がなく、治療を受けられる患者は限られていました。脳梗塞後の脳組織では炎症反応が起きて脳梗塞巣が拡大し、神経症状を悪化させます。最近では脳梗塞後の炎症に着目した新しい治療法の開発に期待が高まっていますが(参考文献1)、炎症が収束するメカニズムはこれまで全く分かっていません。
炎症は病原微生物などに対する生体の自然な防御反応です。本研究グループは、壊死した脳組織で産生される炎症惹起因子(DAMPs:Damage-associated molecular patterns)が、マクロファージや好中球注5)など免疫細胞を活性化し、炎症性サイトカイン注6)を産生させることにより、炎症が引き起こされることを明らかにしてきました(参考文献2)。炎症は、壊死した脳組織周囲の正常な組織をも傷害し、さらなるDAMPsの放出につながるため、炎症を収束できないと、症状がさらに悪化するという悪循環に陥る可能性があります。
病原体が体内に侵入する感染症では、病原体が免疫細胞によって殺菌、排除されると炎症は収まります。しかし脳は無菌の臓器であり、細菌やウイルスなどの外敵は通常存在しません。本研究グループは、DAMPsを排除すれば炎症を収められるのではないかと仮説を立てました。DAMPsを排除するメカニズムを解明すれば、脳梗塞後の炎症の収束を早める新しい治療法を開発できる可能性が生まれます。
<研究の内容>
本研究グループは脳梗塞モデル注7)マウスを用いて、炎症を引き起こすDAMPsが、脳組織に存在する免疫細胞(主にマクロファージ)によって細胞内に取り込まれて排除されることを発見しました(図1)。同様にDAMPsを細胞内に取り込むマクロファージ細胞株(RAW264.7)を突然変異誘発剤(エチルニトロソウレア:ENU)注8)で処理して、DAMPsを排除できない変異細胞株を樹立しました。正常な細胞株と変異細胞株の遺伝子発現パターンを比較したところ、数十種類の遺伝子発現が欠落していることが判明し、この中からMsr1、Marco、Mafbという遺伝子がDAMPsの排除に重要であることを突き止めました(図2)。
MSR1とMARCOは病原体や変性したたんぱく質を取り込むスカベンジャー受容体注9)として知られており、脳梗塞後はマクロファージが強く発現していました。MSR1とMARCOの両方を欠損するマウスではDAMPsの排除が遅れ、炎症が長引くことによって脳梗塞巣が拡大し、神経症状が悪化しました(図3)。
マクロファージは脳に侵入する前からMSR1を発現していますが、脳梗塞を起こして数日後の脳ではMSR1を強く発現するマクロファージが出現し、これらの細胞がDAMPsを効率的に取り込んで排除することが分かりました。MSR1を強く発現するマクロファージは炎症性サイトカインを産生せずに神経栄養因子注10)を産生して、脳組織を修復していることも分かりました(図4)。
Mafbという転写因子注11)は脳梗塞巣でマクロファージにMSR1を強く誘導するために重要な役割を持つことを発見しました。今回の発見を脳梗塞の新しい治療法の開発に応用するため、マクロファージに作用してMSR1の発現を増強できる薬剤を探したところ、白血病の治療薬として日本で使われているタミバロテン(AM80)がMafbを介してMSR1の発現を増強することを見いだしました。現状では脳梗塞の治療はできるだけ早期の開始が原則ですが、動物実験でタミバロテンは脳梗塞の発症24時間後に投与した場合でも、脳の保護効果や神経症状を改善する効果が認められ、将来は脳梗塞治療にも役立つことが期待されます(図5)。
<今後の展開>
本研究によって、病原体が関与せずに発生する脳梗塞後の炎症が収束するメカニズムが解明されました(図6)。さまざまな炎症性の病態では、炎症を抑制すると修復効果をも抑制する可能性が懸念されており、本研究のように炎症の収束を早める治療法の開発に期待が高まっています。また、脳梗塞など脳卒中の発症後の治療開始可能時間を広げる治療法に応用されることが期待されます。
<参考図>
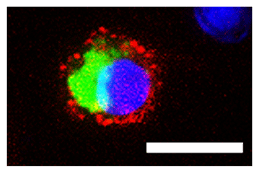
図1 蛍光標識したDAMPsがマクロファージ細胞内に取り込まれた様子
緑色は蛍光標識したDAMPs(ペルオキシレドキシンたんぱく質)。マクロファージの細胞膜を赤色で染色している。青色は細胞の核を示す。蛍光標識したDAMPsがマクロファージの細胞内に取り込まれている(細胞質に存在している)。取り込まれたDAMPsはリソソームに運ばれて分解され、排除される。白い線は10μm(マイクロメートル)の長さを表す。
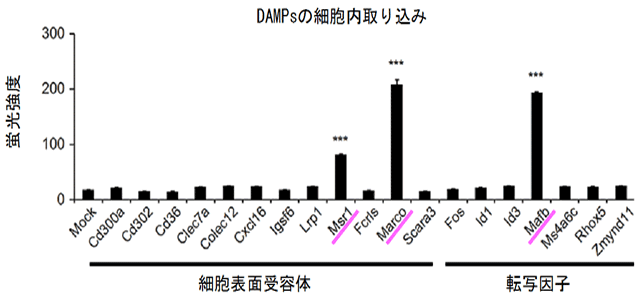
図2 蛍光標識したDAMPsを細胞内に取り込むために重要な遺伝子群の発見
DAMPsを排除できない変異細胞株で欠損していた遺伝子群を示している(細胞表面受容体が12種類、転写因子が7種類)。それぞれの遺伝子を1つずつ変異細胞株に過剰発現させた上で、蛍光標識したDAMPsの細胞内取り込みを蛍光強度で評価した。Msr1、Marco、MafbがDAMPsの排除に重要であることが判明した。
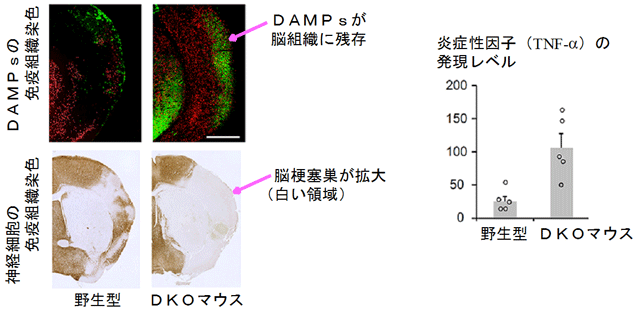
図3 MSR1、MARCOを両方欠損した(DKO)マウスを用いた脳梗塞の病態解析
野生型マウスとDKOマウスで脳梗塞モデルを作製して、発症4日目の脳組織を解析して病態を比較した。緑色は蛍光標識したDAMPs。マクロファージの細胞膜を赤色で染色している。DKOマウスではDAMPsの排除が遅れて、脳組織に顕著に残存しており(左図右上)、脳梗塞巣も拡大している(左図右下)。脳組織内における炎症性因子の発現レベルも高く、脳梗塞後の炎症が悪化していることが分かる(右図)。
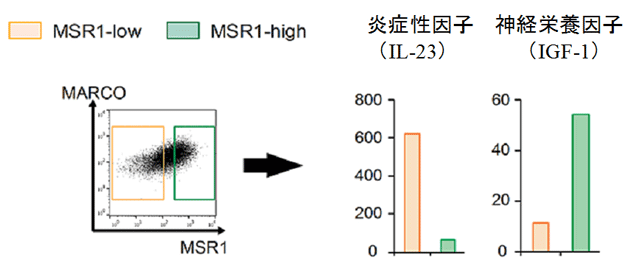
図4 MSR1を高発現する細胞での炎症性因子および神経栄養因子の発現を比較
脳梗塞発症後3日目の組織から、脳内に浸潤したマクロファージを単離した。左図に示すようにMSR1の発現レベルが低い細胞と高い細胞が存在する。それぞれの細胞における炎症性因子と神経栄養因子の産生レベル(mRNA発現レベル)を比較した。炎症性因子はMSR1の発現レベルが低い細胞から、神経栄養因子はMSR1の発現レベルが高い細胞から産生されている。この結果からMSR1を高発現するマクロファージは修復細胞であることが示唆される。

図5 タミバロテン(AM80)の投与による脳梗塞病態の改善
タミバロテン(AM80)を脳梗塞の発症24時間後に投与した脳梗塞モデルマウスの発症後28日目の脳梗塞体積を示す。左図は神経細胞の免疫組織染色(白い部分が脳梗塞巣)。タミバロテンの投与によって脳梗塞巣が縮小しており、脳の保護効果や神経症状を改善する効果が認められた。
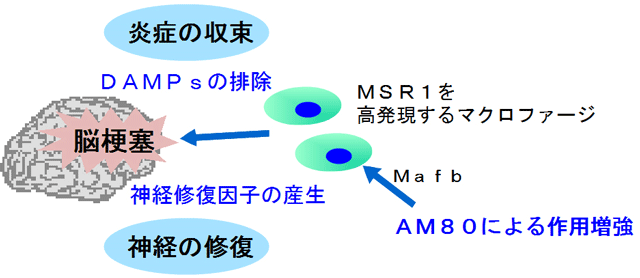
図6 本研究の概要
脳梗塞において、MSR1を高発現するマクロファージはDAMPsを効率よく排除し、神経栄養因子を産生する修復細胞として機能する。AM80を投与するとMafbを介して、マクロファージのMSR1の発現を増強して脳梗塞後の炎症の収束を加速させる。
<用語解説>
- 注1) 脳浮腫
- 虚血による脳細胞の傷害が起こり、脳細胞内に水が流入して浮腫を起こす。脳組織でも、虚血によって脳血管が傷害されて血液成分が脳組織に流入して、水分量も増えることにより脳組織が浮腫を起こす。脳浮腫によって周囲の正常な脳組織が圧迫を受け、さらなる虚血や神経傷害を引き起こす。
- 注2) 炎症惹起因子DAMPs
- Damage-associated molecular patternsの略語。組織傷害に伴って細胞から放出され、周囲の組織や細胞に危険を知らせるアラームのような役割を担う因子のこと。脳梗塞ではHMGB1やPeroxiredoxin、S100A8/A9などがDAMPsとして機能することが知られている。
- 注3) タミバロテン(AM80)
- ビタミンA誘導体の1種で、日本では急性前骨髄性白血病の治療薬として用いられている。タミバロテンは核内受容体の1つであるRAR(Retinoic Acid Receptor)を活性化して、細胞内のMafbの発現を上昇させる効果がある。
- 注4) 無菌性炎症
- 炎症は、細菌やウイルスなどの病原体が体内に侵入したことに、免疫細胞が察知して反応することによって引き起こされる。一方で、けがなどの場合のように身体の組織が損傷しても炎症が起こり、腫れて痛みを生じる。この場合は病原体を免疫細胞が察知したわけではなく、組織の損傷によって免疫細胞が活性化されたと考えられる。このように病原体が関与しない炎症を無菌性炎症と呼ぶ。
- 注5) マクロファージ、好中球
- 血液や骨髄などに存在する免疫細胞で、細菌やウイルスなどの微生物の侵入や臓器の異常の際にいち早く活性化して免疫応答を起こす役割を持つ。微生物由来の物質や、死細胞由来の物質を認識すると活性化して、IL-1βなどのさまざまな炎症性因子を生み出す。これらは、免疫細胞が臓器に侵入するのを促進したり、血管を拡張させて浮腫を起こしたりするなど、他の免疫細胞や臓器の細胞が起こす炎症を促進する効果がある。
- 注6) 炎症性サイトカイン
- 免疫細胞などから分泌されるたんぱく質で、特定の細胞に炎症反応を誘導したり、分化や細胞死などの情報を伝達する役割を持つ。
- 注7) 脳梗塞モデル
- マウスを用いて脳梗塞モデルを作製することができる。本研究では、細い塞栓糸を頚動脈から挿入して脳血管(中大脳動脈)に到達させ、一時的に閉塞させて脳虚血を誘導した。挿入した塞栓糸を引き抜くことにより、脳血管の閉塞を解除(再灌流)させることができる。
- 注8) 突然変異誘発剤(エチルニトロソウレア:ENU)
- 細胞内のDNAに作用して、高効率にランダム変異を導入する薬剤。DNAの情報がランダムに書き換えられることによって、たんぱく質などの分子の発現がランダムに変化する。本研究ではENUの作用によって、DAMPsを取り込むために重要なたんぱく質を欠損した細胞を人工的に作り出した。
- 注9) スカベンジャー受容体(MSR1、MARCO)
- 主にマクロファージが発現する受容体たんぱく質で、体内の異物を認識して細胞内に取り込む作用を持つ受容体。さまざまな種類のスカベンジャー受容体が知られているが、その中でもMSR1、MARCOはクラスAに分類され、構造が似ていることが知られている。本文中で、Msr1、Marcoと記載しているのは、それらの遺伝子であること示す。
- 注10) 神経栄養因子
- 神経細胞の生存や増殖のために重要な因子。本研究では、マクロファージから産生される神経栄養因子であるIGF-1(インスリン様成長因子1)を評価している。脳梗塞においてIGF-1はシナプスの形成を促進するなど、神経機能を改善させる因子であると考えられている。
- 注11) 転写因子Mafb
- マクロファージの分化に必須の転写因子(標的となる遺伝子の発現を変化させるたんぱく質)として知られており、動脈硬化病変の形成に関与する(参考文献3)。炎症における Mafbの役割はまだ十分に明らかになっていなかった。
<論文情報>
| タイトル |
“MAFB prevents excess inflammation after ischemic stroke by accelerating clearance of damage signals through MSR1”
(MAFBはMSR1の発現を介してDAMPsの排除を促進し、炎症の悪化を阻止する)
|
| doi |
10.1038/nm.4312 |
<参考文献>
- 参考文献1:
- Iadecola C, Anrather J. The immunology of stroke: from mechanisms to translation. Nat Med. 17, 796-808 (2011)
- 参考文献2:
- Shichita, T et al. Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain. Nat Med 18, 911–917 (2012)
- 参考文献3:
- Hamada, M., et al. Mafb promotes atherosclerosis by inhibiting foam-cell apoptosis. Nat Commun 5, 3147 (2014)
<お問い合わせ先>
<研究に関すること>
七田 崇(シチタ タカシ)
東京都医学総合研究所 脳卒中ルネサンスプロジェクト プロジェクトリーダー
〒156-8506 東京都世田谷区上北沢2-1-6
Tel:03-5316-3125(内線2640) Fax:03-5316-3125(内線2650)
E-mail:
吉村 昭彦(ヨシムラ アキヒコ)
慶應義塾大学 医学部 微生物学・免疫学教室 教授
〒160-8582 東京都新宿区信濃町35 東校舎4F
Tel:03-5363-3483 Fax:03-5360-1508
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ) 科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
慶應義塾大学 信濃町キャンパス総務課
〒160-8582 東京都新宿区信濃町35
Tel:03-5363-3611 Fax:03-5363-3612
E-mail:
筑波大学 広報室
〒305-8577 茨城県つくば市天王台1-1-1
Tel:029-853-2039 Fax: 029-853-2014
E-mail: