ポイント
- 哺乳類が空腹のときに活性化される、脳の新規の神経細胞を発見しました。
- この神経細胞は延髄の網様体にあり、視床下部で感知した空腹の信号を受け取ると、エネルギー消費(熱産生)を抑制するとともに、摂食や咀嚼を促進することがわかりました。
- 空腹時に体内にエネルギーを蓄えて飢餓を生き延びる本能のために備わった脳の神経回路で、中心的な役割を担う神経細胞とその回路メカニズムが明らかになりました。
名古屋大学 大学院医学系研究科(研究科長・髙橋 雅英)統合生理学の中村 佳子 助教と中村 和弘 教授の研究グループは、群馬大学、オレゴン健康科学大学との共同研究により、飢餓を生き延びるために機能する脳の神経回路で鍵となる仕組みを解明しました。
人を含めた哺乳類では、空腹や飢餓になると、体内のエネルギー消費(熱産生)を減らす反応が生じるとともに、食物を摂取する行動が促進されます。これらの「飢餓反応」は、空腹を脳の視床下部で感知して生じる飢餓信号が引き金となります。しかし、視床下部の飢餓信号から飢餓反応を引き起こす脳の神経回路メカニズムは長年の謎でした。
研究グループは、ラットとマウスを使った実験によって、視床下部から飢餓信号を受けて活性化され、体内の熱産生(代謝)を抑制する神経細胞群を、延髄の網様体注1)と呼ばれる場所に見つけました。この神経細胞が働かなくなると、飢餓信号が作用しても熱産生を抑制できなくなりました。また、この網様体の神経細胞群は、摂食や咀嚼を促進する機能を持つこともわかりました。
このように、今回発見した網様体の神経細胞群は、視床下部からの飢餓信号に応じて、エネルギーの「節約」と「摂取」の両方の飢餓反応を同時に駆動することから、飢餓を生き延びる仕組みで重要な役割を担うことが本研究で明らかとなりました。
本研究成果は、過度のダイエットや拒食で生じる低体温症注2)や、飢餓反応の異常亢進による肥満症などの発症メカニズムの解明と治療法の開発に有用であると期待されます。
本研究成果は、国際科学誌「Cell Metabolism」(米国東部時間2017年1月5日付けの電子版)に掲載されます。
本研究は、科研費(新学術領域「温度生物学」、「包括脳ネットワーク」、「適応回路シフト」、若手研究(A、B)、基盤研究(B)、国際活動支援班)、科学技術振興機構(JST) 戦略的創造研究推進事業 個人型研究(さきがけ)、内閣府 最先端・次世代研究開発支援プログラム、米国国立衛生研究所グラント、武田科学振興財団、中島記念国際交流財団、上原記念生命科学財団、ブレインサイエンス振興財団、興和生命科学振興財団の支援を受けて実施されました。
<研究の背景>
人を含めた哺乳類では、空腹や飢餓になると、熱の産生に代表されるエネルギー消費を減らす反応が生じるとともに、食物を摂取するための行動が促進されます。これらの「飢餓反応」は、空腹であることを脳の視床下部が感知し、その際に放出されるニューロペプチドYと呼ばれる神経ペプチド注3)が視床下部の一部に作用することが引き金となって生じます。しかし、視床下部の飢餓信号から、エネルギー消費の抑制と摂食促進という飢餓反応の発現に至る神経回路メカニズムはわかっていませんでした。特に、「熱の産生(体温調節)」と「摂食」は、それぞれ交感神経系と運動神経系注4)という独立した神経系によって調節されることから、それらを脳がどのように統合的に調節して飢餓反応を引き起こすのかは長年の謎でした。
<研究の成果>
中村教授の研究グループは、ラットとマウスを使って、交感神経系を通じた褐色脂肪組織注5)での熱産生を調節する脳内の神経細胞群を探索する中から、新規の神経細胞群を延髄の網様体と呼ばれる場所に見つけました。この神経細胞群は、視床下部のニューロペプチドYによる飢餓信号を受けると活性化され、GABA注6)という神経伝達物質を用いて神経伝達を行う特徴(GABA作動性)を持っていました(図1)。DREADD技術注7)を用いて、この網様体のGABA作動性神経細胞群だけを活性化すると、交感神経系が抑制され、それによって褐色脂肪組織での熱産生が強く抑制されました。また、この網様体の神経細胞群が働かなくなると、視床下部にニューロペプチドYが作用しても熱産生は抑制されなくなりました。これらの実験結果は、網様体のGABA作動性神経細胞群が視床下部からの飢餓信号によって活性化され、交感神経系を抑制することによって熱産生(エネルギー消費)を抑制する働きがあることを示しています。
興味深いことに、研究グループは、この網様体のGABA作動性神経細胞群が、熱産生を調節する交感神経系だけでなく、咀嚼を駆動する運動神経系にも信号を送ることを見いだしました。この網様体の神経細胞群を刺激すると、褐色脂肪組織での熱産生を抑制(エネルギー節約)するとともに、咀嚼運動が引き起こされ、摂食量が増加(エネルギー摂取)しました(図2)。一部のラットでは、唾液分泌も促進されました。これらは、飢餓時に生体で生じる典型的な飢餓反応です。
こうした実験結果から、今回発見した網様体のGABA作動性神経細胞群は、視床下部からの飢餓信号によって活性化され、その信号を交感神経系と運動神経系へ伝えることで、エネルギーの「節約」と「摂取」の両方の飢餓反応を同時に駆動するという重要な役割を担うことが明らかとなりました(図3)。
本研究で明らかとなった仕組みは、空腹時に体内にエネルギーを蓄積し、飢餓を生き延びるための本能機能を司る脳の神経回路の根本的な仕組みです。
<今後の展開>
本研究により、飢餓反応を生み出す神経回路の基本的な仕組みが明らかになりました。この神経回路は、熱産生の抑制を通じて体温を低下させることから、現代社会で増加している、過度のダイエットや拒食(栄養不足)によって生じる低体温症の発症に関わっているものと考えられます。また、この飢餓反応の神経回路が、何らかの原因によって平常時でも活性化されると、肥満症につながると考えられ、新たな発症メカニズムの発見につながる可能性があります。今後、本研究成果をさらに発展させ、体温や代謝を調節する脳の本質的な仕組みの全貌解明を進めるとともに、低体温症や肥満症などの関連疾患の発症メカニズムの解明と治療法の開発に貢献します。
<参考図>
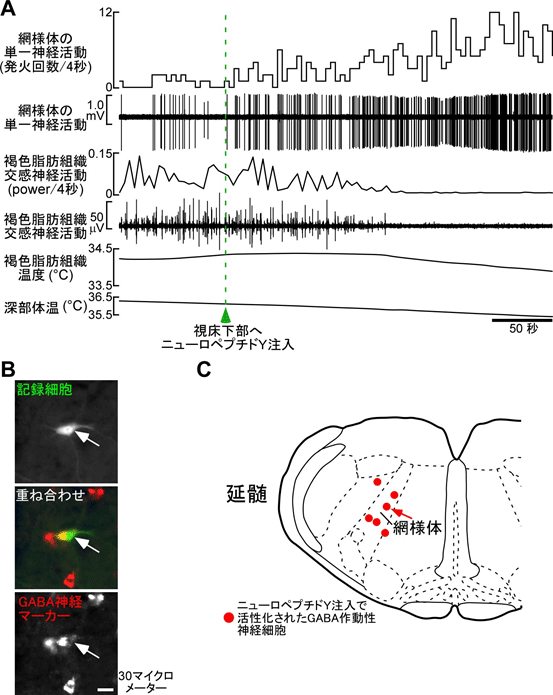
図1
ニューロペプチドY注入によって神経活動が活性化(発火回数が増加)した延髄網様体の神経細胞(A、麻酔ラットの単一細胞からの活動記録)。発火は神経細胞の電気的活動であり、発火回数が増加することは、神経細胞から伝達される電気信号が増加することを表す。延髄網様体の神経活動の活性化と並行して、褐色脂肪熱産生が徐々に消失した(A)。褐色脂肪組織交感神経活動のpowerは、交感神経活動の波形を解析して、その活動の大きさを定量化したものである。活動記録した単一神経細胞を標識(緑)後、GABA作動性神経細胞のマーカー(赤)で染色した(B、矢印)。このような、ニューロペプチドY注入で活性化されたGABA作動性神経細胞は網様体に分布していた(C、矢印はBで示した細胞)。
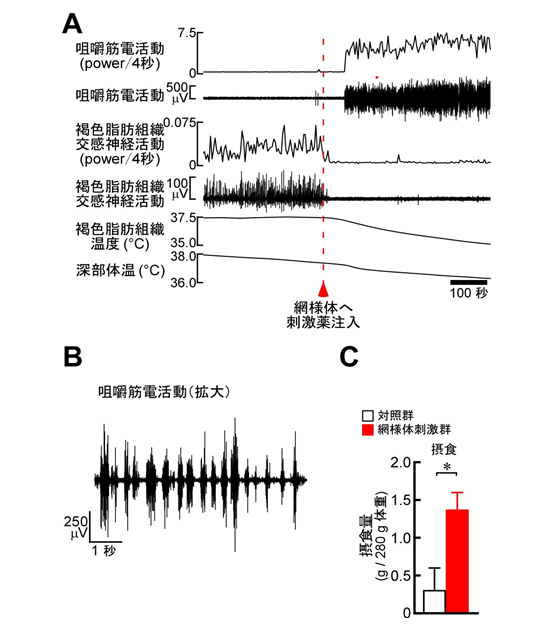
図2
網様体神経細胞を薬物刺激すると、褐色脂肪組織での熱産生が消失するとともに、咀嚼運動が引き起こされた(A)。咀嚼の筋電活動を拡大すると、周期的な咀嚼運動が記録された(B)。網様体神経細胞を薬物刺激すると、摂食量も増加した(C)。
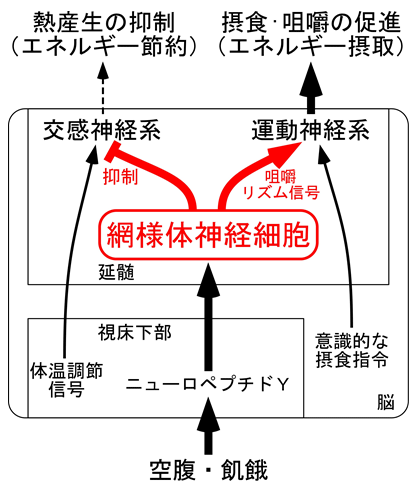
図3
飢餓を生き延びるために脳に備わった神経回路の模式図。通常、熱産生(体温調節)と摂食はそれぞれ交感神経系と運動神経系を介して独立に制御されるが、空腹・飢餓時には、視床下部のニューロペプチドYの作用により、飢餓信号が延髄の網様体へ伝達される。これによって活性化される網様体神経細胞が、交感神経系を抑制することで熱産生を抑制(エネルギー節約)するとともに、運動神経系へ咀嚼リズム信号を送ることにより咀嚼と摂食を促進(エネルギー摂取)させる。
<用語解説>
- 注1) 延髄の網様体
- 延髄は脳の中で脊髄に最も近い部位にあり、呼吸や血圧調節など、生命維持に必要な多くの生体調節の機能を担う。延髄の中でも網様体と呼ばれる領域は、神経細胞と神経線維が絡まった網目状の構造を持つことから、そのような名称で呼ばれる。網様体は様々な生体機能の制御に関わることが知られているが、代謝や熱産生の調節機能を持つことは、本研究で初めて明らかとなった。
- 注2) 低体温症
- 体の深部の体温が平熱よりも(35℃以下に)低下する症状。低体温症を引き起こす要因は様々なものが知られているが、過度の拒食やダイエットによる飢餓状態(栄養不足)もその一因となる。
- 注3) 神経ペプチド
- 神経線維(軸索)の末端から放出されるペプチド(アミノ酸が鎖状につながった物質)の総称で、神経伝達物質として働く。神経ペプチドの中でも、ニューロペプチドYは、空腹や飢餓の時に視床下部の室傍核などの脳領域で放出され、その脳領域内の神経細胞に作用することが飢餓信号の神経伝達の引き金となる。
- 注4) 交感神経系と運動神経系
- 交感神経系は自律神経系を構成する主要な神経系の一つであり、脳からの指令を受けた交感神経系の働きによって、熱産生の活性化、血圧の上昇、脈拍の増加など、生命維持に関わる多様な生理反応が生じる。交感神経の反応は、すべて意識や意志とは関係なく自動的(自律的)に起こる。一方、運動神経系は、歩く、話す、食べるなど、意志に基づいた骨格筋の運動を行うための指令を伝達する神経系である。このような違いからもわかるように、交感神経系(自律神経系)と運動神経系は、脳内の異なる神経回路メカニズムによって制御されると一般的に考えられている。
- 注5) 褐色脂肪組織
-
褐色脂肪組織は熱を産生する能力を持つ特殊な脂肪組織である。褐色脂肪組織内の脂肪細胞はミトコンドリアと呼ばれる細胞内器官を豊富に持つため、組織が褐色になることからこのような名称で呼ばれる。交感神経系を通じた指令を受けて、ミトコンドリアで熱を産生し、寒冷環境で体温の低下を防いだり、感染時に発熱を引き起こしたりする。
- 注6) GABA
-
γ-アミノ酪酸(ガンマアミノ酪酸、gamma-aminobutyric acid)という神経伝達物質の略称。GABA作動性神経細胞は神経線維(軸索)の末端からGABAを放出し、そのGABAを受け取った次の神経細胞は、その活動が抑制される。
- 注7) DREADD技術
-
DREADDとはDesigner Receptors Exclusively Activated by Designer Drugの略で、アセチルコリン受容体を遺伝子改変した人工受容体(デザイナー受容体)である。この人工受容体だけを活性化できる薬物、clozapine-N-oxide(CNO)を投与することで、この人工受容体を発現させた細胞だけを活性化あるいは抑制することができる。本研究では、遺伝子導入技術を用いて、hM3Dqという人工受容体を網様体のGABA作動性神経細胞群のみに発現させ、CNOを投与することで、この神経細胞群だけを刺激した。
<論文情報>
| タイトル |
“Medullary reticular neurons mediate neuropeptide Y-induced metabolic inhibition and mastication” |
| 著者名 |
Yoshiko Nakamura, Yuchio Yanagawa, Shaun F. Morrison, Kazuhiro Nakamura. |
| doi |
10.1016/j.cmet.2016.12.002 |
<お問い合わせ先>
<研究に関すること>
中村 和弘(ナカムラ カズヒロ)
名古屋大学 大学院医学系研究科 統合生理学・教授
Tel:052-744-2052 Fax:052-744-2056
E-mail:
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
名古屋大学 医学部・医学系研究科 総務課総務係
Tel:052-744-2228 Fax:052-744-2785
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: