ポイント
- 金属錯体を用いて、狙った神経伝達物質受容体を選択的に活性化することに成功。
- 開発した手法はタイプの異なるグルタミン酸受容体にも適用可能。
- 記憶や学習などの脳機能解明や神経疾患を対象とする創薬研究につながると期待。
京都大学 大学院工学研究科の浜地 格 教授らは、狙った膜タンパク質受容体を選択的に活性化できる新しい手法の開発に成功しました。本研究は科学技術振興機構(JST)の戦略的創造研究推進事業 チーム型研究(CREST)の一環として行われました。
細胞表面に存在する膜タンパク質受容体は、細胞外の特定の物質を選び結合、構造が変化し細胞内に情報を伝え生理活動に影響を及ぼします。そのため、創薬の効果的な標的とされている重要なタンパク質群であり、詳細な機能の解明が求められています。しかし、細胞表面には構造が似ている多くの受容体が存在しているため、標的のみを選択的に活性化し機能を解明することはいまだ困難といえます。
研究グループは膜タンパク質受容体が活性化の際に示す「構造変化」に着目しました。狙った膜受容体に、「構造変化」を起こす金属錯体注1)の人工的なスイッチをつけることで、標的のみを活性化する手法を開発しました。本研究で標的としたグルタミン酸受容体注2)は、活性化するとパックマンが口を閉じるかのように構造が変化します。本研究グループでは、金属錯体によって口を強制的に閉じるスイッチを導入することで、グルタミン酸受容体を人工的に活性化することに成功しました。このスイッチを、解析したいグルタミン酸受容体に付けることで、狙った膜受容体に絞った活性化や機能解析が可能となります。
さらに、本手法ではイオンチャネル型注3)・Gタンパク質共役受容体型注4)という異なる種類のグルタミン酸受容体でも選択的な活性化が可能であることを示しました。これらグルタミン酸受容体は、脳において記憶や学習に関与していると考えられており、今後本手法を用いて記憶や学習などの脳機能の解明や神経疾患に対する創薬研究につながると期待されます。
本研究成果は、横浜市立大学 大学院生命医科学研究科の高橋 栄夫 教授らの研究グループ、および福岡大学、慶応大学との共同研究の成果であり、2016年6月27日(英国時間)に英国科学雑誌「Nature Chemistry」のオンライン速報版で公開されます。
<背景>
細胞膜表面に存在する膜タンパク質受容体は、神経伝達物質やホルモン等の化学物質を受け取り、細胞内へ情報を伝達する重要な機能を示すタンパク質群です。現在市販されている約半数の薬剤がこれら膜タンパク質受容体を標的としているように、創薬ターゲットとして有望なため、その生理機能の解明は極めて重要です。機能を詳細に調べるためには、解析したい膜タンパク質受容体のみを選択的に活性化する必要があります。しかしながら、細胞表面には構造が似ている膜タンパク質受容体が多種類存在していることから、選択的活性化は現在でも困難です。そこで、狙った膜タンパク質受容体のみを活性化できる新たな手法の開発が求められていました。
<研究手法・成果>
本研究では、グルタミン酸受容体を対象に実験を行いました。グルタミン酸受容体は、大きくイオンチャネル型とGタンパク質共役受容体(GPCR)型の2種類に分けられます。これらグルタミン酸受容体は、リガンド注5)(活性化剤)であるグルタミン酸が結合すると、リガンド結合部位と呼ばれる一部分が、まるでパックマンが口を閉じるかのような構造変化を示します(図1a)。そこで本研究では、この「口を閉じる構造変化」を強制的に起こすことで、グルタミン酸受容体を人工的に活性化できると考えました(図1b)。具体的には、金属錯体に結合する性質を持つアミノ酸であるヒスチジンをグルタミン酸受容体に導入し、ヒスチジンと金属錯体との結合により「口が閉じた」構造へ導くことで、グルタミン酸受容体を活性化できることを発見しました。
(1)イオンチャネル型グルタミン酸受容体の活性化
本研究グループでは、まず初めにイオンチャネル型グルタミン酸受容体(iGluR)の活性化に着手しました。このiGluRは、細胞外から細胞内へCa2+などを透過させるタンパク質で、既に活性化における構造変化が詳細に報告されています。そこで不活性化状態と活性化状態の構造を比較することで、活性化時に近づく「くちびる」部分を発見し、ヒスチジンを導入しました。続いて、構築した変異型iGluRの活性を細胞内のCa2+濃度上昇により評価しました(図2)。その結果、ヒスチジンを導入した変異型iGluRはパラジウム錯体が存在すると強い活性を示すことがわかりました。活性化の詳細を検討したところ、パラジウム錯体が存在することでグルタミン酸が結合しやすくなることが明らかとなりました。すなわち変異型iGluRの活性化において、パラジウム錯体は導入したヒスチジンと結合を形成することでリガンドの親和性を変化させるアロステリック作用注6)を示すことがわかりました。
(2)GPCR型グルタミン酸受容体の活性化
本研究で開発した活性化法を異なる受容体に適用できるかを確認するため、GPCR型グルタミン酸受容体(mGluR)の活性化を検討しました(図3)。iGluRと同様に、ヒスチジンを導入し評価した結果、iGluRと同じくパラジウム錯体存在下において、強い活性を示すことがわかりました。また活性化の様子を注意深く観察したところ、変異型mGluRはパラジウム錯体のみで活性化されることがわかりました。すなわち変異型mGluRでは、その活性化においてリガンドであるグルタミン酸が不必要であり、パラジウム錯体が変異型mGluRのリガンド(活性化剤)として機能することが明らかとなりました。
(3)培養神経細胞における変異型iGluRの選択的活性化
最後にグルタミン酸受容体を元々発現している神経細胞においても、本手法が適用できることを発見しました(図4a)。ヒスチジンを導入した変異型iGluRを培養神経細胞に発現させ、低濃度のグルタミン酸とパラジウム錯体を作用させたところ、変異型グルタミン酸受容体のみが活性化しました。さらに、選択的に活性化した変異型iGluRを発現している細胞については、細胞内に情報が伝達されCREBと呼ばれる転写因子注7)がリン酸化されていることもわかりました(図4b)。以上の結果から、本手法は神経細胞においても、ヒスチジンを導入した変異型iGluRのみを選択的に活性化できることが明らかとなりました。
<今後の予定>
今回、活性化に成功したグルタミン酸受容体は、記憶や学習などの脳機能に関与していることが知られています。しかしながら、グルタミン酸受容体には、iGluR・mGluRの中でも複数の種類が存在し、各々の詳細な機能はいまだ不明な点が多いです。本手法を応用することで、記憶や学習のメカニズムを詳細に解明できるだけでなく、神経疾患(アルツハイマー病・パーキンソン病・筋萎縮性側索硬化症など)に対する創薬研究につながることが期待されます。
<研究支援者やプロジェクトなど>
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「新機能創出を目指した分子技術の構築」(研究総括:山本 尚 中部大学 教授)
研究課題名:「生細胞有機化学を基軸としたタンパク質その場解析のための分子技術」
<参考図>
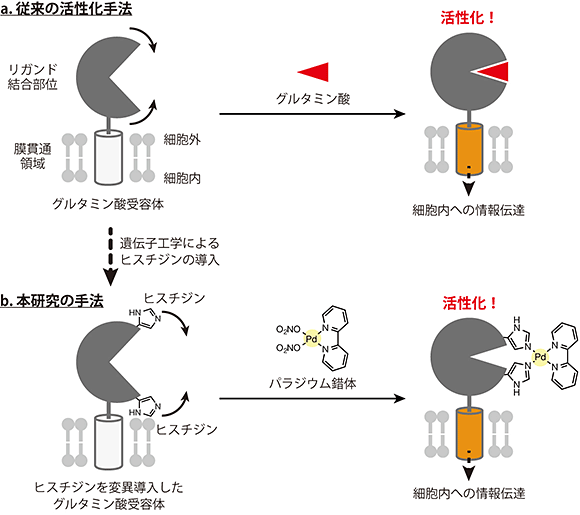
図1 これまでの活性化機構と本研究で提案した活性化手法の模式図
- a:グルタミン酸受容体の活性化モデル。グルタミン酸がリガンド結合部位に結合することで、受容体が閉じる動きが導かれる。その動きが細胞膜を貫通している領域に伝わることで、グルタミン酸受容体が活性化し細胞内に情報が伝達される。
- b:本研究の手法。リガンド結合部位の「くちびる」に遺伝子工学によりヒスチジンを導入した変異型グルタミン酸受容体を作成した。変異導入したヒスチジンと自然には存在しない金属錯体が結合し、閉じたリガンド結合部位の構造変化を引き起こすことで、グルタミン酸受容体を人工的に活性化できる。
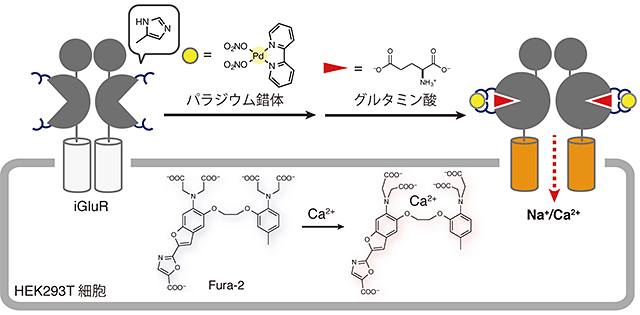
図2 イオンチャネル型グルタミン酸受容体(iGluR)の活性化
ヒスチジン(図中略記)を導入した変異型iGluRの活性化により引き起こされる細胞内のCa2+濃度上昇をFura-2という蛍光性分子で評価した。
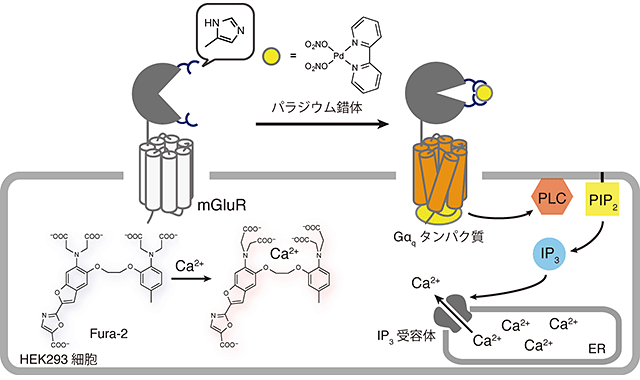
図3 GPCR型グルタミン酸受容体(mGluR)の活性化
ヒスチジン(図中略記)を導入した変異型mGluRの活性を、iGluRと同様に細胞内のCa2+濃度上昇により評価した。変異型mGluRでは、パラジウム錯体のみで活性化できることが明らかとなった。
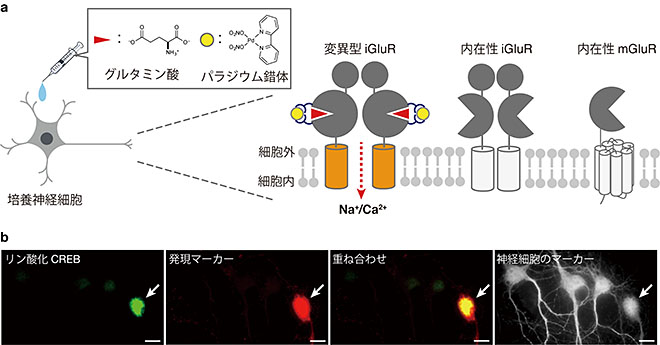
図4 培養神経細胞における変異型iGluRの活性化
- a:培養神経細胞における変異型iGluRの選択的活性化の模式図。モデル細胞とは異なり、神経細胞には元々発現している内在的なiGluRおよびmGluRが存在する。本手法を用いることで、変異型iGluRのみを選択的に活性化できることを示した。
- b:変異型iGluRをパラジウム錯体とグルタミン酸で活性化した後の免疫染色画像。白矢印で示した変異型iGluRを発現している細胞(発現マーカーで赤色に染まっている細胞)でのみ、CREBがリン酸化されていることがわかった(緑色)。
<用語解説>
- 注1) 金属錯体
- 金属や金属イオンが分子の中心に位置する化合物。
- 注2) グルタミン酸受容体
- 主に脳などの中枢神経系に存在し、グルタミン酸と結合する受容体である。記憶や学習のメカニズムに関与していると考えられており、研究対象として注目が集まっている。
- 注3) イオンチャネル型
- 細胞膜上に存在し、受動的にイオンを透過させるタンパク質の総称。本研究で用いたイオンチャネル型グルタミン酸受容体は、Na+やCa2+等の陽イオン(カチオン)を透過させるチャネル(カチオンチャネル)である。
- 注4) Gタンパク質共役受容体(GPCR)型
- 細胞膜上に存在する膜タンパク質。神経伝達物質やホルモンを受容することで構造を変化させ、細胞内のGタンパク質を介して情報を伝達する。細胞膜を7回貫通する特徴的な構造を有することから7回膜貫通型受容体とも呼ばれる。
- 注5) リガンド
- 特定の受容体と結合する化学物質の総称。リガンドの中でも、受容体を活性化するリガンドと不活性化するリガンドが存在する。
- 注6) アロステリック作用
- リガンド結合サイト以外の部分に特定の化学物質が作用することで、タンパク質(膜タンパク質受容体)の活性が変化する現象。
- 注7) 転写因子
- DNAの特定領域に結合し、DNAがメッセンジャーRNAに転写される頻度を制御するタンパク質の総称。
<論文情報>
| タイトル |
“Allosteric activation of membrane-bound glutamate receptors using coordination chemistry within living cells”
(金属錯体化学をもちいた膜結合型グルタミン酸受容体の生細胞におけるアロステリック活性化) |
| 著者名 |
清中 茂樹、窪田 亮、道籏 友紀子、坂倉 正義、高橋 栄夫、沼田 朋大、井上 隆司、柚﨑 通介、浜地 格 |
| 掲載誌 |
Nature Chemistry |
| doi |
10.1038/nchem.2554 |
<お問い合わせ先>
<研究に関すること>
窪田 亮(クボタ リョウ)
京都大学 大学院工学研究科 合成・生物化学専攻 助教
〒615-8510 京都府京都市西京区京都大学桂
Tel:075-383-2757 Fax:075-383-2759
E-mail:
<JST事業に関すること>
鈴木 ソフィア 沙織(スズキ ソフィア サオリ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail:
<報道担当>
京都大学 広報課 国際広報室
Tel:075-753-5727 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: