ポイント
- 膵臓の外分泌組織が極端に少ないマウスを作成して解析したところ、内分泌組織の分化・増殖/維持・成熟が阻害され、糖尿病になった。
- iPS細胞から機能的な膵島(内分泌組織)を作るためには、内分泌細胞だけでなく、膵島には含まれない外分泌組織と共に作製すべきことが示唆された。
児玉 創太 医師(元・京都大学 医学研究科 研究生/京都大学 CiRA 研究員、現・地域医療機能推進機構 滋賀病院 医長)、中野 泰博 研究員(元・京都大学 CiRA 大学院生、現・東海大学 医学部 基盤診療学 再生医療科学 特定研究員)、平田 耕司 研究員(京都大学 医学研究科 研究生/京都大学 CiRA 研究員)、川口 義弥 教授(京都大学 CiRA)らの研究グループは、外分泌組織注1)が極端に少ないマウスを作成して解析したところ、内分泌組織注2)の分化・成熟が阻害され、糖尿病になることを示しました。
今回の研究で、研究グループは胎生期の膵臓形成に必須の遺伝子Pdx1注3)を膵管枝分かれ構造の先端部分だけで働かなくすることで、外分泌組織が極めて少なくなるマウスを作製し、その内分泌組織の形成過程と生後の機能を調べました。その結果、内分泌細胞ができる膵管枝分かれ構造の幹部分も影響を受け、内分泌細胞が少なくなると同時に細胞の成熟化も遅れ、インスリン注4)を十分に分泌できないため、マウスは糖尿病になりました。外分泌組織で作られる未知の因子が、内分泌組織の形成と機能を獲得する過程に重要な働きをしていることが分かりました。
この研究成果は2016年2月18日午前10時(英国時間)に英科学誌「Scientific Reports」で公開されます。
<研究の背景>
膵臓は、さまざまな消化酵素を含む膵液を腸に送り出す外分泌組織と、糖代謝を調節するホルモンを血中に放出する内分泌組織という2つの異なった組織が1つの臓器内に混在する臓器です(図A)。これまでの発生学研究から、胎生期の膵臓で樹枝状に枝別れした膵管構造が形成され、その先端部分から外分泌組織が、幹部分から内分泌組織がほぼ同時にできることが分かっていましたが、両者の相互関係はよく分かっていませんでした。
川口教授らの研究グループは、iPS細胞など多能性幹細胞から機能的な膵島注2)(内分泌組織)細胞を作製し、糖尿病治療に役立てることを目指しており、「より良い膵島細胞を作るには、発生過程と同様に、外分泌細胞と同時に作製するべきでは?」という仮説を立てました。この仮説を検証するため、膵臓の外分泌組織が極端に少ないマウスを用いて解析を行い、内分泌細胞の形成への影響を調べました。
<研究結果>
1.外分泌組織が極めて少なくなる変異マウスが作製できた
Pdx1は、内分泌組織・外分泌組織を含む膵臓形成に必要な転写因子です。ここでは、エラスターゼ注5)を作る膵臓の外分泌細胞だけでPdx1の発現が抑制されるマウスを作製しました(以降、Pdx1cKOマウス注6)とする)。Pdx1cKOマウスの子供は、生後直ぐにはコントロール(Pdx1を発現するマウス)と見分けがつきませんでしたが、7日目には体のサイズが小さく、また、その膵臓サイズも小さいことが分かりました(図1)。
生まれる前の膵臓のサイズは、胎生14.5日まではコントロールとの明らかな違いは見られませんでしたが、胎生16.5日から小さくなり、それ以降コントロールより小さいままでした。外分泌細胞の分化については、胎生16.5日では、外分泌組織を構成する腺房細胞注7)が通常より小さく、立方体状で、細胞質顆粒も少ないなど、外分泌組織の形態も変化していました。
2.外分泌組織が少ないマウスでは血糖値の恒常性が阻害され、インスリン分泌が低い
外分泌組織の発生阻害が、内分泌組織の機能に影響を及ぼすかを調べました。空腹時のPdx1cKOマウスは軽度の高血糖を示していました。生後28日目の腹腔内ブドウ糖負荷試験注8)では、通常のように血糖値が下がらず、ブドウ糖注射15分後の血漿中では、血糖値を下げる役割を担うインスリンの濃度も低く、血糖値恒常性維持機構注9)が阻害された、糖尿病状態になっていることが分かりました(図2)。
3.外分泌組織が少ないマウスでは、内分泌組織の分化・増殖/維持・成熟が阻害される
Pdx1cKOマウスが糖尿病状態になった原因を調べるため、胎児期の膵臓形成を調べました。その結果、外見上、コントロールと明らかな違いの見られない胎生14.5日の段階から、通常では内分泌組織を発生する膵管枝分かれ構造幹部分の細胞のアポトーシス注10)(細胞死)の促進が見られました(図3)。そして内分泌細胞の割合が低く、内分泌組織の分化が正常に進んでいませんでした。これらの結果から、膵臓の発生過程において、外分泌細胞から分泌される何らかの物質によって、内分泌細胞の分化や維持が影響を受けていることが示唆されました。
出生後のマウスを比較すると、Pdx1cKOマウスでは、膵島(内分泌組織)が小さく、生後1日目では、インスリンを分泌するβ細胞の成熟が見られませんでした(図4)。出生後の細胞増殖活性が低く、生後28日目では、成熟マーカーはコントロールと同様レベルまで正常化していましたが、通常なら膵島周辺に並んでいるグルカゴン注11)産生細胞(α細胞)がPdx1cKOマウスでは内部に配置しているなど、膵島の構造についての異常を認めました(図5)。
<まとめ>
本研究では、膵臓の外分泌組織が極めて少なくなる変異マウスを作製すると、そのマウスの内分泌細胞の分化や成熟が阻害され、糖尿病になることを示しました。
今回の結果から、iPS細胞を用いた糖尿病に対する再生医療の開発において、内分泌組織だけでなく外分泌組織も同時に作製する方が良いと考えられます。また今後、外分泌組織から内分泌組織に働きかける因子を解明することで、さらに機能的な膵島細胞の作製が期待できます。
<参考図>
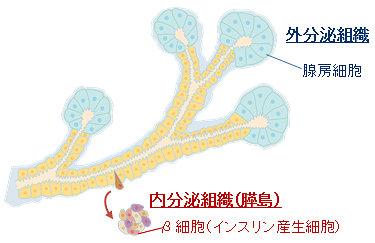
図A 膵臓の構造
枝分かれした膵管構造の幹部分から内分泌細胞が発生し、外に出て、膵島ができる。

図1 外分泌細胞特異的にPdx1をノックアウトしたマウスとその膵臓(生後7日目)
青に染まっている部分が膵臓を示す。Pdx1cKOマウスでは、外分泌組織が少なく、膵臓が小さい。
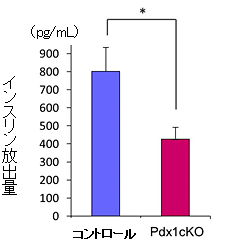
図2 腹腔内ブドウ糖負荷試験15分後の血漿中インスリン濃度(生後28日)
Pdx1cKOマウスでは、インスリン放出量が有意に低かった。
(n=4,mean±S.E.,*p<0.05)

図3 胎生14.5日目の膵臓
赤矢印:増殖活性マーカー、緑矢印:アポトーシス・マーカー、青:外分泌組織を示す。
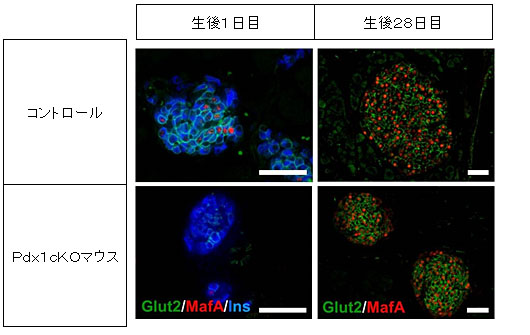
図4 膵島の成熟の様子(生後28日目)
Glut2,MafA:内分泌β細胞成熟マーカー、Ins:インスリン(β細胞マーカー)
[スケールバー:50µm]
Pdx1cKOマウスでは、コントロールより内分泌組織が小さい。
生後1日目では成熟マーカーが少なく、膵島の成熟が遅れている。
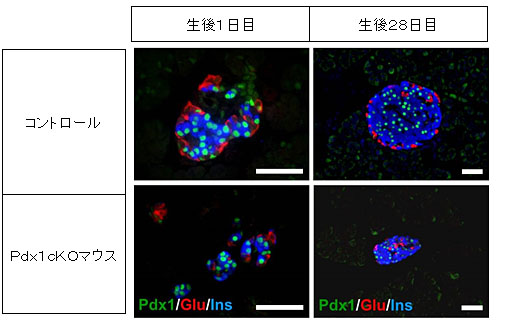
図5 膵島の構造(生後28日目)
Pdx1:膵芽細胞マーカー、Glu:グルカゴン(α細胞マーカー)、Ins:インスリン(β細胞マーカー)
[スケールバー:50µm]
Pdx1cKOマウスでは、膵島が小さいままで、内分泌組織の構成細胞の配置がコントロールと異なっている。
<用語解説>
- 注1) 外分泌組織
- 膵管を通じてさまざまな消化酵素を含む膵液を分泌する組織。膵臓の大部分(約95%)を構成する。
- 注2) 内分泌組織(膵島)
- 糖代謝に関連するホルモンを血液中に分泌して、血糖値調節を司る組織。α細胞、β細胞、δ細胞、PP細胞の4種類の細胞で構成されている。ランゲルハンス島とも呼ばれる。
- 注3) Pdx1
- 膵芽細胞マーカー。発生過程において、膵臓の内分泌細胞・外分泌細胞の形成に必須の遺伝子。
- 注4) インスリン
- 血糖値を低下させる唯一のホルモン。内分泌組織のβ細胞から血中に分泌され、肝臓・筋肉・脂肪組織などで細胞内へのブドウ糖の取り込みを促進する。インスリンが不足すると、肝臓・筋肉・脂肪組織などの臓器でブドウ糖の利用や取り込みが低下し、血中のブドウ糖が増えて高血糖になるため、糖尿病になる。
- 注5) エラスターゼ
- 膵臓の外分泌組織で生成される消化酵素。
- 注6) Pdx1cKOマウス
- 個体発生に必須の遺伝子などを特定の細胞でのみノックアウトできる(働かないようにする)Cre/loxPシステムを利用して作製した。本研究では、エラスターゼをつくる外分泌細胞だけでCreが活性化して、膵臓形成に必要なPdx1の発現を抑える。
- 注7) 腺房細胞
- 膵臓の外分泌組織を構成する細胞。糖質、脂質、タンパク質に対するそれぞれの消化酵素(アミラーゼ、リパーゼ、キモトリプシン/トリプシン/エラスターゼなど)を産生し分泌する。
- 注8) 腹腔内ブドウ糖負荷試験(IPGTT; Intraperitoneal glucose tolerance test)
- ブドウ糖を腹腔内に投与し、血糖値を一定時間ごとに測定することにより、糖代謝機能に異常があるかを判定する試験。
- 注9) 血糖値恒常性維持機構
- 血糖値(血中ブドウ糖濃度)が一定の範囲に調節されるしくみ。通常の状態では、血糖値を下げる「インスリン」と、上げる働きをする「グルカゴン」の両ホルモンの作用によって、血糖値は調節されている。
- 注10) アポトーシス
- 個体の生命維持のために、不要な細胞や異常な細胞を自ら死に至らしめるように制御されたメカニズム。生体内では、個体発生におけるさまざまな臓器・組織の余分な細胞の除去、癌化細胞や内部に異常を起こした細胞の除去、自己抗原に反応する細胞の除去などに重要な役割を果たす。
- 注11) グルカゴン
- 内分泌組織のα細胞から血液中に分泌されるホルモン。インスリンと拮抗的に作用し、おもに低血糖になると働き、血糖値を上げる。
<論文情報>
| タイトル |
“Diabetes caused by Elastase-Cre-Mediated Pdx1 inactivation in Mice” |
| 掲載誌 |
Scientific Reports |
| 著者 |
Sota Kodama1,2+, Yasuhiro Nakano2+, Koji Hirata1,2+, Kenichiro Furuyama1,2, Masashi Horiguchi1,2, Takeshi Kuhara1, Toshihiko Masui1, Michiya Kawaguchi1, Maureen Gannon3,4, Christopher V.E. Wright3, Shinji Uemoto1 and Yoshiya Kawaguchi2*
(*責任著者、+同等貢献)
著者の所属機関:
- 京都大学 大学院 医学研究科
- 京都大学 iPS細胞研究所(CiRA)
- ヴァンダービルト大学 細胞・発生生物学部
- ヴァンダービルト大学 医学部
|
<本研究への支援>
本研究は、下記機関より資金的支援を受けて実施されました。
- 若年性糖尿病研究財団
- 米国国立衛生研究所(National Institutes of Health:NIH)
- 日本学術振興会 最先端・次世代研究開発支援プログラム
- JST AMED 再生医療実現拠点ネットワークプログラム
<お問い合わせ先>
<研究内容およびCiRAに関すること>
京都大学 iPS細胞研究所(CiRA)
国際広報室 野口 悦
〒606-8507 京都府京都市左京区聖護院川原町53
Tel:075-366-7005 Fax:075-366-7185
E-mail:
<AMED 再生医療実現拠点ネットワークプログラムに関すること>
日本医療研究開発機構 再生医療研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル22階
Tel:03-6870-22205 Fax: 03-6870-2242
E-mail:
URL: https://www.amed.go.jp/
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: