ポイント
- 血液中のタンパク質AIMがこれまで全く知られていなかった作用メカニズムにより、急性腎不全を顕著に治癒せしめることを見出した。
- AIMは、急性腎不全時、マウスとヒトで同じ動態を示すことを明らかにした。したがってAIMは、マウスのみならずヒト患者においても急性腎不全の治癒に重要な役割を果たすと考えられる。
- 本研究は、これまで確実な治療法のなかった急性腎不全に対する新規かつ効率的な治療法の開発に貢献することが期待される。
腎臓は血液中の老廃物をろ過し、尿として排泄する重要な器官である。腎臓の機能が低下すると、血液中に老廃物が溜まり、身体の色々な臓器の働きに支障をきたす。出血による腎臓の虚血、細菌感染、薬剤など色々な原因により腎臓が障害され、急速に腎機能が低下する状況を急性腎不全という。急性腎不全は自然に改善する場合もあるが、致死率も高い。また、急性腎不全を発症した患者は慢性化するリスクが著しく高まり、慢性腎不全となり将来的に透析を受けなくてはならなくなる場合も多い。これまで多くの研究がなされてきたが、急性腎不全に対して確実な治療法の確立は果たされていなかった。
東京大学 大学院医学系研究科の宮崎 徹 教授らの研究グループは、自ら発見したタンパク質AIM注1)(文献1-4)が、直接腎臓に働きかけ急性腎不全を治癒させることを明らかにした。
急性腎不全が生じると、腎臓の中の尿の通り道(尿細管という)に“ゴミ”(細胞の死骸)が詰まり、そのことが腎機能の低下を招く引き金となることが知られている。AIMは通常血液中に存在するが、腎臓の機能が低下すると尿中に移行しゴミに付着する。そして付着したAIMが目印となって、周囲の細胞が一斉にゴミを掃除し、迅速に詰まりが解消され、その結果、腎機能は速やかに改善することが明らかとなった。さらに本研究グループは、AIMを持たないマウスが急性腎不全になると、詰まったゴミは掃除されることなく、腎臓の機能は著しく悪化し続け多くが死んでしまい、またAIMを正常に持っているマウスでも、重症の急性腎不全を起こすと、体内に持っているAIMの量では十分にゴミが掃除されず、腎臓内の詰まりが解消されないまま、やはり多くが死んでしまうことを明らかにした。そしていずれの場合でも、AIMを静脈注射することで、尿細管の詰まりは劇的に解消され、腎機能が速やかに改善し致死率は著しく低下することを見出した(注:致死率は60~100%であったものが、AIM投与により0%となった)。
すなわち、血中のAIM量が不十分である場合(もともと血中濃度が低い場合や、重度の腎不全が生じた場合)には、AIMを投与することで急性腎不全を速やかに改善させ、慢性化する危険を回避することが可能であると考えられる。腎機能低下時の血中AIMの尿中への移行およびゴミへの付着は、ヒト急性腎不全患者でも同様に観察されるため、マウスだけでなくヒト急性腎不全患者においても、AIMによる治療は有効であると考えられる。
本研究結果により、これまで確実な治療法のなかった急性腎不全の治療がAIMにより可能になると期待される。また、急性腎不全治癒後も、定期的にAIMを投与し、腎臓のゴミを掃除することにより、急性腎不全の再発や慢性化のリスクを低下させる可能性が高いと考えられる。また、AIMは本来人間の血液中に存在しているので安全性の高い治療法となることが期待される。
本研究成果は、2016年1月4日(米国東部時間)に「Nature Medicine」オンライン版で公開される。
本研究は、日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)の研究開発領域「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」(研究開発総括:永井 良三)の一環で行われた。なお、本研究開発領域は、本年度4月の日本医療研究開発機構の発足に伴い、科学技術振興機構より移管されている。
<発表内容>
急性腎不全(Acute Kidney Injury:AKI)は、腎虚血、敗血症、腎毒性のある薬剤など、多彩な原因によって発症する。自然軽快する場合もあるが、長期の入院を必要とし死亡率も高い。何よりもAKI患者は、慢性腎不全(Chronic Kidney Disease:CKD)を発症するリスクが高まるため、AKIの積極的な治療が望ましいが、これまで実用化に至った治療法はない。
AKIの重要な病理学的特徴の1つは、壊死した近位尿細管上皮細胞が脱落し、その死細胞塊(debris)が管腔内を閉塞することである。それが二次的に腎実質の炎症や線維化を惹起すると共に、糸球体機能を低下させることが知られている。
本研究グループは、血中タンパク質AIM(Apoptosis Inhibitor of Macrophage:CD5Lとも呼ばれる。文献1-4)が、AKIの治癒メカニズムに決定的な役割を果たしていること、それゆえ、AIMによってAKIを治療できる可能性があることを示した。
健康時、AIMは血液中でIgM五量体と結合して存在している(文献5)。IgM五量体は巨大な分子量の複合体(>1000kDa)であるため、AIMは尿中に排泄されることはない。しかし、AKIが発症すると、全身性にAIMが急速にIgM五量体から解離し、単体のAIM(フリーAIM)となる。フリーAIMは40kDa以下の分子量であるため糸球体を通過し、尿中に移行する。そして尿中のAIMは、AKIによって生じた近位尿細管を閉塞しているdebrisに付着する。これらの現象は、虚血再灌流(IR)でAKIを発症させたマウスでも、ヒトAKI患者でも共通して認められた。
AKI時に障害を受けた(が死んではいない)近位尿細管上皮細胞は、Kidney Injury Molecule-1(KIM-1)という膜タンパク質を管腔側に向けて強く発現する。興味深いことに、KIM-1はAIMのリガンド注2)であり、debrisに付着したAIMがdebrisごとKIM-1を介したphagocytosisによって近位尿細管上皮細胞に取り込まれることが明らかになった。すなわち、AIMがKIM-1に認識されることにより、KIM-1を発現している尿細管上皮細胞によって急速にdebrisが除去され、管腔の閉塞が解消されるのである。本研究グループは、この新たに発見したメカニズムをvivoとvitroの多くの実験で証明した。
AIMを正常に有する野生型(wild-type:WT)マウスとAIM欠損(AIM-KO)マウスにIRによってAKIを誘導すると、WTでは、上記のAIM/KIM-1の作用によるdebrisの急速な除去に伴い、一旦悪化した腎機能は速やかに改善する。しかし、AIM-KOマウスでは、尿細管上皮にKIM-1は発現しているものの、debrisの除去は著しく不全となり、近位尿細管の閉塞が解消されず、腎機能・全身状態は急速に悪化し、多くのマウスが死んでしまう。また、KIM-1欠損マウスがAKIを発症した場合、AIMは尿中に移行し、debrisに付着するもののdebrisは除去されず、AIM-KOマウスと同様に大半が死んでしまう。
しかしながら、AKIを発症したAIM-KOマウスにAIMを投与すると、debrisの除去を誘起することによって腎機能は速やかに改善し、生存率も著しく上昇する。さらに、WTマウスでもほとんどが死亡してしまうような重篤なAKIを発症させた場合でも、AIMを投与することにより、同様に腎機能と生存率の著しい改善をみることができた。すなわち、AIM投与がAKIの治療法として有効であることを示した(図)。
さらにAIMは診断法への応用の可能性もある。AKIを発症したヒトおよびマウスにおいて、腎機能の重症度と尿中のAIM量は相関していた。マウスでは、AKIの回復と共に、尿中のAIM量は減少した。したがって、尿中AIM値は、AKIの重症度と予後判定の新規マーカーとなり得ると考えられる。以上の研究成果から、AIMはAKIの診断と治療に対し、新しい大きな可能性を持つタンパク質であると期待される。
<参考図>
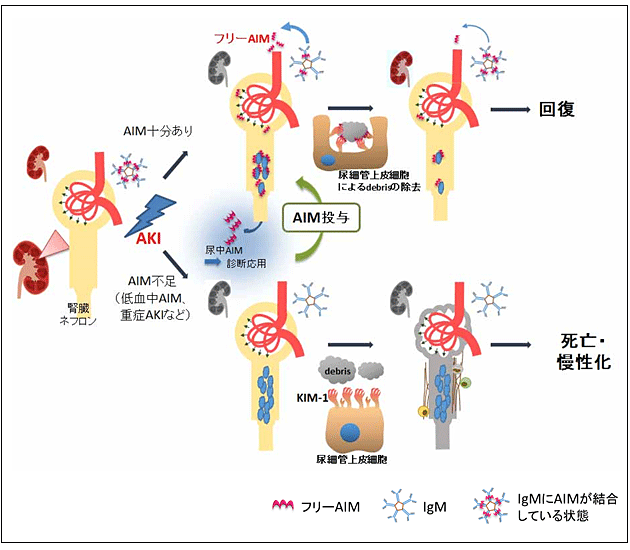
図 AIMによる急性腎不全(AKI)治癒メカニズムとその臨床応用
AKI発症時、血中にAIMが十分ある場合(上)、IgMから解離したフリーAIMが尿中に移行し、近位尿細管に詰まったdebrisに付着し、それを目印としてKIM-1を発現した尿細管上皮細胞が速やかにdebrisを除去し、AKIは回復に向かう。一方、AIMが不足している状況、すなわち血中AIM値が低値であったり、通常のAIMの量では十分治癒できないような重症のAKIを発症した場合(下)、debrisの除去が十分に行われず、二次的に炎症や線維化、さらには糸球体の機能低下を惹起し、腎不全のために患者は死亡あるいは慢性化する。このような場合、AIMを投与しdebrisの十分な除去を誘導することによって、AKIを治療することが可能である。また、尿中のAIM値を測定することにより、AKIの重症度や予後を診断することも可能である。
<用語解説>
- 注1) AIM(Apoptosis Inhibitor of Macrophage)
- 当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として東京大学 大学院医学系研究科の宮崎 徹 教授が発見したもの。その後の研究で、作用する細胞の種類などの違いによりアポトーシス抑制以外にもさまざまな作用があることが明らかになった。
- 注2) リガンド(ligand)
- 結合し相互作用する相方となる分子のこと。
<論文情報>
| タイトル |
“Apoptosis inhibitor of macrophage protein enhances intraluminal debris clearance and ameliorates acute kidney injury in mice” |
| 著者 |
新井 郷子、北田 研人(以上、co-first author)、山崎 智子、高井 亮輔、津川 陽司、杉澤 良一、松元 彩香、森 真弓、吉原 靖典、土井 研人、前原 奈津美、楠木 俊介、土井 研人、野入 英世、矢作 直樹、宮崎 徹(corresponding author)、以上東京大学
Xizhong Zhang、Lakshman Gunaratnam(Western University, Canada)、高畑暁子、鈴木祐介(順天堂大学)、西山 成(香川大学)、高野 朋子(McGill University, Canada) |
| 掲載誌 |
Nature Medicine(Article)(2016年1月4日オンライン版) |
| doi |
10.1038/nm.4012 |
<参考文献>
- Miyazaki, T. et al. J. Exp. Med. 189: 413-422 (1999)
- Kurokawa, J. et al. Cell Metab. 11: 479-492 (2010)
- Maehara, N., et al. Cell Rep. 9: 61-74 (2014).
- Arai, S. & Miyazaki, T. Semin. Immunopathol. 36: 3-12 (2014). Review.
- Arai, S. et al. Cell Rep. 3: 1187-1198 (2013).
<お問い合わせ先>
<研究に関すること>
宮崎 徹(ミヤザキ トオル)
東京大学 大学院医学系研究科 附属疾患生命工学センター 分子病態医科学部門 教授
Tel:03-5841-1436 Fax: 03-5841-1438
E-mail:
<事業に関すること>
日本医療研究開発機構(AMED) 戦略推進部 研究企画課
Tel:03-6870-2224 Fax: 03-6870-22
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: