理化学研究所(理研) 統合生命医科学研究センター 炎症制御研究チームの小野 瑠美子 大学院生 リサーチ・アソシエイト、田中 貴志 チームリーダーと和歌山県立医科大学 医学部先端医学研究所の改正 恒康 教授の共同研究チームは、炎症反応を制御する新たな分子を発見しました。
生体にウイルスや細菌が感染すると、まず樹状細胞注1)という免疫細胞がこれらの病原体を認識し、炎症反応という一連の免疫反応を起こすことにより、侵入した病原体を攻撃します。ところが、この炎症反応が、何らかの原因で過剰に、しかも無制限に起こってしまうと、アレルギー疾患や自己免疫疾患注2)となることが知られています。このことから、生体は免疫系を効率的に活性化するだけでなく、逆に抑制するシステムも備えており、炎症反応が過剰にならないように巧妙に調節していると考えられています。
樹状細胞による炎症反応の発動には、「NF-κB注3)」という核内の転写因子の活性化が極めて重要であることが知られています。NF-κBは普段は細胞質に存在していますが、病原体の感染などで樹状細胞が活性化されると核内に移動し、炎症性サイトカイン注4)などの炎症反応に必要なさまざまな遺伝子を活性化させ炎症反応を誘導します。
共同研究チームは、「PDLIM1」という細胞質内に存在するタンパク質が、NF-κBと結合してNF-κBの核内への移動を妨げることにより、炎症反応を抑制することを発見しました。さらに、このPDLIM1によるNF-κBの核内移動の抑制には、PDLIM1が、細胞骨格タンパク質であるアクチンに結合しているαアクチニン注5)というタンパク質と結合することが重要だと分かりました。
実際、PDLIM1を欠損させたマウスの樹状細胞では、NF-κBの核への移動が亢進しており、正常マウスと比べて、炎症性サイトカインの産生量が2~3倍に増えていることが分かりました。
今回解明したPDLIM1による炎症反応の抑制機構は、アレルギー疾患や自己免疫疾患の治療を目的とした人為的な免疫制御法の開発に役立つと期待できます。
本研究は、科学技術振興機構(JST) 戦略創造研究推進事業の一環として行われました。成果は、英国のオンライン科学雑誌『Scientific Reports』(12月18日付け)に掲載されます。
<背景>
生体にウイルスや細菌が感染すると、まず樹状細胞という免疫細胞がこれらの病原体を認識し、炎症反応という一連の免疫反応を起こすことにより、侵入した病原体を攻撃します。樹状細胞は細胞膜上のToll(トール)様受容体(TLR)注6)というセンサーを使って病原体を認識します。そしてTLRから細胞内へシグナルが伝わり、最終的に転写因子「NF-κB」が活性化します。活性化したNF-κBは、炎症反応に必要な多くの遺伝子が順序よく働くように指令を出し、炎症反応の開始と進行に必要不可欠な役割を果たしています。ところが、このNF-κBが過剰に活性化して免疫細胞が暴走するような状態が続くと、アレルギー疾患や炎症性疾患、自己免疫疾患を発症することが報告されています。このため、正常な免疫応答を保ちながらこれら疾患の発症を防ぐには、NF-κBの活性をオンにするだけでなく、それを適切な時点でオフにするシステムが非常に重要です。
田中 貴志 チームリーダーらは2007年、核内タンパク質「PDLIM2(PDZ and LIM domain protein 2)注7)」が、NF-κBの分解を誘導することにより炎症反応を抑制することを明らかにしました※1)。NF-κBは活性化すると細胞質から核へと移行し、炎症反応に必要な多くの遺伝子の転写を誘導しますが、PDLIM2は、炎症反応を抑制するため核内に移行したNF-κBにユビキチン注8)という小さなタンパク質を付加(ユビキチン化)します。ユビキチン化はタンパク質分解酵素の目印となることから、NF-κBの分解が誘導され炎症反応が抑制されます。
PDLIM2はPDZドメイン注9)とLIMドメインという特有の構造を持っています。この2つのドメインを持つタンパク質はPDZ-LIMタンパク質と呼ばれ、これまでに、PDLIM2を含めて10個のファミリー遺伝子が報告されています。しかし、PDLIM2以外のPDZ-LIMタンパク質が免疫系でどのように働いているのかは明らかにされていませんでした。そこで共同研究チームは、このPDZ-LIMタンパク質の中で、PDLIM2と最も構造が似ているものの1つで、樹状細胞に強く発現しているPDLIM1について、樹状細胞による炎症反応の誘導をどのように調節しているかを調べることにしました。
- ※1) 2007年4月30日プレスリリース「炎症反応を制御する新たなメカニズムを解明」
-
 http://www.riken.jp/~/media/riken/pr/press/2007/20070430_1/20070430_1.pdf
http://www.riken.jp/~/media/riken/pr/press/2007/20070430_1/20070430_1.pdf
<研究手法と成果>
共同研究チームは、まず培養細胞にNF-κBとPDLIM1を過剰に発現させて、PDLIM1がNF-κBの活性化をどのように調節するのかを調べました。NF-κBが炎症反応に関わる遺伝子の転写を誘導するためには、NF-κBが活性化に伴って細胞質から核へと移行することが非常に重要ですが、PDLIM1はこのNF-κBの核への移動を妨げることにより、NF-κBの転写活性を抑制することが明らかになりました。さらにPDLIM1は、TLRが認識する細菌成分であるリポ多糖(Lipopolysaccharide;LPS)で細胞を刺激したときの炎症性サイトカインの産生も著しく抑制していました。
次に、PDLIM1がどのようにNF-κBの核への移動を妨げているのかを調べました。PDLIM1のPDZドメインは、細胞骨格タンパク質のアクチンと結合しているタンパク質の1つであるαアクチニンというタンパク質と結合することが知られています。実験の結果、PDLIM1によるNF-κBの核内移動の抑制には、PDLIM1がαアクチニンと結合して、NF-κBを細胞質内にとどめることが重要であることが明らかになりました(図)。また、これまではIκBαという抑制性タンパク質がNF-κBと結合することが、NF-κBを細胞質にとどめる主要なメカニズムであると考えられてきましたが、PDLIM1は、IκBαとはまったく独立にNF-κBの核への移行を阻害していることも明らかになりました。
さらに、PDLIM1を欠損させた樹状細胞では、NF-κBの核への移動が亢進しており、正常マウスと比べて、炎症性サイトカインの産生量が2~3倍に増えていました。PDLIM1はNF-κBの活性を抑制することで、生体に過剰な炎症反応が起こらないように制御していると考えられます。
<今後の期待>
PDLIM1やPDLIM2などのPDZ-LIMタンパク質は、炎症反応を制御するタンパク質の新しいファミリーであり、それぞれが異なったメカニズムで、炎症反応を抑制していると考えられます。これらのPDZ-LIMタンパク質による炎症反応の抑制機構は、アレルギー疾患や自己免疫疾患の治療を目的とした人為的な免疫制御法の開発に役立つと期待できます。
<参考図>
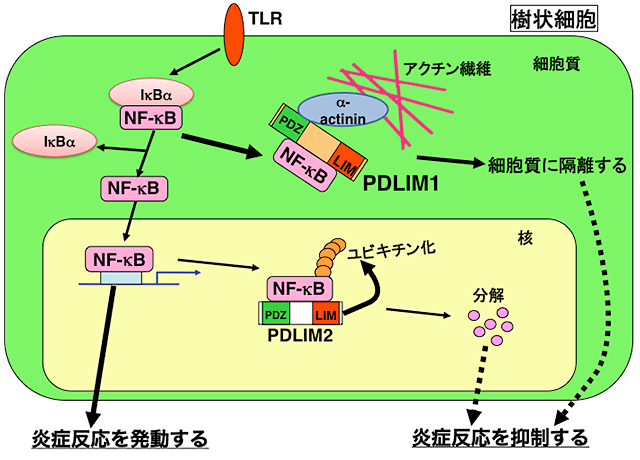
図 PDLIM1およびPDLIM2による炎症反応制御機構
樹状細胞において、PDLIM2は核内に移行したNF-κBにユビキチンを付加(ユビキチン化)する。ユビキチン化はタンパク質分解酵素の目印となるため、NF-κBの分解が誘導され炎症反応が抑制される。PDLIM1は、アクチンに結合しているタンパク質の1つであるαアクチニンと結合して、NF-κBを細胞質内にとどめて、NF-κBの核への移行を阻害する。その結果、炎症反応が抑制される。
<用語解説>
- 注1) 樹状細胞
- 樹状突起を持つ白血球で、病原体を認識して取り込み、Tリンパ球に異物の情報を伝える。Tリンパ球は、病原体を攻撃したり、他の免疫細胞を刺激して抗体の生産を活性化する免疫細胞。
- 注2) 自己免疫疾患
- 何らかの免疫異常によって自分の体や組織を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の体を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。
- 注3) NF-κB
- 特定のDNA配列に結合して遺伝子の発現を制御するタンパク質を転写因子という。転写因子のNF-κBにはp65を含む5種類のサブユニットが知られており、これらが二量体を形成したものが転写因子として機能する。Toll様受容体が認識する菌体成分などの刺激で活性化され、炎症性サイトカインなどの発現を亢進させることで、炎症反応の誘導に中心的役割を果たす。
- 注4) 炎症性サイトカイン
- サイトカインとは、細胞同士の情報伝達に関わるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。
- 注5) αアクチニン
- 細胞骨格を構成しているアクチンに結合するタンパク質の1つ。アクチン線維の構造を制御しているほかに、他のタンパク質をアクチン線維および細胞骨格に結合する足場として機能している。
- 注6) Toll(トール)様受容体(TLR)
- TLRはToll-like receptorの略。病原体由来のさまざまな成分の認識に関与する膜タンパク質群の総称。ヒトでは10種類、マウスでは12種類が報告されており、それぞれのTLRが病原体特異的な成分(膜分子や核酸)を認識する。
- 注7) PDLIM2(PDZ and LIM domain protein 2)
- PDZドメインとLIMドメインという2つの特殊な構造を持つタンパク質で田中 貴志 チームリーダーらが発見した。標的タンパク質となる転写因子をユビキチン化し分解を誘導することで、シグナル伝達を抑制させるように働く。
- 注8) ユビキチン
- ユビキチンは76個のアミノ酸からなる小さなタンパク質で、標的となるタンパク質に多数のユビキチン分子が鎖状に結合すると、標的タンパク質はプロテアソームという巨大なタンパク質分解酵素複合体に認識され分解される。
- 注9) ドメイン
- タンパク質分子中で複数の領域に分けることができる場合がある。これをドメインと呼び、特定の機能や構造で他と区別できる。
<論文情報>
| タイトル |
“PDLIM1 inhibits NF-κB-mediated inflammatory signaling by sequestering the p65 subunit of NF-κB in the cytoplasm” |
| 著者 |
Rumiko Ono,Tsuneyasu Kaisho,Takashi Tanaka |
| 掲載誌 |
Scientific Reports |
| doi |
10.1038/srep18327 |
<お問い合わせ先>
<研究に関すること>
理化学研究所 統合生命医科学研究センター 炎症制御研究チーム
チームリーダー 田中 貴志(タナカ タカシ)
大学院生 リサーチ・アソシエイト 小野 瑠美子(オノ ルミコ)
Tel:045-503-9283(田中) Fax:045-503-7064
E-mail: (田中)
(田中)
和歌山県立医科大学 医学部 先端医学研究所
教授 改正 恒康(カイショウ ツネヤス)
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
川口 哲(カワグチ テツ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
理化学研究所 広報室 報道担当
Tel:048-467-9272 Fax:048-462-4715
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
和歌山県立医科大学 総務課
Tel:073-441-0710 Fax:073-441-0713
E-mail: