ポイント
- 多発性硬化症は、中枢神経系の組織に免疫細胞が侵入して神経を傷つけた結果、視力障害や感覚障害、運動麻痺などの神経症状が起こる自己免疫疾患です。本研究により、多発性硬化症において多数の免疫細胞が中枢神経組織に侵入する仕組みを明らかにしました。
- 多発性硬化症では、病原性のT細胞が産生するRANKL(ランクル)というサイトカインが、中枢神経組織のアストロサイトに働きかけて、ケモカインの放出を促すため、多数の免疫細胞が中枢神経組織に集積し炎症が起きることが分かりました。
- マウスの多発性硬化症モデルにおいて、RANKLの活性を低下させるような低分子阻害剤が高い治療効果を示すことが分かり、今後RANKLを標的とした新しい治療アプローチの開発が期待されます。
免疫系は病原菌やウイルスなどの異物を認識し排除するシステムですが、時には私たちの身体の一部を異物と誤認してしまい、自己組織を攻撃し炎症を引き起こすことがあります。多発性硬化症は、脳や脊髄といった中枢神経系注1)が免疫系によって攻撃を受ける自己免疫疾患であり、視力障害や運動麻痺などの神経症状が起きます。患者数が全世界で約250万人に及ぶ難病の神経疾患で、いまだ根治療法が存在しません。
健常状態では、中枢神経組織内に血液中の有害物質が侵入できないように、血液脳関門注2)と呼ばれる特殊なバリア機構が存在するため、免疫細胞は簡単に侵入できません。しかし、多発性硬化症では、たくさんの炎症性細胞注3)が中枢神経組織に侵入し集積してしまいます。多発性硬化症で、炎症性細胞が血液脳関門を通り抜けて中枢神経組織に集まる理由は、これまでよく分かっていませんでした。
この度、東京大学 大学院医学系研究科 病因・病理学専攻 免疫学分野のMatteo M.Guerrini 学術支援職員(研究当時)と岡本 一男 助教、高柳 広 教授らの研究グループは、マウスの多発性硬化症モデルである実験的自己免疫性脳脊髄炎(EAE)注4)の解析から、病原性T細胞注5)が発現するサイトカイン注6)RANKLが、中枢神経組織のアストロサイト注7)を刺激してケモカイン注8)を放出させるため、多数の免疫細胞が呼び寄せられ、炎症が起こることを突き止めました。さらに、RANKLの低分子阻害剤をマウスに経口投与することで、EAEの発症を抑えることができました。従って、RANKLを阻害する治療アプローチが多発性硬化症に有効であることが分かりました。
本研究は日本学術振興会 科学研究費補助金、科学技術振興機構 戦略的創造研究推進事業「高柳オステオネットワークプロジェクト」(研究総括:高柳 広)、ならびに日本医療研究開発機構 難治性疾患実用化研究事業などの一環で行われました。
本研究成果は、2015年12月8日(米国東部時間)に米国科学誌「Immunity」のオンライン速報版で公開されます。
<発表内容>
免疫系は本来、病原菌やウイルスなどの異物を認識し排除するシステムですが、時には私たちの身体を構成している成分を異物と誤認し攻撃することにより、自己の組織に炎症が起こり、組織損傷に至るケースがあります。こうした現象が生ずる病気を、「自己免疫疾患」と呼び、その中でも、中枢神経組織系が免疫系の標的となって引き起こされる疾患の1つが多発性硬化症です。中枢神経系の神経線維は、絶縁体の役割を果たす「髄鞘」と呼ばれる膜状構造物に覆われ、神経ネットワークに流される電気信号が、高速かつ正確に伝えられています。多発性硬化症では免疫系の攻撃によって髄鞘が破壊されることにより、神経情報伝達が障害され、視力障害や感覚障害、運動麻痺などの神経症状が起こります。多発性硬化症は、欧米の白人種に多く見られる疾患ですが、日本でも約1万人の患者が存在します。根治療法が現在のところ存在せず、国が定める指定難病に含まれています。
中枢神経組織には、血液中の有害物質が流入しないように血液脳関門と呼ばれるバリア機構があります。このため、免疫細胞やウイルス、毒素などの大きな分子は脳や脊髄に至ることはありません。しかし、多発性硬化症では、自己に反応する病原性T細胞が血液脳関門を通過して中枢神経組織に侵入し、さらに多くの免疫細胞が呼び寄せられ、慢性的な炎症が引き起こされます。多発性硬化症で、たくさんの免疫細胞が血液脳関門を通り抜けて中枢神経組織に集まる理由はよく分かっていませんでした。
今回、多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎(EAE)の解析から、病原性T細胞が発現するRANKLというサイトカインが中枢神経組織の炎症を引き起こすことを突き止めました。T細胞だけでRANKL遺伝子を破壊したマウスを作製し、EAEモデルを解析したところ、発症率も病態の進行も強く抑えられることが分かりました(図1)。さらに、このマウスでは、病原性T細胞やマクロファージなどの炎症性細胞が中枢神経組織内に侵入できず、中枢神経組織の炎症も髄鞘破壊も強く抑えられていました。中枢神経組織内のアストロサイトは、RANKLに対するRANK受容体を発現しており、病原性T細胞はRANKLを介してアストロサイトに働きかけることが分かりました。またRANKLの刺激を受け取ったアストロサイトは、細胞の移動を促す因子であるケモカインを大量に産生し、その結果多くの病原性T細胞や炎症性細胞を中枢神経組織に呼び寄せてしまい、慢性的な炎症が起こることが明らかとなりました(図2)。実際、アストロサイトだけでRANK受容体を欠損させたマウスでも、EAEの発症が抑えられました。さらにRANKLに対する低分子阻害剤をマウスに経口投与すると、EAEの発症率が抑えられました(図3)。
本研究成果により、多発性硬化症で中枢神経系に炎症が引き起こされる仕組みが明らかになりました。また、RANKLを標的とした治療法が多発性硬化症に対して強い効果を発揮すると期待されます。多発性硬化症の治療としては、ステロイド製剤やインターフェロン治療といった免疫応答を広範に抑える手法が主流でしたが、近年フィンゴリモドやナタリズマブといったT細胞輸送を抑える新薬の開発が進み、注目を浴びています。RANKLを標的とした治療法は、こうしたT細胞輸送を標的とした新しい治療アプローチに、さらなる飛躍をもたらすものと期待されます。またRANKLは骨粗しょう症や関節リウマチの骨破壊の引き金になるサイトカインとしても有名です。近年、RANKLに対する中和抗体が骨粗しょう症やがんの骨転移病変の治療薬に承認され、骨疾患分野で注目されています。本成果により、RANKLを標的とした新しい疾患制御の可能性を提言できたといえます。
<参考図>
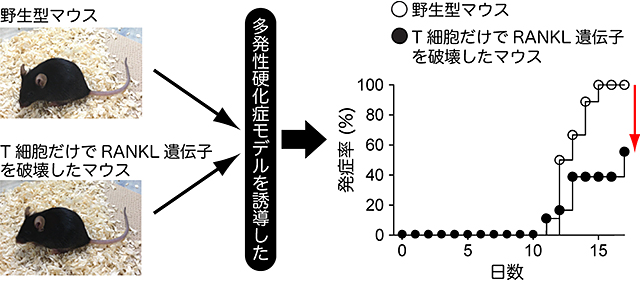
図1 T細胞でRANKL遺伝子を破壊したマウスは多発性硬化症に対して抵抗性を示す
野生型マウスおよびT細胞だけでRANKL遺伝子を破壊したマウスに、多発性硬化症のモデルである実験的自己免疫性脳脊髄炎(EAE)を誘発させた。野生型マウスでは10日過ぎたあたりからEAEを発症するマウスが現れ、15日目では全てのマウスがEAEを発症する。一方、T細胞だけでRANKL遺伝子を破壊したマウスでは、発症率が半減した。
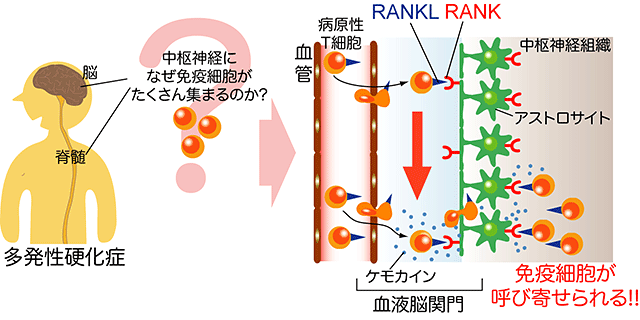
図2 T細胞が発現するサイトカインRANKLが、中枢神経組織に免疫細胞を呼び寄せる
多発性硬化症では多数の免疫細胞が血液脳関門を通り抜けて、中枢神経系に集積する(左図)。それは、病原性T細胞が発現するRANKLというサイトカインの仕業だった。病原性T細胞が発現するRANKLは、アストロサイト上のRANK受容体に作用する(右図の上)。その結果、ケモカインがアストロサイトから放出され、多くの免疫細胞が中枢神経組織に呼び寄せられてしまい、炎症が引き起こされる(右図の下)。
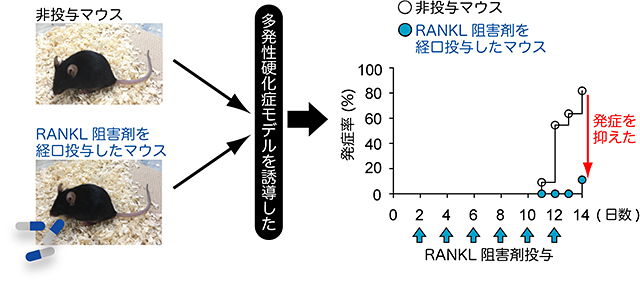
図3 RANKL阻害剤の投与により、多発性硬化症の発症が抑えられる
RANKLに対する低分子阻害剤を2日おきに経口投与したところ、多発性硬化症の発症率が強く抑えられた。
<用語解説>
- 注1) 中枢神経系
- 脊椎動物の神経系は中枢神経系と末梢神経系に大別される。中枢神経系は脳、脊髄で構成され、末端器官に指令を出す司令塔としての役割を果たす。一方、末梢神経系は、効果器や感覚器などの末端器官と中枢神経系を連結する働きを担う。
- 注2) 血液脳関門
- 血液と脳・脊髄との間の物質輸送を制限する機構。中枢神経系の血管の内皮細胞、血管周皮の細胞およびアストロサイトによって形成されている。
- 注3) 炎症性細胞
- 免疫応答の局所に集まってくる細胞で、好中球、マクロファージ、リンパ球などの白血球を指す。充血・はれ・発熱・痛みなどの原因となる。
- 注4) 実験的自己免疫性脳脊髄炎(EAE)
- ミエリンオリゴ糖タンパク質など、髄鞘の主要な構成タンパク質を抗原としてマウスに投与することで、多発性硬化症に似た病状を誘導できる。投与した抗原に反応するT細胞が活性化され、やがて中枢神経組織内の髄鞘が攻撃を受け、炎症および組織損傷が起こる。多発性硬化症の動物モデルとして広く用いられている。英語表記「experimental autoimmune encephalomyelitis」の略としてEAEとも呼ばれる。
- 注5) T細胞
- リンパ球の1つ。通常、病原体などの成分を認識する受容体を持ち、特異的な免疫応答を引き起こす。自己免疫疾患の場合では、自己の成分を認識したT細胞が活性化し、異常な免疫応答が引き起こされる。
- 注6) サイトカイン
- 細胞から放出されるタンパク質であり、細胞間の情報伝達に関わる。
- 注7) アストロサイト
- 中枢神経系に存在する多数の突起を持つ非神経細胞。アストロサイトの突起からなる網目状構造の間に神経線維が配置され、中枢神経系の機能的構造維持に働く。
- 注8) ケモカイン
- サイトカインの一群であり、白血球などの細胞の移動を促すタンパク質。
<論文情報>
| タイトル |
“Inhibition of the TNF Family Cytokine RANKL Prevents Autoimmune Inflammation in the Central Nervous System” |
| 著者 |
Matteo M. Guerrini, Kazuo Okamoto, Noriko Komatsu, Shinichiro Sawa, Lynett Danks, Josef M. Penninger, Tomoki Nakashima and Hiroshi Takayanagi |
| 掲載誌 |
Immunity (オンライン版:2015年12月8日) |
| doi |
10.1016/j.immuni.2015.10.017 |
<お問い合わせ先>
<研究に関すること>
東京大学 大学院医学系研究科 病因・病理学専攻 免疫学分野
教授 高柳 広(タカヤナギ ヒロシ)
Tel:03-5841-3373 Fax:03-5841-3450
E-mail:
<JST事業に関すること>
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: