ポイント
- 血管新生では、一つ一つの血管内皮細胞が複雑な運動を行いながら、出芽・伸長・分岐・管腔形成といった二次元・三次元にわたって秩序ある血管形態をつくっていく(図1)。このしくみは、これまでの医学研究の長い歴史の中で大きな研究対象であったにも関わらず、実はいまだ十分に理解されていない。
- 生物学と数理科学・コンピュータ科学を融合させた研究により、血管の伸長を担う多細胞運動のしくみとして、細胞が自発的に自らを制御して自律的に動く過程と、隣接した細胞から適宜影響を受けて協調的に動く過程がうまく共存することで、全体の動きが巧みに統制されていることを明らかにした。
- 今回明らかにした血管新生のメカニズムは、生物の形態形成を支える共通原理になることが期待される。
熊本大学 大学院生命科学研究部 循環器内科学/熊本大学 国際先端医学研究機構の西山 功一 特任講師/主任研究員、東京大学 大学院医学系研究科 代謝生理化学の栗原 裕基 教授、杉原 圭 学部生(現東京大学附属病院 臨床研修医)らの研究グループは、血管新生注1)において血管が伸長する際の血管内皮細胞注2)運動を制御するしくみを、生物学と数理モデル注3)・コンピュータシミュレーションを融合させた先端的な研究手法により明らかにしました。
生物は、最小の機能単位である細胞が寄り集まった多細胞体です。しかし、細胞の集まりが、組織や器官といった秩序ある形態や構造をつくり機能するしくみはほとんど分かっていません。中でも血管は、体中の全組織に十分な酸素や栄養源を効率よく供給するため、組織や組織の間に入り込み、血管外の環境との相互作用により、巧妙な枝分かれ構造をとっています。これまでに本研究グループは、新しく血管がつくられる(血管新生)際の細胞の動きに着目し、特に血管内皮細胞の動きをリアルタイムで可視化し、定量的に捉えることを可能にしてきました。
今回さらに、血管の伸長を制御するしくみについて、細胞が自発的に自らを制御して動く過程(自律的過程)と、隣接した細胞から適宜影響を受けて動く過程(協調的過程)がうまく共存することで、全体の動きが巧みに統制されていることを世界に先駆けて実証しました。興味深いことに、血管内皮細胞が前後したり、お互いに追い抜きあったりという血管新生で見られる複雑な細胞集団の動きを制御している中枢部分は、細胞一つ一つの動き(スピードと方向性)の「確率的な変化」として十分説明できることをコンピュータシミュレーションで実証しました。対して、血管の伸長に重要な先端細胞注4)の動きは、一つ一つの細胞の確率的な動きのみでは十分説明できず、後続の茎細胞注5)との相互作用により、より厳密に制御されていることも新しく分かってきました。
本研究の成果は、血管の形態形成のみならず、さまざまな組織の形態形成における多細胞運動を支える共通原理として広く普及することが期待されます。
本研究成果は、科学雑誌「Cell Reports」オンライン版で米国時間の2015年11月19日(木)正午(日本時間の11月20日(金)午前2時)に公開されます。
本研究は、主に文部科学省 科学研究費補助金 新学術領域研究「動く細胞と場のクロストークによる秩序の生成」、科学技術振興機構 戦略的創造研究推進事業(CREST)「生命動態の理解と制御のための基盤技術の創出」、文部科学省 グローバルCOEプログラム「生体シグナルを基盤とする統合生命学」、文部科学省 生命動態システム科学推進拠点事業「転写の機構解明のための動態システム生物医学数理解析拠点」の支援を受けて行われました。また、東京大学、熊本大学、国立循環器病研究センター、名古屋市立大学、広島大学、ドレスデン工科大学との共同で行ったものです。
<説明>
生物の体の中には、さまざまな組織・器官といった形態・構造が存在します。器官や組織は、生物の最小の機能単位である細胞が、たくさん集まった多細胞体です。しかし、細胞が集まることで組織や器官といった秩序ある形態が何度も同じ様につくりだされる巧妙なしくみはほとんど分かっていません。近年、形態形成を多細胞運動(形態形成運動と呼ばれる)の切り口で理解しようとする研究が数多くなされてきました。
血管新生は、新たな血管のネットワークをつくる重要な形態形成現象の1つです。血管内皮細胞が他の細胞と協働して、出芽・伸長・分岐・管腔形成などのイベントを繰り返しながら、二次元・三次元の枝分かれ構造といった血管に特徴的なかたちをつくっていきます(図1)。そこでは、VEGF注6)を始めとした種々の分子が作用していますが、最近、当該研究グループはVEGFに反応して血管新生を進める多細胞運動を視覚化して捉えることを可能にしました。
血管新生に必要な細胞を含む組織を適切な条件下で3次元的に培養すると、血管様の構造が構築されます。この血管内皮細胞の動きを可視化し、その動きをコンピュータ上で定量化して解析したところ、従来の定説のように、先端細胞が枝の伸長を先導し茎細胞がそれに後続するという静的な現象ではなく、極めて動的でかつ複雑な多細胞運動として捉えられることが分かってきました。先端細胞やそれに続く後続の茎細胞は、さまざまなスピードや方向性で動いて、追いつき追い越しあい、次々とお互いの位置関係を入れ替えながらも、全体として秩序ある血管の形態がつくられています。同様の現象は、生体内でも確認されています(図2)。
それでは、この複雑な内皮細胞運動はどのように制御されているのでしょうか。本研究において、生物学と数理モデル・コンピュータシミュレーションを融合させた研究手法で検討しました。この手法は多細胞体の複雑な現象を支えるしくみを体系的に理解するのに有用です。しかし、これまでに報告されている数理モデルの中で、観察された血管新生の細胞動態を十分に反映させうるものは乏しいというのが現状でした。そこで、実験データに基づいた独自の数理モデルを構築することから研究を開始しました。
まず、血管が伸長する時の内皮細胞の動きを、エージェント・ベースドモデル注7)とそれに対応する連続モデル注8)として数理モデル化しました。興味深いことに、一つ一つの細胞の動くスピードと方向性が確率的に変化するという非常に単純な細胞自律的なしくみだけで、血管の伸長の程度とその時の内皮細胞全体の動きがほぼ再現できることが分かりました。つまり、血管伸長を行う内皮細胞の動きのしくみの根幹として、細胞が自発的に自らを制御しながら動く自律的な過程が存在することを実証したと言えます(図3)。
一方で、この数理モデルでは、先端細胞の動きを完全には再現できないことも分かってきました。そこで、数理モデルの中に先端細胞と後続の茎細胞との距離が離れると先端細胞の動きが遅くなる、という新たな規則を追加したところ、実験結果とシミュレーション結果の乖離が改善されました。最終的に、数理モデルに新たに組み込んだしくみが、実際の生物現象としてあり得るのかを実験的に確かめました。ゼブラフィッシュ胚注9)の血管新生の際に、レーザー焼灼手法注10)を使って人工的に先端細胞と後続の茎細胞との距離を広げる操作をすると、先端細胞の前向きの動きが生じなくなることが分かりました。つまり、数理モデルで予測したしくみが生体内で実際に生じていることが示されました。これらの結果から、先端細胞の動きには、自発的に生じる細胞の確率的な挙動に加えて、後続の茎細胞との相互作用により厳密に制御されている新たなしくみが関わっていることが解明されました(図3)。先端細胞が後続の茎細胞と十分に接していることが、先端細胞が前向きに動くために重要な因子であると考えられます。
以上、本研究によって、血管の伸長を担う複雑な多細胞運動を制御するしくみとして、細胞が自発的に自らを制御して自律的に動く過程と、隣接した細胞から適宜影響を受けて協調的に動く過程がうまく共存することで、全体の動きが巧みに統制されていることを、世界に先駆けて明らかにすることに成功しました。生物に存在するさまざまな多細胞運動現象では、それを構成する個々の細胞の自律的なふるまいが、細胞同士のコミュニケーションによって巧みに調整されることで、全体としての調和が成立していると想定されます。本研究の結果は、このような生物に存在する根本的なしくみを、生物学と数理モデル・コンピュータシミュレーションを融合させた先端的研究手法を使うことで、形態形成運動の視点から実証したものです。本研究は今後、血管の形態形成のみならずさまざまな形態形成の場における多細胞運動のしくみの理解に、さらに、生物の成立ちの根本的なしくみを理解するために広く貢献することが期待されます。
<参考図>
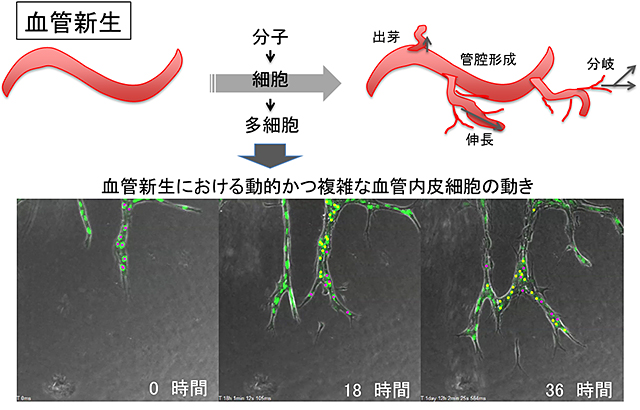
図1 血管新生の内皮細胞動態
血管新生において、血管内皮細胞は集団として複雑に動きながら枝分かれ形態をつくっていることが分かってきた。しかし、多細胞運動を制御しているしくみはよく分かっていない。(下段)血管新生を模す3次元組織培養。緑は内皮細胞核、黄、赤は人工的マーキングによる細胞の追尾。
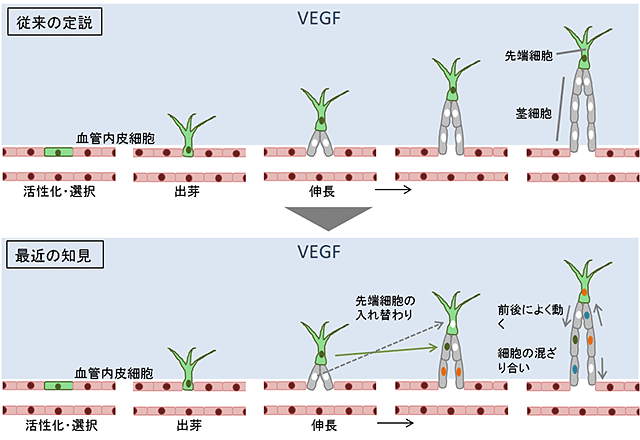
図2 血管新生における血管内皮細胞動態の従来の理解と最近の知見
- 従来の定説: 虚血組織などからの血管新生促進因子(VEGFなど)により刺激を受けて、内皮細胞の活性化・先端細胞の選択が起こる。先端細胞は、後続の茎細胞を先導する形で血管の成長(伸長)を進める。
- 最近の知見: 内皮細胞の動きが直接捉えられるようになり、先端細胞は頻繁に入れ替わっていること、茎細胞も含めて一つ一つの細胞は速く動いたりゆっくり動いたり、また、前に後ろに動いたりと、かなり動的で複雑な現象であることが分かってきた。
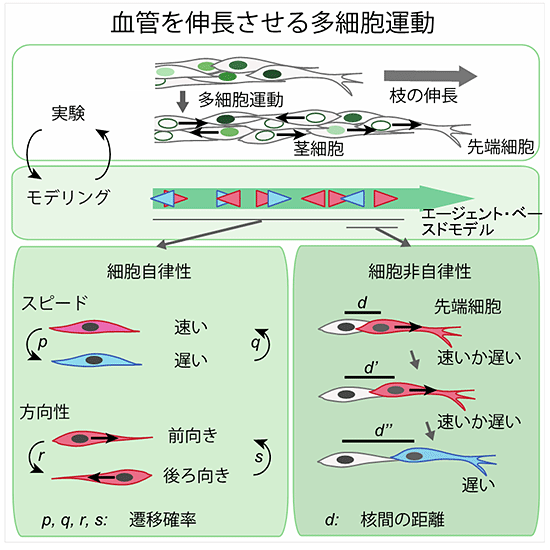
図3 実験と数理モデリングによる血管を伸長させる内皮細胞運動の理解
- 1) 細胞一つ一つの動き(スピードと方向性)を確率的に制御するという単純な規則のみで、枝の伸長の際の内皮細胞運動の基本的な性質が再現された。
- 2) 先端の細胞と後続の細胞の核間の距離が離れると、先端細胞の前向きの動きが緩徐になることが分かった。
<用語解説>
- 注1) 血管新生
- 血管が新しくつくられる様式。既に存在する血管から伸び出るように血管が増生する。個体がつくられる発生時期とともに、発生後も炎症、虚血性心臓病、腫瘍などさまざまな病態で生じ重要な治療標的とも考えられている。
- 注2) 血管内皮細胞
- 血管の内腔の一面を覆っている、血管を構成する主要な細胞の1つ。この細胞のみで血管の構造をつくることができる。
- 注3) 数理モデル
- 現実の世界のさまざまな現象を、その本質的な理解のために方程式などで数学的に記述したもの。
- 注4) 先端細胞
- 新生される血管の先端に位置する細胞のこと。他の細胞とは違う特徴的な細胞形状を示し、これまでは特別な細胞であろうと想定されていた(図2)。
- 注5) 茎細胞
- 血管新生の際において、先端細胞に続いて存在する血管内皮細胞のこと(図2)。
- 注6) VEGF
- 血管内皮細胞増殖因子Vascular endothelial growth factor。主要な血管新生の促進因子の1つ。細胞増殖、遊走、分化、そして血管の透過性などを促進する。
- 注7) エージェント・ベースドモデル
- コンピュータによるモデルの1つ。自律的なエージェント(ここでは血管内皮細胞)のふるまいやエージェント同士の相互作用が、システム全体に与える影響を試験するモデル。
- 注8) 連続モデル
- エージェント・ベースドモデルなどのように、連続している情報を時間などで区切って扱うモデル(離散モデル)に対して、微分方程式のように連続した情報として扱うモデル。
- 注9) ゼブラフィッシュ胚
- 胚発生期において透明度がかなり高いため、生命現象(特に発生現象)を可視化して観察する良い対象となっている。
- 注10) レーザー焼灼手法
- レーザー光を組織に照射し、その熱作用により組織を変性させる(焼く)手法。さまざまな医療の場で治療に応用されてきている。ここでは、後続細胞をレーザー焼灼することで細胞死を誘導した。
<論文情報>
| タイトル |
“Autonomy and Non-autonomy of Angiogenic Cell Movements Revealed by Experiment-Driven Mathematical Modeling” |
| 著者名 |
Kei Sugihara*, Koichi Nishiyama*,**, Shigetomo Fukuhara, Akiyoshi Uemura, Satoshi Arima, Ryo Kobayashi, Alvaro Köhn-Luque, Naoki Mochizuki, Toshio Suda, Hisao Ogawa and Hiroki Kurihara(*筆頭著者、**責任著者) |
| 雑誌名 |
Cell Reports |
| doi |
10.1016/j.celrep.2015.10.051 |
<お問い合わせ先>
<研究に関すること>
西山 功一
熊本大学 大学院生命科学研究部 循環器内科学/熊本大学 国際先端医学研究機構 特任講師/主任研究員
Tel:096-373-6876
E-mail:
栗原 裕基
東京大学 大学院医学系研究科 代謝生理化学 教授
杉原 圭
東京大学 大学院医学系研究科 代謝生理化学 元学部生(東京大学 医学部附属病院 臨床研修医)
Tel:03-5841-3498
E-mail:
<JST事業に関すること>
川口 哲
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: