ポイント
- ヒト培養細胞内で、環状mRNAを鋳型としたたんぱく質の大量合成に成功した。
- 環状mRNAはたんぱく質合成のためにキャップ構造やポリA鎖を必要としない。
- たんぱく質の新しい大量合成法として、産業・医療応用が期待される。
JST 戦略的創造研究推進事業において、名古屋大学 大学院理学研究科の阿部 洋 教授(理化学研究所 伊藤ナノ医工学研究室 客員主管研究員)、阿部 奈保子 博士研究員らは、ヒト培養細胞内で環状mRNA注1)から終わりのないたんぱく質合成が起きることを見いだしました。
産業や医療への利用を視野に、真核生物注2)においてたんぱく質を大量合成する技術の開発が望まれていました。しかし原核生物注2)とは異なり、真核生物のたんぱく質合成系は複雑な構成要素からなるため、いまだにそのメカニズムは完全には明らかになっていません。真核生物のたんぱく質合成系で鋳型となるmRNAは通常は線状(直鎖型)で、その末端には特別な構造(キャップ構造やポリA鎖注3))を持ち、この構造が目印となり、たんぱく質合成反応が開始の目印(開始コドン注4))から終了の目印(終止コドン注4))まで起こります。
阿部教授らは、mRNAからキャップ構造やポリA鎖を除き、さらに終止コドンを除いた環状mRNAを合成しました。それをヒト培養細胞内に導入したところ、環状の鋳型に沿って終わりなく続く回転式たんぱく質合成反応が起こり、たんぱく質を大量に合成できました。以前の研究で原核生物においても同様な現象が見られることから、本現象はたんぱく質合成反応における普遍的なものであることが示されました。本手法は、たんぱく質の大量生産法としての産業応用や、安全性の高いたんぱく質補充療法注5)として医療応用されることが期待されます。
本研究成果は、2015年11月10日(英国時間)に英国科学誌「Scientific Reports」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「脳神経回路の形成・動作と制御」
(研究総括:村上 富士夫 大阪大学 大学院生命機能研究科 特任教授) |
| 研究課題名 |
「シナプス可塑性に関わるRNA群の革新的イメージング法の開発」 |
| 研究者 |
阿部 洋(名古屋大学 大学院理学研究科 教授) |
| 研究期間 |
平成23年10月~平成27年3月 |
<研究の背景と経緯>
たんぱく質合成は、リボソーム注6)と呼ばれるたんぱく質の複合体が、鋳型であるmRNA上を移動し、アミノ酸をつないでいく反応です。自然界では通常、線状(直鎖状)のRNAが鋳型に用いられ、たんぱく質合成反応は開始コドンに始まり終止コドンに終わります。
2013年に阿部教授らは、原核生物である大腸菌のたんぱく質合成系において、終止コドンを除いた環状mRNAを鋳型として用いたたんぱく質合成反応について検討しました(図1)。その結果、通常の直鎖状mRNAと比較し、環状mRNAからは大量のたんぱく質を合成できることを明らかにしました(参考文献)。
この結果は以下のような原理に基づくと考えられます。通常のたんぱく質合成反応は、開始、伸長、終止の3つの段階に大きく分けられます。直鎖状mRNAを鋳型とするたんぱく質合成反応では、反応1回ごとにリボソームが鋳型へ結合、解離を行います(図2)。しかし環状mRNAを鋳型とする場合には、終止コドンを除けば、リボソームが一度結合してたんぱく質合成が開始すると、RNA配列に終わりがないため、永久に反応が続くと予想されます。
また、たんぱく質合成反応で最も時間のかかる段階(律速段階)は、多数のたんぱく質やリボソームが集合し翻訳開始複合体を形成する開始段階にあると考えられています(図3)。しかし、環状mRNAを鋳型に用いた場合、律速となる開始段階は最初の一度のみで、それ以降は伸長反応が効率よく進行します。そのため、「終わりのない回転式たんぱく質合成反応」は高効率なたんぱく質合成法となる可能性を秘めていました。
<研究の内容>
原核生物での結果を受け、本研究では真核生物においても同じ現象が起こるかを検討しました。真核生物におけるたんぱく質合成のメカニズムは原核生物よりはるかに複雑で、その分子メカニズムの詳細はいまだに明らかになっていません。
真核生物では、原核生物と異なりmRNAの5’末端にキャップ構造が、3’末端にポリA鎖があります(図3)。直鎖状mRNAを鋳型としたたんぱく質合成反応の開始では、さまざまなたんぱく質がキャップ構造およびポリA鎖に結合し、これらのたんぱく質同士が相互作用することで、RNAが環状構造を取ります。この構造をリボソームが認識し結合することで、開始コドンからたんぱく質合成反応が開始すると考えられています。この複合体形成が反応開始に必要なことから、真核生物では鋳型となるmRNAには末端が必要であると理解されています。一般に、末端からではなくRNAの途中からたんぱく質合成が起こる場合には、配列内リボソーム進入部位(IRES)注7)と呼ばれる特殊なRNA領域が必要と考えられていました。
阿部教授らはキャップ構造、ポリA鎖やIRES配列を持たずに、かつ開始コドンを持ち、終止コドンを持たない環状mRNAを設計しました(図4a)。これは大腸菌のたんぱく質合成系で用いた「終わりのない回転式たんぱく質合成反応」と同じ設計指針です。この環状mRNAが真核生物たんぱく質合成系の鋳型として働くかを検討しました。
まず始めに、8アミノ酸配列からなるFLAGペプチド注8)の鋳型配列を複数個含む環状mRNAを設計・合成しました(図4a)。コザック配列注9)およびFLAG鋳型配列からなる長さの異なる3つの環状mRNA(129、258、387ヌクレオチド長)を合成し、ウサギ赤血球由来の無細胞たんぱく質合成系におけるたんぱく質合成反応を解析しました。その結果、直鎖状mRNAでは短いたんぱく質の合成が確認されたのに対し、環状mRNAでは長いたんぱく質の合成が確認されました。このとき、3つの長さの異なる環状mRNAのうち、FLAG鋳型配列を8つ含む258ヌクレオチド長の環状mRNA(8xFLAG環状RNA)で最も合成産物が多く生じました(図4b)。そこで、次に、この8xFLAG環状RNAをヒト培養細胞であるHeLa細胞注10)に導入し、生きた細胞内でたんぱく質が合成されるかどうかを検討しました(図5)。その結果、生きたHeLa細胞内においても環状mRNAからは長いたんぱく質が合成されること、また直鎖状mRNAに比較し大量のたんぱく質が合成されることが分かりました。
続いて、異なる配列を持つ数種類の環状mRNAを合成し、その配列がたんぱく質合成反応に及ぼす影響を調べました。その結果、RNA配列が高次構造を生じにくいと考えられる配列ほど回転式たんぱく質合成反応の産物を多く生じました。また、終止コドンを含む環状mRNAからは翻訳産物が検出されませんでした。最適なコザック配列を持つ環状mRNAは、弱いコザック配列を持つ環状mRNAよりも産物が多く生じました。
以上の結果は、合成した環状mRNAでは鋳型配列の終わりがないために、大量のたんぱく質が合成されたことを示します。真核細胞のシステムでは環状mRNA上における合成開始反応は通常起こりにくいと考えられますが、一度開始されれば無限に続く鋳型配列に沿って反応が続き、その結果大量のたんぱく質を合成できます。また、環状mRNAは直鎖状mRNAと比較して生体内で分解されにくいことが知られています。この特性も長期的なたんぱく質合成に有利に作用します。「終わりのない回転式たんぱく質合成」は、原核生物および真核生物に普遍的な現象であることが示されました。
<今後の展開>
今回の研究により、終止コドンを持たない環状mRNAをヒト培養細胞内に導入することで、終わりのない回転式たんぱく質合成反応が起こり、高い効率でたんぱく質が合成できることを示しました。本手法は、真核生物のたんぱく質合成開始のメカニズムの解明に役立ちます。また、コラーゲンや蜘蛛の糸などの反復配列があるたんぱく質を大量合成して医療材料としたり、遺伝子治療に代わって生体内で安全にたんぱく質を合成させる手法として、産業および医療応用されることが期待されます。さらに、終わりのない回転式たんぱく質合成分子はシグナル増幅反応として利用することが可能です。例えば、蛍光シグナルを増幅することで神経細胞における微量RNAのイメージングに応用されることが期待されます。
<参考図>
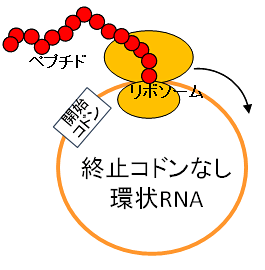
図1 環状RNAを用いた終わりのない回転式たんぱく質合成現象
終止コドンがなく連続的な鋳型配列を持つ環状RNAを鋳型にしたとき、リボソームはいったん反応を開始すると、永久にたんぱく質を合成し続ける。反復配列を持つ非常に大きなたんぱく質が合成される。
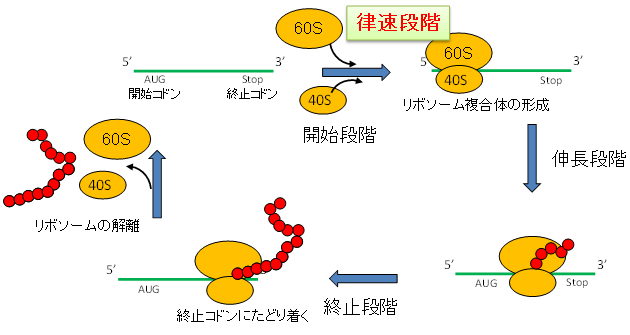
図2 線状mRNAを鋳型とする通常のたんぱく質合成反応
リボソームは、mRNAの5’末端を認識した後、開始コドン上でリボソーム複合体を形成する。この段階が反応中で最も時間がかかる律速段階と考えられている。続いてコドンに従がってたんぱく質合成を進めていく。終止コドンに到達すると、リボソームは解離し、次の反応に向かう。
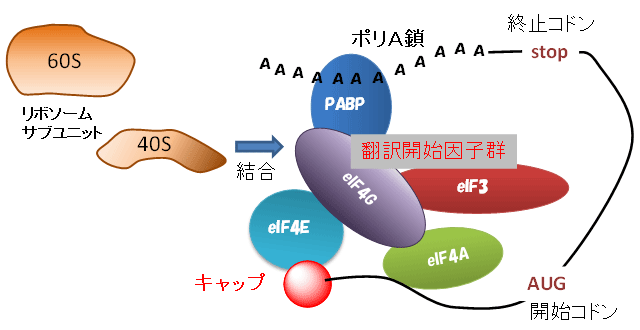
図3 キャップ構造とポリA鎖を両端に持つ線状mRNAにおける翻訳開始複合体形成の模式図
ポリA結合性たんぱく質(Poly(A)-binding protein、PABP)や種々の真核生物型翻訳開始因子(eukaryotic Initiation Factor:eIF)が相互作用をして、mRNAの5’末端で複合体を形成する。
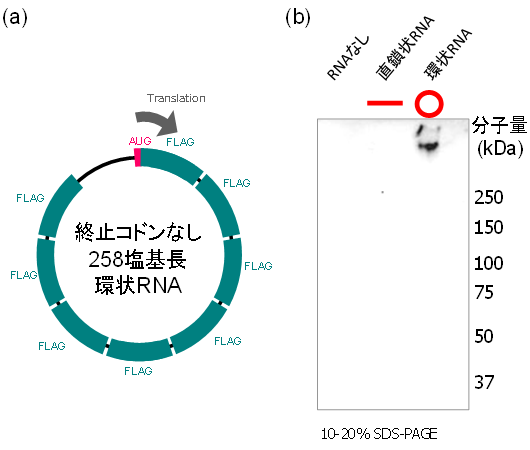
図4 258塩基長の環状RNAデザインとウェスタンブロット解析
(a)FLAG鋳型配列を8個含む258塩基長の環状RNA(8×FLAG環状RNA)の模式図(b)ヒト由来HeLa細胞に導入し合成産物を検出した(抗FLAG抗体を用いて検出した結果)。環状RNAを細胞内に導入した場合にのみ、高分子量領域にバンドが検出された。ウェスタンブロット解析は、電気泳動によって分離したたんぱく質を膜に転写し、目的とするたんぱく質に対する抗体を用いて、そのたんぱく質を検出する解析方法である。
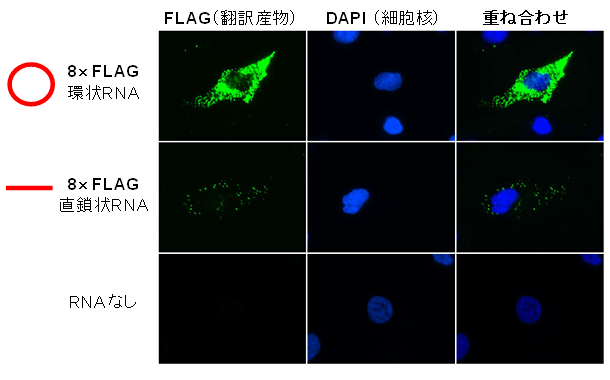
図5 たんぱく質翻訳産物の蛍光イメージング
環状RNA(8×FLAG環状RNA)をヒト由来HeLa細胞に導入後、細胞内における合成産物を検出した(抗FLAG抗体を用いた免疫染色の顕微鏡観察結果)。線状(直鎖状)RNAを導入した場合と比較し、環状RNAを導入した場合により強い染色が観察された。
<用語解説>
- 注1) 環状mRNA
- 線状(直鎖状)RNAの末端同士が共有結合し環状になったmRNA。近年、生体内にも環状mRNAが存在していることが明らかになり、その機能や生成メカニズムに注目が集まっている。
- 注2) 真核生物、原核生物
- 真核生物とは、動物、植物、菌類、原生生物など、身体を構成する細胞の中に細胞核と呼ばれる細胞小器官を持つ生物。原核生物とは、核膜を持たず、従がって明確な輪郭を持った細胞核の見られない細胞からなる生物(真正細菌および古細菌)のこと。
- 注3) キャップ構造、ポリA鎖
- 真核生物のmRNAが5’末端と3’末端にそれぞれ持つ構造のこと。キャップ構造とは、5’末端塩基の三リン酸にメチルGTPが5’−5’向きに結合したもので、RNAの5’末端の保護や翻訳を補助する働きを持つ。ポリA鎖とはRNAの3’末端にアデニン塩基が連なったもので、mRNAを細胞質での分解から保護し、転写終結、核外輸送、翻訳を補助する働きを持つ。
- 注4) 開始コドン、終止コドン
- 遺伝暗号は3塩基の配列を1組としたコドンによってアミノ酸を指定する。64種類あるコドンのうち、開始コドンと呼ばれるAUGからmRNAの翻訳が開始され、終止コドンと呼ばれるUAG、UGA、UAAによって翻訳が停止する。開始コドン(AUG)はアミノ酸の1つであるメチオニンをコードするが、終止コドン(UAG、UGA、UAA)はアミノ酸をコードしていない。
- 注5) たんぱく質補充療法
- その不足が病気・症状の原因となっているたんぱく質(酵素など)を外部から補うことで改善を図る治療法。
- 注6) リボソーム
- mRNA上を移動し、mRNAの配列情報を読み取ってたんぱく質を合成する場。たんぱく質(リボソームたんぱく質)とRNA(リボソームRNA)から構成されている。
- 注7) 配列内リボソーム進入部位(internal ribosome entry site:IRES)
- mRNA内部のリボソーム進入サイト。主にウイルス由来のRNA配列で複雑な二次構造を形成し、リボソーム結合性を持つ。IRESのすぐ下流からの翻訳反応開始を促進する。
- 注8) FLAGペプチド
- 8つのアミノ酸、Asp(アスパラギン酸)-Tyr(チロシン)-Lys(リシン)-Asp-Asp-Asp-Asp-Lysからなるペプチド。結合親和性が高い抗体を用いてたんぱく質の標識や精製のための指標に使用される。
- 注9) コザック配列
- 真核生物のmRNAに見られる共通配列で、開始コドンおよびそれに隣接するヌクレオチド配列。たんぱく質合成反応の開始に関与することが知られている。
- 注10) HeLa細胞
- 試験管内で細胞を用いる試験や研究に幅広く用いられている、ヒト由来の細胞株。子宮頸がんの腫瘍病変から分離され株化されたもの。
<論文タイトル>
“Rolling Circle Translation of Circular RNA in Living Human Cells”
(ヒト生細胞内における環状RNAのローリングサークル翻訳反応)
Abe, N., Matsumoto, K., Nishihara, M., Nakano, Y., Shibata, A., Maruyama, H., Shuto, S., Matsuda, A., Yoshida, M., Ito, Y. and Abe, H.
doi :10.1038/srep16435
<参考文献>
“Rolling Circle Amplification in a Prokaryotic Translation System Using Small Circular RNA”
(小さな環状RNAを利用した原核生物翻訳系におけるローリングサークル増幅反応)
Abe, N., Hiroshima, M., Maruyama, H., Nakashima, Y., Nakano, Y., Matsuda, A., Sako, Y., Ito, Y. and Abe, H. Angew. Chem. Int. Ed. 2013, 52, 2004
doi :10.1002/anie.201302044
<お問い合わせ先>
<研究に関すること>
阿部 洋(アベ ヒロシ)
名古屋大学 大学院理学研究科 物質理学専攻 生物化学研究室 教授
〒464-8602 愛知県名古屋市千種区不老町
Tel:052-789-2490 Fax:052-789-2947
E-mail:
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
名古屋大学 総務部 広報渉外課
〒464-8601 愛知県名古屋市千種区不老町
Tel:052-789-2699 Fax:052-788-6272
E-mail:
理化学研究所 広報室 報道担当
〒351-0198 埼玉県和光市広沢2-1
Tel:048-467-9272 Fax:048-462-4715
E-mail: