ポイント
- 抗体を用いる独自の結晶化技術により、ヒト・哺乳類において糖分子を細胞内に輸送する膜たんぱく質の立体構造を解明した。
- 膜たんぱく質が柔軟に立体構造を変化させて、特定の糖分子を選択的に細胞内に取り込む仕組みが分かった。
- 肥満やがんを抑制する薬剤の分子設計などにつながる基盤情報が得られた。
京都大学 大学院医学研究科 野村 紀通 助教、岩田 想 教授らは、ヒト・哺乳類において細胞内に果糖を選択的に輸送するGLUT5(グルットファイブ)注1)という膜たんぱく質の立体構造を解析し、GLUT5が細胞膜において細胞の外側に向けて開いた状態(以下、「外開き」)と内側に向けて開いた状態(以下、「内開き」)の2つの立体構造を介して果糖を細胞内に輸送していることを明らかにしました。
ブドウ糖や果糖などの糖分子は生命維持に必須ですが、食物中の糖分子は糖輸送体という膜たんぱく質を介して、細胞内に取り込まれてエネルギーなどへ変換されます。この糖輸送体のうち、促進拡散によって糖分子を輸送する膜たんぱく質(GLUT)は、肥満や糖尿病だけでなく、がんの細胞増殖制御にも関与していることが知られています。
本研究グループでは、抗体フラグメント注2)を結晶化の促進因子として用いる独自技術により、ヒトのGLUT5とよく似ているラットのGLUT5を結晶化することに成功し、その立体構造を原子レベルで解明しました。得られた立体構造は、GLUT5が外開きの状態であり、細胞の外からの果糖の流入・結合を待ち受けている構造と考えられます。また、ウシのGLUT5を結晶化し、立体構造を解明することにも成功しました。この立体構造は内開きの状態で、GLUT5が細胞内に果糖を放出して輸送を終えた瞬間の構造と考えられます。さらに、これらの立体構造を比較したところ、GLUT5を構成する2つの大きな部位が開閉するだけでなく、それらの部位の内部でも局所的な構造変化が起こることで、一度結合した果糖を細胞外に逃さずに効率良く細胞内に送り込むためのゲートが形成されることが明らかになりました。
これらの立体構造の情報は、GLUT5の輸送活性を阻害するための薬剤の分子設計に重要な指針を与えるものであり、今後、肥満や生活習慣病の予防・治療薬やがん細胞のマーカーなどの開発につながることが期待されます。
今回の研究開発は、JST 戦略的創造研究推進事業による支援を受けています。また、本研究はスウェーデン王国・ストックホルム大学のDavid Drew(デイビット ドリュー)博士らとの国際共同研究チームで行ったものです。本研究成果は、2015年9月30日(英国時間)に英国科学誌「Nature」のオンライン速報版で公開されます。
<研究の背景と経緯>
清涼飲料水や菓子類、加工食品、ファーストフード、化学調味料などに多く含まれる果糖(フルクトース)の過剰摂取は、肥満・メタボリックシンドローム(内臓脂肪症候群)や脂肪肝など多くの生活習慣病につながる隠れた危険因子です。このことは高果糖のコーンシロップ(高果糖ブドウ糖液糖)を大量に消費する米国ではすでに大きな問題になっており、果糖の摂り過ぎの注意を促す臨床研究が相次いで報告されています。
生体内に果糖が取り込まれる際の関門になっているのが、GLUT5という膜たんぱく質です。GLUT5は腸管上皮細胞の頭頂面に局在し、摂取した食物から果糖を選択的に吸収する働きを持っています。また、最近の研究結果から、GLUT5は乳がん細胞で過剰発現していることも明らかになり、がん細胞の増殖に深く関与することも知られています。GLUT5を含むGLUTの分子機構(動く仕組み)や基質認識の特異性を明らかにすることにより、細胞内の糖濃度の調節、ひいては糖尿病、生活習慣病やがんの予防・改善に役立つ新たな知見が得られると期待されており、その基盤情報となる立体構造の解析が望まれています。
20年以上にわたり世界中の多数の研究グループがGLUTの立体構造解析に挑戦し、昨年、初めてブドウ糖(グルコース)を選択的に輸送するヒトGLUT1の内開き状態の立体構造が解明されました。しかし、たった1つの立体構造からでは、GLUTがどのように糖分子と結合し細胞内に糖分子を輸送させるのか、糖分子を輸送するためにGLUTがどのように構造を変化させるのかという仕組みは明らかにできませんでした。
本研究グループでは、ヒトのGLUT5とほぼ同じ配列を持つ哺乳類GLUT5の立体構造解析に平成19年度から取り組んできましたが、哺乳類の膜たんぱく質の立体構造解析は結晶化が非常に難しく、解析に成功していませんでした。しかし本研究グループは5年前に、抗体フラグメント(Fv)を膜たんぱく質の結晶化を促進する因子として用いる独自技術を開発することに成功し、GLUT5の結晶化およびX線構造解析に成功しました。
<研究の内容>
本研究グループは、JST 戦略的創造研究推進事業 ERATO「岩田ヒト膜受容体構造プロジェクト」(平成17~22年度)にて開発した抗体を用いた結晶化促進技術により、ラットのGLUT5と抗体フラグメントの複合体の結晶化に成功し、立体構造を原子レベルで解明しました。得られた立体構造は、GLUT5が細胞外側に向けて開いた状態(以下、「外開き」)であり、細胞外からの果糖の流入・結合を待ち受けている、糖分子の輸送直前の瞬間の構造と考えられます(図1a)。また、変異導入注3)により細胞の内側に向けて開いた状態(以下、「内開き」)で安定化したウシのGLUT5の結晶化にも成功し、その立体構造も原子レベルで解明しました。この立体構造は、GLUT5が細胞内に果糖分子を輸送し終えた瞬間の構造と考えられます(図1b)。昨年解明されたヒトGLUT1の立体構造とこれらの構造を比較したところ、ラットのGLUT5の外開き状態の構造は新規の知見であることが明らかになりました。
今回解析したGLUT5の立体構造は、細胞膜を貫通する6本のヘリックス注4)の束が2組、V字型のように配置されて、基質分子の透過経路となる深く大きな「空洞」を形成していました。基質である果糖は結合していませんでしたが、この空洞の最深部に露出しているアミノ酸残基注5)を生化学実験により詳しく調べたところ、GLUT5の基質である果糖が結合する部位が明らかになりました。また、この部位にあるアミノ酸残基を1つ変更することで、GLUT5が果糖ではなく、ヒトのGLUT1のようにブドウ糖に結合しやすくなることが分かりました。これらの結果は、空洞の最深部周辺のアミノ酸残基が、結合する糖の種類を決める役割を担っていることを示しています。
さらに、外開き状態と内開き状態のGLUT5立体構造を重ね合わせて比較したところ、2組の膜貫通ヘリックスの束が大規模に動いて輸送経路の「空洞」を外開きから内開きに変換する仕組みがあること、それに加えていくつかのヘリックスでは局所的に構造が変化し、いったん結合した果糖を細胞外に逃さず効率的に細胞内に送り込むために、2つの「ゲート」が形成される仕組みが明らかになりました(図2)。また、外開き状態の構造ではV字型の全体構造の根元部分に複数の塩橋注6)が形成されているのに対し、内開き状態の構造ではこれらの塩橋が切断されていました。この塩橋の形成に関与しているアミノ酸残基を変えると、果糖のGLUT5への結合が弱まることから、この塩橋は外開き状態の構造を安定化させるだけでなく、果糖の結合にも重要な役割を担っていることが示唆されました。
これらの立体構造の詳細な分析と生化学的な実験結果から、GLUT5は果糖を細胞内に取り入れるために、果糖を輸送するための空洞を外開きから内開きへと単純に開閉するロッカースイッチ機構注7)ではなく、果糖が結合しやすいように細胞の外側ゲートが開いた状態を維持し、果糖が結合したらそのゲートを閉じ、局所的な構造を変化させた後に細胞の内側ゲートを開けて果糖を細胞内に放出する「ゲートポア機構」を持っていると考えられます(図3、動画)。親水性の低分子化合物を受動的に輸送する、促進拡散型の膜たんぱく質は、GLUT5と同じような機構により細胞外の分子を細胞内に輸送している可能性が示唆されます。
<今後の展開>
GLUT5において果糖が結合する部位の立体構造情報と、果糖を輸送する仕組みが明らかになったことで、GLUT5の輸送活性を阻害する、あるいは調節できる薬剤の探索や分子設計が可能になると考えられます。また、今回明らかになった立体構造をもとに、基質輸送に伴う輸送体の構造変化を計算機上でシミュレーションおよび再現することにより、輸送体の機能や分子機構をより深く理解できるようになると考えられます。本研究グループが開発した抗体フラグメント作製技術により、これまで立体構造解析が難しかった多くの膜たんぱく質の結晶化および構造解析をより迅速に実施できるものと期待されます。
<参考図>
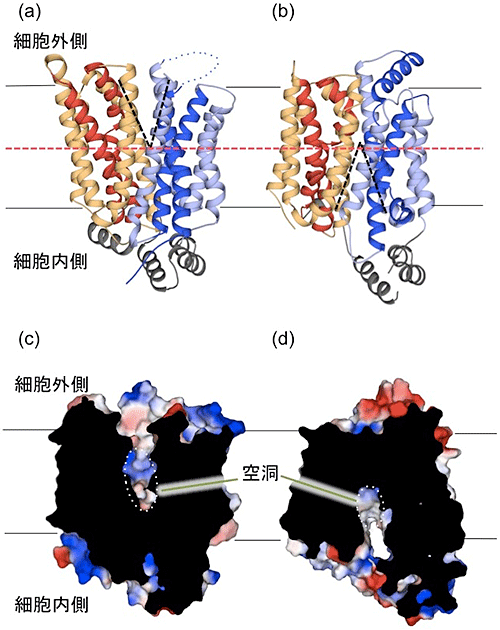
図1 GLUT5の立体構造
- (a) 外開き状態と(b)内開き状態のGLUT5の全体構造(リボン図)。6本の膜貫通ヘリックスの束(赤色、橙色、濃青色、淡青色のリボン)が2つ組み合わさってV字の「空洞」(黒色破線)を形成している。外開き状態も内開き状態も細胞膜の中間地点(赤色破線)までしか開かないことが分かる。
- (c) 外開き状態と(d)内開き状態のGLUT5の果糖を輸送する経路の空洞。細胞に垂直な面で切断した切断面から、外開き状態では果糖が結合しやすいように大きな親水性(青色)の空洞が細胞外側に向けて大きく開いているのに対して、内開き状態では果糖が細胞内に放出されやすいように空洞が細胞内側に向けて大きく開いている。
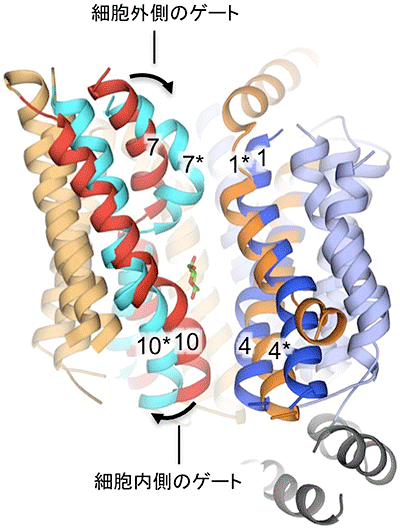
図2 外開き状態と内開き状態のGLUT5の立体構造の比較
外開き状態での各ヘリックスの位置(1、7、4、10)と、内開き状態での各ヘリックスの位置(1*、7*、4*、10*)が異なることが分かる。外開き状態から内開き状態に移行するときに、ヘリックス7の上半分とヘリックス10の下半分が局所的に構造変化を起こして、細胞外側ゲートと細胞内側ゲートを形成するのに大きく寄与することが示唆される。中央に示した低分子化合物は果糖で、生化学実験から予想される結合部位の位置を表している。
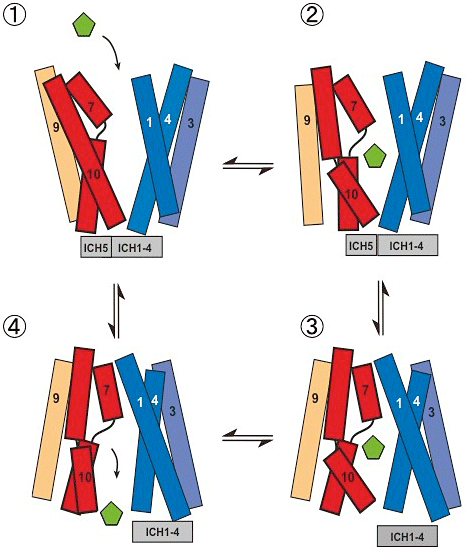
図3 基質輸送に伴うGLUT5の構造変化モデル
- ① 果糖(五角形、緑色)が結合しやすい外開き状態の構造は、2組のヘリックスの束の下端部分に形成される複数の塩橋により安定化されている。また、細胞内のへリックス(ICH1-4、ICH5)もまとまっている。
- ② 果糖が結合することによって、へリックス7の上半分とへリックス10の下半分が動いて果糖を取り囲む。このとき、へリックス4とへリックス10の下端は近い位置にあり細胞内側のゲートが形成されている。
- ③ 2組のヘリックスの束が剛体回転により大きく動いた結果、へリックス1とへリックス7の上端が近づいて細胞の外側のゲートが形成され、果糖が細胞外に散逸しない状態になる。その際に細胞内へリックス(ICH5)は、ICH1-4のまとまりから離れた位置に大きく動く。
- ④ へリックス10の下半分が動いて細胞内側ゲートが開く。その結果、果糖が細胞の内側に放出される。このような輸送の仕組みを「ゲートポア機構」という。<動画>
<用語解説>
- 注1) GLUT5(グルットファイブ)
- ヒト・哺乳類細胞における細胞膜を介した糖分子の輸送は、ナトリウムイオン(Na+)-ブドウ糖共輸送体(SGLT)による能動的な輸送と、Na+に依存しない促進拡散による糖輸送体(GLUT)による受動的な輸送により行われることが知られている。GLUTといわれる糖輸送体は、14種類の類縁体(GLUT1~14)が存在し、そのそれぞれの類縁体は特定の組織への局在性や、輸送する糖の種類(基質)が異なる。例えば、GLUT1は細胞内にブドウ糖(グルコース)を輸送する。GLUT5は腸絨毛の腸管上皮細胞頭頂面に局在し、小腸において摂取した食物から果糖(フルクトース)を吸収するために必須の膜たんぱく質である。なお、腸絨毛の頭頂部に局在し、小腸において摂取した食物からのブドウ糖(グルコース)の吸収に必須の膜たんぱく質はSGLT1である。
- 注2) 抗体フラグメント(Fv)
- 抗体を酵素処理や、遺伝子工学的手法を用いて発現させて、抗原に結合できる最小単位にしたもの。
- 注3) 変異導入
- 人為的に現状のアミノ酸配列を異なる配列に置き換えること。
- 注4) ヘリックス
- たんぱく質の立体構造の一部で、アミノ酸がらせん状に折りたたまれたモチーフのこと。
- 注5) アミノ酸残基
- たんぱく質を構成するアミノ酸の一部で、20種類あるアミノ酸の種類を決定する。たんぱく質と基質と結合するなどの機能を持つ。
- 注6) 塩橋
- たんぱく質の中で塩基性のアミノ酸残基(アルギニンやリジン)と酸性のアミノ酸残基(アスパラギン酸、グルタミン酸)の間に働く弱いイオン性相互作用のこと。たんぱく質の立体構造を安定させる。
- 注7) ロッカースイッチ機構
- 2組の膜貫通ヘリックスの束が剛体として可動して内開きと外開きの構造を行き来することにより、基質を輸送する仕組みのこと。
<論文タイトル>
“Structure and mechanism of the mammalian fructose transporter GLUT5”
(哺乳類の果糖輸送体GLUT5の構造と分子機構)
doi :10.1038/nature14909
<お問い合わせ先>
<研究に関すること>
岩田 想(イワタ ソウ)
京都大学 大学院医学研究科 教授
〒606-8501 京都府京都市左京区吉田近衛町
Tel:075-753-4372 Fax:075-753-4660
E-mail:
野村 紀通(ノムラ ノリミチ)
京都大学 大学院医学研究科 助教
〒606-8501 京都府京都市左京区吉田近衛町
Tel:075-753-4389 Fax:075-753-4660
E-mail:
<JST事業に関すること>
小賀坂 康志(オガサカ ヤスシ)、吉田 健司(ヨシダ ケンジ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-6380-9130 Fax:03-3222-2063
E-mail:
<報道担当>
京都大学 企画・情報部 広報課
〒606-8501 京都府京都市左京区吉田本町
Tel:075-753-2071 Fax:075-753-2094
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: