京都産業大学 総合生命科学部の遠藤 斗志也 教授と渡邊 康紀 日本学術振興会 特別研究員(京都産業大学)らの研究グループは、ミトコンドリア注1の外膜から内膜へリン脂質を輸送するタンパク質Ups1-Mdm35複合体の立体構造を解明しました。さらに、その立体構造に基づいた変異体を用いた解析から、Ups1-Mdm35複合体がミトコンドリアの2枚の膜間でリン脂質を輸送するメカニズムを解明しました。本研究成果により、生命活動に必要なエネルギーを産生し、ヒトの健康や老化への関係が注目されるミトコンドリアの機能を支えるリン脂質を正しく供給する仕組みを解明し、リン脂質供給の異常により引き起こされる疾患の病因の理解や治療法開発への貢献が期待されます。
本研究成果は、2015年8月3日(英国時間)に英国科学誌「Nature Communications」のオンライン版に掲載予定です。
生命活動に必要なエネルギーを産生するなど、ヒトの健康に重要とされるミトコンドリアの機能に必須となるリン脂質は、水に溶けない性質を持っています。このリン脂質が、水に満たされた細胞内でどのように脂質でできた生体膜から生体膜へと特異的に輸送されるのかという「細胞内の脂質配送」の仕組みについてはほとんど分かっていませんでした。本研究により、ミトコンドリア外膜から内膜へリン脂質分子を輸送するタンパク質Ups1-Mdm35複合体の遊離型及びリン脂質結合型の立体構造を決定し、決定した立体構造とその変異体を用いた解析から、タンパク質Ups1-Mdm35複合体が、いったん「脂質膜」に結合してそこから運ぶべき脂質を引き抜き、次に「水中」を移動して目的地の「脂質膜」へと脂質を送り込むという、脂質輸送のメカニズムを初めて解明しました。細胞内でさまざまな脂質が、誤送も遅配もなくスムーズに目的地に配送される、謎に満ちた脂質流通の仕組みを明らかにしました。
本研究は、科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中 啓二(東京都医学総合研究所 所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
<背景>
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアをはじめとする膜で仕切られた細胞小器官がつくられています。ミトコンドリアは生命活動に必須のエネルギー生産を担い、細胞内の発電所に例えられる重要な小器官です。ミトコンドリアは外膜と内膜の2枚の生体膜に囲まれ、ミトコンドリアが正常に機能するには、多くの酵素反応の足場となる内膜を構成する、カルジオリピン注2)などのリン脂質の組成が正しく保たれることが不可欠です。ところが内膜のカルジオリピン合成の原材料のリン脂質、ホスファチジン酸注2)はミトコンドリアとは別の小器官である小胞体注3)でつくられます。したがってホスファチジン酸を小胞体からミトコンドリアの外膜へ、さらに外膜から内膜へと、膜間を隔てる水の区画を越えて輸送するシステムが必要となります。「水と油」と言われるように、生体膜を構成する主要成分リン脂質は水には溶けません。細胞内で特定の脂質が生体膜から正しく選別されて引き出され、目的地の生体膜へと水の区画を越えて正しく輸送される「脂質配送」の原理や仕組みは、ほとんど分かっていませんでした。最近になって、Ups1とMdm35という2つのタンパク質が複合体をつくって、ミトコンドリアの外膜から内膜へとホスファチジン酸を運ぶことがわかってきました(図1)。しかしUps1-Mdm35複合体がどうやってホスファチジン酸を識別し、外膜と内膜を隔てる水の区画を越えてホスファチジン酸を運ぶのかは、大きな謎でした。
<研究成果>
本研究グループはUps1-Mdm35複合体の立体構造を決めることで、ホスファチジン酸を運ぶメカニズムを明らかにすることを試みました。Ups1-Mdm35複合体の結晶を作成し、X線結晶構造解析により、Ups1-Mdm35複合体の立体構造を決定しました(図2左)。その結果、Ups1にMdm35が抱きつくように結合することでUps1の立体構造が安定化されていること、Ups1にはプラスに荷電した深い「ポケット」が形成されていることが分かりました。ポケットの入り口には、オメガループと呼ばれる柔軟性に富んだループ構造があって、これがあたかも蓋のように入り口を塞いでいました。
さらに、研究グループはUps1-Mdm35複合体のホスファチジン酸結合型の立体構造の決定に成功しました(図2右)。ホスファチジン酸は、水に溶けにくいアシル基の「尾部」とマイナスの電荷を持つリン酸基の「頭部」から成る分子です。ホスファチジン酸はUps1のポケットに頭部から入り込み、ポケット内のプラスの電荷を持つアミノ酸残基にプラスとマイナスの電荷が引き合う形で結合していることが分かりました。また、変異体を用いた解析からUps1のポケットを塞いでいたオメガループと、ポケットの入り口付近及び奥に存在しているプラスの電荷を持つアミノ酸残基が、実際にホスファチジン酸の膜間輸送に重要であることが明らかになりました。
以上の結果から、まずUps1のポケットの入り口のプラスの電荷が、外膜のホスファチジン酸のマイナスに荷電した頭部をポケット入り口に導き、ポケット内部のプラスの電荷が頭部をポケット内奥深くに引き込みます。続いてオメガループがポケットに蓋をしてホスファチジン酸を水から隔離することで、Ups1がコンテナトラックのように外膜から内膜へと、水の区画を越えてホスファチジン酸を運ぶことを可能にすることが分かりました。
Ups1-Mdm35複合体が外膜からホスファチジン酸を積込むとき、次に内膜で荷下ろしするとき、Ups1は外膜や内膜と直接結合する必要があります。Ups1-Mdm35複合体は水に良く溶け、水の区画を自由に移動できますが、膜に結合するときはMdm35を解離させ、Ups1単独の積込み型(荷下ろし型)になるらしいことが示唆されていました。研究グループは明らかになったUps1-Mdm35複合体の立体構造に基づいてUps1とMdm35を共有結合で繋ぎ、両者が解離できない形(水中輸送型に固定)にしました。するとこの状態のUps1は膜への結合が弱くなること、ホスファチジン酸の積込みや荷下ろしが遅くなり、結果としてホスファチジン酸の輸送能が低下することを見出しました。したがって、ホスファチジン酸の外膜から内膜への効率的な輸送には、Mdm35の切り離し(解離)を伴ったUps1の膜への結合(水中輸送型から膜上での積込み(荷下ろし)型への変換)が重要であることが示唆されました(図3)。
このように2つのタンパク質の結合・解離により脂質の輸送が制御されるメカニズムはこれまでに例がなく、新規のメカニズムであると言えます。
<今後の展開>
これまで、細胞内で数千~数万種類におよぶタンパク質が合成され、各々が働くべき場所に正しく配送される仕組みはかなり詳しく調べられてきました注4)。しかし数百種類もの脂質がどうやって働くべき場所に届けられるかという脂質配送の仕組みも物流の全体像もほとんど分かっていませんでした。本研究をきっかけとして脂質配送の仕組みがわかってくると、オートファジー(自食作用)やアポトーシス(プログラム化された細胞死)がそうであったように、さまざまな要因が複雑に絡んで引き起こされるがんや糖尿病をはじめとする病気や、逆に原因不明であった難病に、実は脂質配送の異常が関わる例が見つかってくることが考えられます。実際、本研究で解析した出芽酵母のUps1-Mdm35複合体はヒトに至るさまざまな生物種間でよく保存されており、その増減がヒトの健康と深くかかわることが示されています注5)。将来的には、ヒトを含む高等真核生物の脂質配送の全体像の解明を通じて、脂質の配送の欠陥が引き起こすヒトの病気の治療や、健康を保つ試みなどにつながることが期待されます。
<参考図>
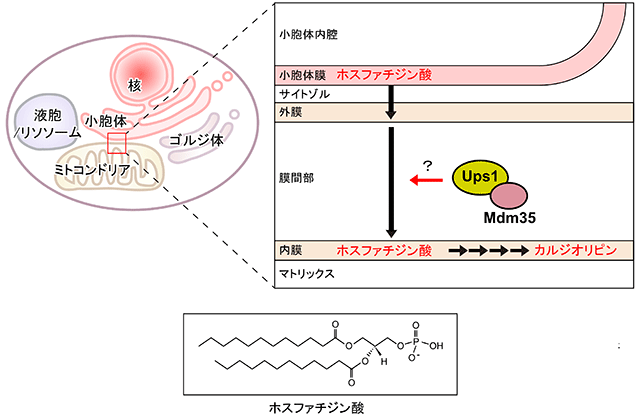
図1 小胞体及びミトコンドリア膜間におけるホスファチジン酸の輸送経路(上)とホスファチジン酸の構造(下)
小胞体膜で合成されたホスファチジン酸はミトコンドリア外膜から内膜へ輸送され、ミトコンドリア機能に必須のカルジオリピン合成の原材料となる。
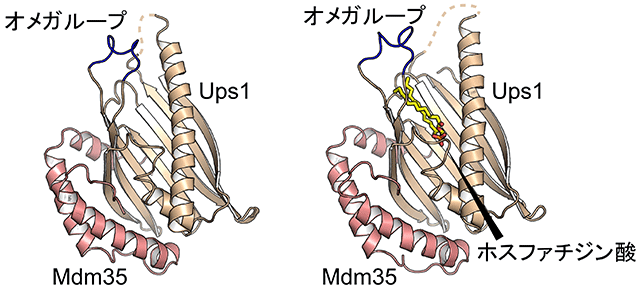
図2 Ups1-Mdm35複合体の遊離型(左)とホスファチジン酸結合型(右)の立体構造
Ups1は薄茶色、Mdm35はピンク色、オメガループは青色で示してある。
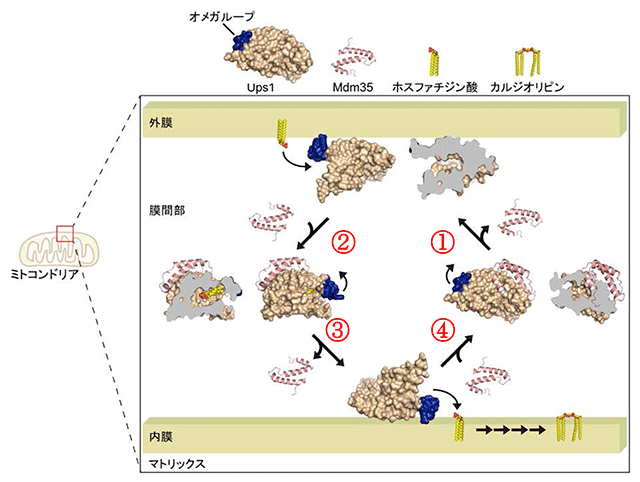
図3 Ups1-Mdm35複合体によるミトコンドリア外膜・内膜間のリン脂質輸送のモデル
- ①Ups1は膜間部(外膜と内膜の間の水の区画)ではMdm35と複合体を形成しているが、ホスファチジ酸積込みのために外膜へ結合する際、Mdm35は解離する。
- ②ホスファチジン酸をポケット内に積込み、オメガループが蓋をすると積込みが完了、再びMdm35と複合体を形成して水中輸送型となって、外膜から離れる。水に溶けないホスファチジン酸はオメガループが蓋をすることで水から隔離され、Ups1-Mdm35複合体はホスファチジン酸を積込んだまま、効率よく膜間部の水の区画を移動できる。
- ③内膜に到着したUps1-Mdm35複合体は、Mdm35を切り離して荷下ろし型となり、オメガループの蓋を開いてホスファチジン酸を内膜に荷下ろしする。
- ④荷下ろし後、Ups1はMdm35と再び複合体を形成して、内膜から離れる。
<用語解説>
- 注1)ミトコンドリア
- 酵母からヒトまで広く真核生物の細胞内に見られる必須の細胞小器官。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシスにも関わる。ミトコンドリアの機能低下や機能異常と老化やがん、糖尿病、さまざまなミトコンドリア病との関連がわかっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、健全なミトコンドリアを増やす方法が注目されている。
- 注2)カルジオリピンとホスファチジン酸
- カルジオリピンは主にミトコンドリアの内膜だけに存在し、ミトコンドリアの機能に必須のリン脂質。カルジオリピンは(マウスでは)胚発生に必須であり、その欠損や異常はヒトの老化、心不全、心筋症など、さらには難病として有名なバース症候群につながることが知られている。パーキンソン病との関連を指摘する報告もある。ホスファチジン酸はカルジオリピン合成の材料で、小胞体膜で作られた後、ミトコンドリアの外膜に配送され、そこからUps1-Mdm35によって内膜に配送されると考えられる。
- 注3)小胞体
- 真核生物の細胞内に見られる細胞小器官。細胞から外に出て行くタンパク質の合成、機能獲得、修飾、そして配送の場であるとともに、脂質をはじめさまざまな物質の合成代謝、カルシウム貯蔵などに関わる。
- 注4)タンパク質の配送機構
- 細胞内で合成されたタンパク質は、働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており、それを目的地の何らかの装置が読み取る、という原理があることを発見した(1999年ノーベル生理学・医学賞)。シェクマンとロスマンは、さらに小胞体からリソゾーム、細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ、小胞を生み出す膜、小胞、目的地の膜の間でタンパク質の選別の原理が働くことを見出した(2013年ノーベル生理学・医学賞)。一方脂質の配送については、タンパク質の配送にあたるような原理も機構もまったくわかっていなかった。
- 注5)Ups1-Mdm35複合体とヒトの健康
- ヒトのMdm35(ヒトでの名称:TRIAP1)は遺伝毒性ストレスの低下や腫瘍細胞でレベルが上昇して細胞周期の進行を速めること、ヒトのUps1(ヒトでの名称:PRELI)はリンパ球のアポトーシスや分化を抑制することが知られている。こうしたTRAP1-PRELIの機能は、TRAP1-PRELIがホスファチジン酸輸送を介してミトコンドリア機能に必須なカルジオリピン合成に関わることから、カルジオリピンがアポトーシスのシグナル(ミトコンドリアからの過剰なシトクロムc放出)を抑制することが考えられている。本研究で明らかになったリン脂質の膜間輸送のカニズムは、ヒトなどの高等真核生物における脂質流通の仕組みと制御機構、そしてそれらとアポトーシスやがん細胞の増殖などの関係解明につながることが期待される。
<発表論文>
「Structural and mechanistic insights into phospholipid transfer by Ups1-Mdm35 in mitochondria」
(Ups1-Mdm35によるリン脂質輸送に関する構造と機構の理解)
著者:渡邊 康紀(京都産業大学)、田村 康(山形大学)、河野 慎(京都産業大学)、遠藤 斗志也(京都産業大学)
研究体制:京都産業大学、山形大学の研究グループの共同研究
doi :10.1038/ncomms8922
<お問い合わせ先>
<研究に関する問い合わせ>
京都産業大学 総合生命科学部 教授
遠藤 斗志也(えんどう としや)
Tel:075-705-1508
E-mail:
<JSTの事業に関する問い合わせ>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
川口 哲(かわぐち てつ)
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道に関する問い合わせ>
京都産業大学 広報部
Tel:075-705-1411 Fax:075-705-1987
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: