ポイント
- 自閉症などの神経発達障害に関連するタンパク質同士が結合した状態の立体構造を決定しました。
- 決定した立体構造から神経細胞同士を適切につなぐ仕組みを明らかにしました。
- 本成果は神経回路形成のメカニズムの解明や自閉症などの神経発達障害に関わる今後の研究に役立つ知見になると期待されます。
東京大学 放射光連携研究機構(雨宮 慶幸 機構長)の深井 周也 准教授らの研究グループは、自閉症などの神経発達障害に関連するタンパク質同士が結合した状態の立体構造を決定し、神経細胞同士を適切につなぐ仕組みを解明しました。
神経細胞間のシナプス注1)の形成と再編は、神経回路の形成や記憶学習の際に起きる極めて重要なステップであり、その調節機構の破綻は様々な神経発達障害の発症と密接に関連することが示唆されています。自閉症などの神経発達障害に関連するタンパク質であるPTPδ注2)とIL1RAPL1/IL-1RAcP注3)は、それぞれ軸索末端と樹状突起注4)に発現し、選択的に相互作用することで神経伝達物質の放出を行うシナプス前終末と神経伝達物質の受容を行うシナプス後終末への分化誘導を促します。同研究グループの吉田 知之 准教授(富山大学)らは、この選択的相互作用がPTPδのスプライシング注5)で挿入される短いペプチド(ミニエクソンペプチド)により調節されることを見出し、ミニエクソンペプチドがシナプス標的認識の暗号として機能することを提唱してきましたが、その仕組みの詳細は不明でした。
深井准教授らの研究グループは、PTPδとIL1RAPL1及びPTPδとIL-1RAcPが結合した状態の立体構造をX線結晶構造解析の手法で決定することにより、それぞれの相互作用がミニエクソンペプチドによって調節される仕組みを明らかにし、ミニエクソンペプチドがシナプス標的認識の暗号として機能することを裏付けました。本成果は、神経回路形成のメカニズムの解明や自閉症などの神経発達障害に関わる今後の研究に役立つ知見になると期待されます。
本成果は、科学技術振興機構(JST)の戦略的創造研究推進事業 チーム型研究(CREST)「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域(田中 啓二 研究総括)における研究課題「シナプス形成を誘導する膜受容体複合体と下流シグナルの構造生命科学」(研究代表者:深井 周也)及び戦略的創造研究推進事業個人型研究(さきがけ)「脳神経回路の形成・動作と制御」研究領域(村上 富士夫 研究総括)における研究課題「中枢シナプスオーガナイザーによる標的認識と特異的シナプス形成の調節機構の解明」(研究代表者:吉田 知之)の一環として行われました。
<研究の背景>
神経細胞間のシナプス(図1)の形成と再編は、脳の発達に伴い神経回路が作られる際や記憶学習の際に起こる極めて重要なステップであり、その調節機構の破綻は自閉症、知的障害などの神経発達障害の発病と深く関わることが示唆されています。シナプス形成の一端はシナプスオーガナイザーと呼ばれるシナプス前終末と後終末の構造を分化誘導する一部の細胞接着分子が担うと考えられてきましたが、適切なシナプス標的を選別しながら非常に複雑な神経ネットワークを作り上げる原理はよくわかっていませんでした。同研究グループの吉田 知之 准教授ら(富山大学)は、これまでにシナプス前終末に発現するシナプスオーガナイザーPTPδがその細胞外領域の2カ所に挿入されるミニエクソンペプチドA及びB配列に依存してIL1RAPL1もしくはIL-1RAcPと結合して近接する神経細胞間に興奮性シナプス形成を誘導することを見出していました。そのためスプライシングによって作り出されるPTPδのミニエクソンペプチドA及びB配列はシナプス標的認識の暗号として機能すると考えられました。
<研究の内容>
深井准教授らの研究グループはPTPδ–IL1RAPL1及びPTPδ–IL-1RAcP複合体の立体構造(図2)からPTPδのミニエクソンペプチドA及びB配列のもつシナプス標的識別暗号を解読するメカニズムを明らかにすることを試みました。それぞれの複合体の結晶を作成し、大型放射光施設SPring-8(兵庫県佐用郡)及びPF(フォトンファクトリー)(茨城県つくば市)の高輝度X線を利用したX線結晶構造解析により、PTPδ–IL1RAPL1及びPTPδ–IL-1RAcP複合体の立体構造を決定しました。その結果、ミニエクソンペプチドAはIL1RAPL1及びIL-1RAcPとの結合面を構成することが明らかになりました(図3)。一方、ミニエクソンペプチドBは2つのイムノグロブリン様ドメインの間に挿入され、ドメイン間の位置関係を調節するリンカーとしてIL1RAPL1及びIL-1RAcPとの結合に寄与することが明らかになりました(図3)。立体構造から明らかになった選択的相互作用のメカニズムは、部位特異的変異体の分子間相互作用解析とシナプス誘導能の解析によって、機能的にも裏付けることができました。即ち、2つのミニエクソンペプチドはシナプスオーガナイザー複合体形成の特異性保持において異なる役割を担うことが判りました。これは、シナプス標的識別暗号を解読する新規のメカニズムです。このメカニズムの詳細を明らかにすることによって、ミニエクソンペプチドがシナプス標的認識の暗号として機能することが裏付けられました。
<社会的意義と今後の予定>
ヒトにおいてIL1RAPL1遺伝子の変異はX染色体連鎖型知的障害・自閉症の原因になることが知られています。また、自閉症患者の脳内ではPTPδのミニエクソンペプチドA及びB配列を含むスプライシング調節に異常があることが報告されています。今後、様々なPTPδスプライスバリアントとそのリガンドとの間で形成されるシナプスオーガナイザー複合体の構造を解き明かすことによって、中枢シナプス形成の特異性を保証する基本原理が明らかになると期待されます。さらにPTPδのスプライシング調節機構やシナプスオーガナイザー複合体の活性化からシナプス前終末・後終末が分化誘導される分子シグナルを理解することは神経発達障害の病態解明と治療・創薬標的の提示に役立つと考えられます。
<参考図>
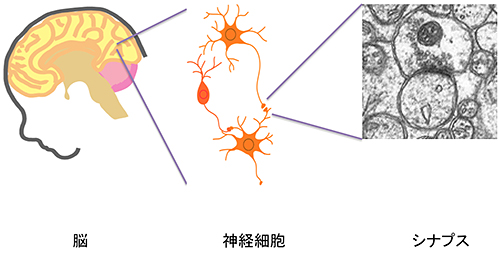
図1
数千億の神経細胞が脳の中で神経回路を形成しており、それぞれの神経細胞はシナプスと呼ばれる特殊な接着構造によってつながっている。
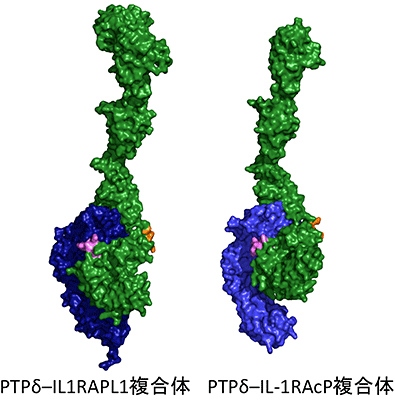
図2
PTPδ–IL1RAPL1複合体(左)とPTPδ–IL-1RAcP複合体(右)の立体構造。PTPδは緑色、IL1RAPL1は濃い青色、IL-1RAcPは薄い青色で示す。ミニエクソンペプチドAとBは、それぞれピンク色とオレンジ色で示してある。
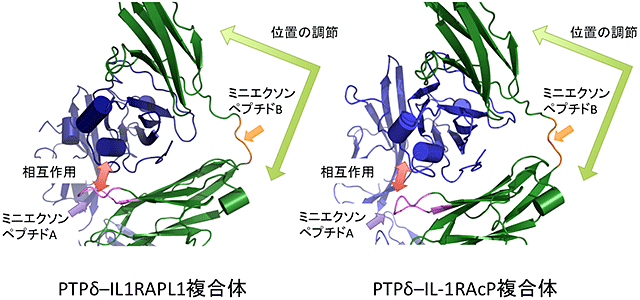
図3
PTPδとIL1RAPL1及びIL-1RAcPとの相互作用の拡大図。ミニエクソンペプチドAは直接の相互作用に関与しているのに対して、ミニエクソンペプチドBは、2つのイムノグロブリン様ドメインの位置を調節する役割を担っている。IL1RAPL1は、IL-1RAcPよりも強くミニエクソンペプチドAと相互作用するため、PTPδ–IL1RAPL1の結合は、ミニエクソンペプチドAの影響をより強く受ける。
<用語解説>
- 注1) シナプス
- 神経細胞の軸索が他の神経細胞に入力する部位に形成される、神経細胞間の信号伝達を担う構造。シナプス前終末と後終末の間に隙間があり、シナプス前終末から放出される神経伝達物質をシナプス後終末の受容体が受容することによって信号を伝える。
- 注2) PTPδ
- 受容体型のチロシンフォスファターゼファミリーに属する膜受容体タンパク質。PTPδは、type IIaと呼ばれるサブファミリーに属し、同じサブファミリーに属するLARやPTPσとともに、シナプス形成を誘導する活性をもつ。
- 注3) IL1RAPL1、IL-1RAcP
- インターロイキン1受容体(IL-1R)ファミリーに属する膜受容体タンパク質。IL-1RAcPとIL1RAPL1ともに、PTPδと選択的に相互作用してシナプス形成を誘導する。IL1RAPL1は神経系のみで発現して機能するが、IL-1RAcPは免疫系でも発現し、IL-1Rとともに炎症反応などの異なるシグナル経路でも機能する。
- 注4) 軸索と樹状突起
- 神経細胞の持つ突起は軸索と樹状突起に分類される。多くの場合、各神経細胞は1本の軸索と複数の樹状突起を持つ。軸索は太さが均一で樹状突起に比べて長く、他の神経細胞へ刺激を伝える。一方、樹状突起は樹状に分岐した比較的短い突起であり、他の神経細胞から刺激を受け取る。
- 注5) スプライシング
- DNAの遺伝情報はメッセンジャーRNA(mRNA)に転写されるが、転写された直後の真核生物のmRNAには、タンパク質をコードする領域(エクソン)とコードしない領域(イントロン)が混在している。イントロンを除去し、エクソンをつなげてタンパク質をコードする領域のみを含むmRNAを生み出すプロセスをスプライシングと呼ぶ。スプライシングの過程でエクソンを取捨選択することで、1つの遺伝情報から多様なタンパク質(スプライシングバリアント)を作ることが可能になる。
<発表雑誌>
| 雑誌名 |
「Nature Communications」 |
| 論文タイトル |
“Mechanisms of splicing-dependent trans-synaptic adhesion by PTPδ–IL1RAPL1/IL-1RAcP for synaptic differentiation” |
| 著者 |
Atsushi Yamagata, Tomoyuki Yoshida, Yusuke Sato, Sakurako Goto-Ito, Takeshi Uemura, Asami Maeda, Tomoko Shiroshima, Shiho Iwasawa-Okamoto, Hisashi Mori, Masayoshi Mishina & Shuya Fukai |
| doi |
10.1038/ncomms7926 |
<お問い合わせ先>
<研究に関すること>
東京大学 放射光連携研究機構 生命科学部門 構造生物学研究室
准教授 深井 周也(フカイ シュウヤ)
Tel:03-5841-7807
E-mail:
富山大学 大学院医学薬学研究部
准教授 吉田 知之(ヨシダ トモユキ)
Tel:076-434-7231
E-mail:
<JST事業に関すること>
科学技術振興機構 戦略研究推進部
川口 哲(カワグチ テツ)、松尾 浩司(マツオ コウジ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: