ポイント
- FOP(Fibrodysplasia Ossificans Progressiva;進行性骨化性線維異形成症)患者さんから作製したiPS細胞(疾患iPS細胞)の遺伝子を修復し、対照iPS細胞を作製した。
- 上記の対照iPS細胞と、疾患iPS細胞をそれぞれ軟骨細胞に分化誘導したところ、疾患iPS細胞からは軟骨ができやすいという病態を再現できた。
- MMP1遺伝子とPAI1遺伝子が軟骨生成を促し、FOPの病態に関与することを初めて示した。
- 患者さん由来の対照iPS細胞を用いて研究を進めることで、より的確な病態メカニズムの解明や創薬へとつながると期待される。
松本 佳久 大学院生(京都大学 CiRA/再生医科学研究所/名古屋市立大学 大学院)、池谷 真 准教授(京都大学 CiRA)、戸口田 淳也 教授(京都大学 CiRA/再生医科学研究所/医学研究科)らの研究グループは、患者さん由来の疾患iPS細胞より、患者さんの遺伝情報をもつ対照iPS細胞を作製し、それぞれから軟骨細胞を誘導し、FOPの病態の再現やメカニズムの一端を明らかにしました。
具体的には、まず、FOP患者さん由来の疾患iPS細胞において、FOPの原因となる遺伝子変異を野生型に修復しました。これにより、修復した変異以外はもとの患者さんと同じ遺伝情報をもつ対照iPS細胞を作製することに成功しました。患者さん由来の疾患iPS細胞と対照iPS細胞を軟骨細胞へと分化させたところ、疾患iPS細胞では軟骨への分化能が亢進していることを確認しました。また、双方のiPS細胞から軟骨へと分化させる途中の段階(間葉系間質細胞)で様々な遺伝子の発現を調べたところ、MMP1とPAI1という2つの遺伝子が疾患iPS細胞で発現が亢進しており、FOPの病態に寄与していることが示唆されました。
今回の研究でのアプローチのように、FOPの変異以外は同じ遺伝情報をもつ細胞を対照細胞とし、比較することで、原因変異によるメカニズムに、より焦点をあてて調べることができます。そのため、より的確な病気のメカニズムの検討、より効率的で有効な創薬につながると期待されます。
この研究成果は2015年3月12日午前9時(米国東部時間)に「Stem Cells」で公開されます。
<研究の背景>
FOPは筋肉や腱、靭帯などの軟部組織の中に、徐々に骨ができてしまう(異所性骨化)病気で、200万人に1人程度の割合で患者さんがいると言われている希少難病の1つです。これまでの研究により、ACVR1と呼ばれる遺伝子に変異が生じて、その遺伝子が過剰に働くとFOPとなることが分かっていました。しかし、FOP患者さんの体内から組織サンプルを採取すると骨化を促進し病状を悪化してしまうことや、マウスを使ったFOP病態モデル注1)の限界から、FOP発症の詳細なメカニズムについては不明な点が多いとされてきました。
これまでにグループは、iPS細胞から軟骨への分化誘導法を確立し、異所性骨化の重要な過程の1つと考えられている軟骨への分化能について検討を行っています。しかし、これまでは病気のメカニズムを調べるために、患者さん由来のiPS細胞とFOPではない人由来のiPS細胞からそれぞれ分化した細胞を比較しており、両者の遺伝的背景が異なっていました。そのため、両者の比較からは、病態に無関係な遺伝情報の個人差が病気の原因として検出される可能性がありました。
そこで本研究では、FOPを引き起こす変異以外は同じ遺伝情報をもつ対照iPS細胞を作製し、それと疾患iPS細胞の軟骨への分化能を比較することにより、FOPのメカニズムの一端の解明を試みました。
なお、本研究については、2011年から大日本住友製薬株式会社と共同研究を行っています。
<研究結果>
1.患者さん由来疾患iPS細胞から対照iPS細胞の作製
まず、FOP患者さんから作製した疾患iPS細胞(FOP-iPSC。以降、本文章中では患者さん由来の疾患モデル細胞をFOPにて表す)のゲノム中の原因変異(ACVR1遺伝子の7番目のエクソン注2)にある変異)をBAC(大腸菌人工染色体)注3)ベクターを用いた相同組換え注4)により、野生型に修復しました(遺伝子修復)。その結果、変異の修復されたiPS細胞株(resFOP-iPSC。以降、本研究で作製した患者さん由来の対照細胞をresFOPにて表す)を作製することに成功しました。このresFOP-iPSCは、修復した変異以外は、もとの患者さん由来iPS細胞と、同じ遺伝情報をもっているため、FOP変異やそれに関連する病気のメカニズムを調べる上で、より厳密な対照細胞となります。
なお、resFOP-iPSCでは、多能性を示すマーカーが発現しており、またテラトーマ(奇形腫)注5)を形成することから多能性を持つことが確認されました。resFOP-iPSCの形や増殖能、テラトーマ内の軟骨組織部分は、もとのFOP-iPSCと同様でした。
2.FOP-iPSCとresFOP-iPSCの、軟骨分化能の確認と病態再現
次に、FOP-iPSCとresFOP-iPSCそれぞれから神経堤細胞(NCC)注6)、間葉系間質細胞(MSC)注7)を介して、マイクロマス培養法注8)により軟骨へと分化誘導しました。MSCの段階から誘導10日後の軟骨組織を観察したところ、FOP-iPSC由来の軟骨では、resFOP-iPSC由来の軟骨よりも軟骨のマーカー遺伝子(SOX9,COL2A1,ACAN)が高く発現しており、より大きな軟骨組織が形成されました。このことは、FOP患者さんの軟骨ができやすいという病態の一部を培養皿の上で再現することができたと考えられます。また、これにより、FOP患者さん体内に存在する変異ACVR1が軟骨への分化と成熟を促進していることが確認されました。
3.網羅的遺伝子解析による発現量の違う遺伝子群の同定
また、iPS細胞、NCC、MSCそれぞれの段階で、マイクロアレイ注9)を用いて、様々な遺伝子の発現を調べ、比較しました。それぞれの段階において、患者さん由来の疾患細胞と対照細胞はまとまって、標準的な細胞と異なる群に分類されています。これは遺伝子発現パターンが極めて近いことを示し、遺伝的背景がほぼ同一な細胞であることに一致した結果であると考えられます。
また、FOP-iPSCとresFOP-iPSC、また途中の段階のFOP-iNCC(FOP-iPSC由来NCC)とresFOP-iNCC(resFOP-iPSC由来NCC)では遺伝子の発現にほとんど違いが見られませんでした。ところが、MSCの段階では、FOP-iMSCでresFOP-iMSCに比べ191もの遺伝子が2倍以上高く発現し、110遺伝子が2倍以上発現が低いことが確認されました。これにより、FOP細胞とresFOP細胞は、MSCの段階でいくつか異なる遺伝子発現が見られるようになることが分かりました。中でもMMP1遺伝子とPAI1遺伝子がとりわけFOP-iMSCで高く発現していました。また、これらの遺伝子には軟骨分化を促進する働きがあり、FOPの病態に寄与していることが分かりました。
<まとめ>
本研究では、FOP患者さん由来疾患iPS細胞のFOP変異を修復することで、FOP変異以外の遺伝的背景が同一の患者さん由来対照iPS細胞を作製することに成功しました。疾患iPS細胞と対照iPS細胞を軟骨へと分化誘導させることで、疾患iPS細胞からは軟骨ができやすいという病態を体外で再現できました。また疾患モデル細胞と対照細胞を比較すると、とりわけ2つの遺伝子が疾患モデル細胞で発現が高く、また、軟骨生成を促し、FOPの病態に関与することが分かりました。
今回のような患者さん由来の対照iPS細胞の作製はFOP以外の疾患においても、より的確な病態メカニズムの解明や有効な創薬へとつながると期待されます。
<論文名と著者>
| 論文名 |
“New protocol to optimize iPS cells for genome analysis of fibrodysplasia ossificans progressiva” |
| ジャーナル名 |
Stem Cells |
| 著者 |
Yoshihisa Matsumoto1,2,3,†, Makoto Ikeya2,†,*, Kyosuke Hino2,4, Kazuhiko Horigome2,4, Makoto Fukuta1,2,3, Makoto Watanabe2,5, Sanae Nagata2, Takuya Yamamoto2,6, Takanobu Otsuka3, and Junya Toguchida1,2,7,* |
| † 筆頭著者 * 責任著者 |
| 著者の所属機関 |
- 1.京都大学 再生医科学研究所
- 2.京都大学 iPS細胞研究所(CiRA)
- 3.名古屋市立大学 大学院医学研究科
- 4.大日本住友製薬株式会社 研究本部先端創薬研究所
- 5.島津製作所 基盤技術研究所
- 6.京都大学 物質-細胞統合システム拠点(iCeMS)
- 7.京都大学 大学院医学研究科
|
<本研究への支援>
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金
- 文部科学省 「再生医療の実現化プロジェクト」
- JST 再生医療実現拠点ネットワークプログラム 「iPS 細胞研究中核拠点」
- JST 再生医療実現拠点ネットワークプログラム 「疾患特異的iPS細胞を活用した難病研究」
- JST 研究成果展開事業 研究成果最適展開支援プログラム「A-STEP」
- iPS細胞研究基金
<参考図>
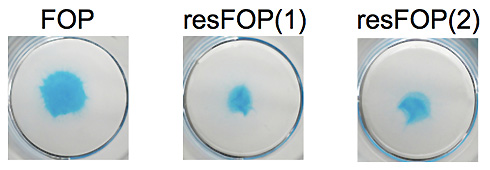
図1 FOP患者さん由来iPS細胞(FOP-iPSC;左)と遺伝子修復したiPS細胞(resFOP-iPSC;中・右)
図2 FOP-iMSC(FOP-iPSC由来MSC)とresFOP-iMSC(resFOP-iPSC由来MSC)
から分化誘導した軟骨組織(それぞれ、左、中・右)
FOP-iMSCとresFOP-iMSCから分化誘導10日目の軟骨組織の様子を示している。
軟骨組織の軟骨基質がアルシアン青染色にて青く染められている。
FOP-iMSCからはresFOP-iMSCからよりも大きな軟骨組織が形成された。
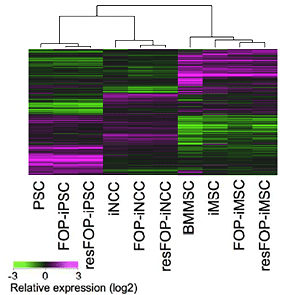
図3 それぞれの細胞の遺伝子発現の近似性
マイクロアレイで遺伝子の発現を調べ、各細胞の遺伝子発現の近似性を調べた。
下のヒートマップでは紫色が発現の高い遺伝子、緑色が発現の低い遺伝子を示している。
また、上の樹形図では、低い位置で枝分かれしているほど遺伝子発現パターンが近いことを示している。
これらよりFOP細胞は標準細胞よりも、resFOP細胞に近似していることが分かる。
PSC、iNCC、iMSC:標準的なiPS細胞、それから分化した神経堤細胞、間葉系間質細胞
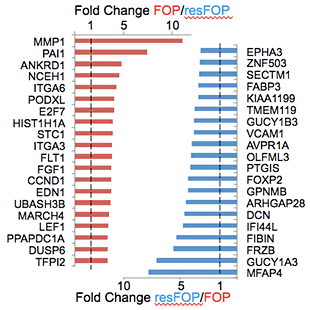
図4 FOP-iMSCとresFOP-iMSCでの遺伝子発現の違い
赤い棒グラフはFOP-iMSCでresFOP-iMSCよりも発現が高い遺伝子、青い棒グラフはresFOP-iMSCでFOP-iMSCよりも発現が高い遺伝子を示している。
横軸の数字は、遺伝子発現量の違いを倍数で示したもの。
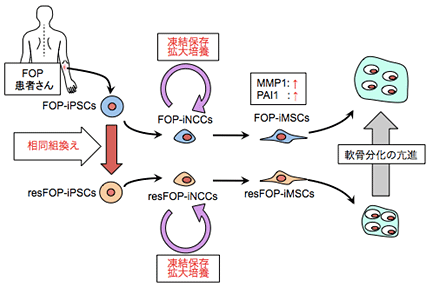
図5 今回の研究のまとめ
<用語解説>
- 注1) 病態モデル
- その病気に特徴的な症状や性質を再現したもの。研究を行う際には、病態モデルを用いて病気の原因究明を行う。これまでも病態を再現した実験動物が、病態モデルとして多くの基礎研究に利用されていた。しかし、ヒトと実験動物とではシステムが異なることもあり、有効な病態モデルが得られないこともあった。ヒトの疾患特異的iPS細胞から病態が再現できれば、病態解明、創薬を目指した研究が進めやすくなると期待されている。
- 注2) エクソン
- 遺伝子を構成するDNAのうち、転写後、最終的にmRNAとなる部分。mRNAはリボソームにおいて翻訳されタンパク質を形成する。
- 注3) BAC(bacterial artificial chromosome:大腸菌人工染色体)
- 約300kbまでの長い遺伝子をクローニングできる、大腸菌が宿主のベクター(運び屋)である。大腸菌内での相同組換えにより、容易に遺伝子を任意に導入できる。
- 注4) 相同組換え
- DNAの塩基配列がよく似た領域(相同部位)で起こるDNAの組換えのこと。二本鎖のDNAには、切断や変異が起こっても相補鎖を元に修復する機能が備わっており、これらの性質を応用して目的の場所の遺伝情報を変える技術。
- 注5) テラトーマ(奇形腫)
- ES細胞やiPS細胞といった多能性幹細胞を免疫不全マウスの皮下などに注射すると、腫瘍を形成する。この腫瘍はテラトーマと呼ばれ、様々な種類の組織が混在している。テラトーマを観察し、様々な組織に分化していることを確認することは、細胞の分化多能性を調べる一般的な方法の1つである。
- 注6) 神経堤細胞(neural crest cell:NCC)
- 頭頚部骨格系、角膜、末梢神経系、皮膚色素細胞など多様な細胞種への分化能を有する、胎児期に一過的に現れる移動性の細胞集団。神経冠細胞と呼ばれることもある。
- 注7) 間葉系間質細胞(mesenchymal stromal cells:MSC)
- 骨・軟骨・脂肪細胞などといった間葉系の細胞に分化する能力を持った間質(結合組織)の細胞。軟骨への分化過程の1つに、神経堤細胞から間葉系間質細胞を経由して分化する過程が知られている。
- 注8) マイクロマス培養法
- 細胞を高濃度で調製し、滴状で培養皿上に播種することで作製される高密度の細胞塊をマイクロマスと呼び、その状態で培養する方法をマイクロマス培養法と呼ぶ。軟骨分化の際に用いられる。
- 注9) マイクロアレイ
- 多種類の微量な分子(核酸や抗体など)を基盤上に固定し、それに解析対象とするサンプルを作用させることで、一度に膨大な数のDNAやRNA、タンパク質の質や量を網羅的に検査することができる解析技術。
<お問い合わせ先>
<研究内容およびCiRAに関すること>
京都大学 iPS細胞研究所(CiRA) 研究支援部門 国際広報室
中内 彩香(ナカウチ アヤカ)
〒606-8507 京都市左京区聖護院川原町53
Tel:075-366-7005 Fax:075-366-7023
E-mail:
<JST 再生医療実現拠点ネットワークプログラムに関すること>
科学技術振興機構 再生医療研究推進部
坂本 祥純(サカモト ヨシズミ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-5214-8427 Fax:03-5214-7810
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: