ポイント
- 生きたマウスの神経活動・シナプス活動を超高感度・超高速で計測できる赤色蛍光カルシウムセンサーの開発に成功。
- マウス生体内で2つの異なる神経細胞種の神経活動の同時計測に世界で初めて成功。
- 行動、記憶の過程における神経回路ネットワークの動作原理や、精神疾患などの病態解明が期待される。
JST 戦略的創造研究推進事業において、東京大学 大学院医学系研究科の尾藤 晴彦 教授と井上 昌俊 特任研究員らは、生きたマウスの神経活動を計測できる高感度・超高速の赤色蛍光カルシウム(Ca2+)センサーの開発に成功しました。
近年、たんぱく質性蛍光Ca2+センサーは生きている哺乳類の脳の神経活動・シナプス活動を計測するために利用されつつあります。しかし、これまでの実用的なCa2+センサーは計測波長域が緑色域に限定され、生体内で神経活動を高速・高感度に計測できる赤色Ca2+センサーの開発が望まれていました。また、従来のCa2+センサーは神経細胞が記憶を成立させるなどの際の高頻度神経発火注1)を計測できないという問題がありました。
本研究グループは、Ca2+結合領域に新規配列を用いることでCa2+に対する結合力を上げ(高感度)、かつ高頻度神経発火の計測が可能な超高感度・超高速赤色Ca2+センサー『R-CaMP2』を開発しました。この超高感度・超高速赤色Ca2+センサーと従来の緑色Ca2+センサーを組み合わせることで、マウス大脳皮質における興奮性と抑制性の2つの異なる神経細胞種の神経活動を同時に計測することを可能にしました。さらに、光遺伝学注2)的手法との組み合わせも可能であることを自由行動下の線虫注3)において証明し、神経ネットワーク解析に新しい道を拓きました。
この成果は、今後生きている哺乳類の脳の神経活動およびそのダイナミクスの多重計測を容易にし、精神疾患や学習・記憶障害などの病態解明および治療法の開発につながるものと期待されます。
本研究は、主としてJSTのCREST研究の一環として行われました。また東京大学 大学院医学系研究科の狩野 方伸 教授、喜多村 和郎 准教授(現 山梨大学 大学院医学工学総合研究部 教授)および埼玉大学 脳末梢科学研究センター 中井 淳一 教授らと共同で行ったものです。本研究成果は、2014年11月24日(米国東部時間)に米国科学誌「Nature Methods」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「脳神経回路の形成・動作原理の解明と制御技術の創出」
(研究総括:小澤 瀞司 高崎健康福祉大学 健康福祉学部 教授) |
| 研究課題名 |
「可塑的神経回路を支えるシグナル伝達の分子基盤解明と制御」 |
| 研究代表者 |
尾藤 晴彦(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成22年10月~平成28年3月 |
JSTはこの領域で、脳神経回路の発生・発達・再生の分子・細胞メカニズムを解明し、さらに個々の脳領域で多様な構成要素により組み立てられた神経回路がどのように動作してそれぞれに特有な機能を発現するのか、それらの局所神経回路の活動の統合により、脳が極めて全体性の高いシステムをどのようにして実現するのかを追求します。またこれらの研究を基盤として、脳神経回路の形成過程と動作を制御する技術の創出を目指します。上記研究課題では、可塑的神経回路を支えるシグナル伝達の分子基盤をシナプスレベル並びにシステムレベルで明らかにし、可塑的神経回路の脱構築・再構築を制御するための技術を開発します。
<研究の背景と経緯>
カルシウム(Ca2+)は神経機能や筋収縮をはじめとしてさまざまな細胞機能を制御する重要な分子です。また、脳は複数の異なる神経細胞種からなり、それぞれが協調的に働くことにより正常な脳機能を発揮していると考えられています。近年、神経発火により細胞内Ca2+濃度が上昇することから、神経発火を検出する方法としてたんぱく質性蛍光Ca2+センサーを用いて、神経活動をイメージングできるようになりました。これを応用して、数百-数千個の神経細胞の活動を同時記録することにより、脳の働き方の原理をはじめとして記憶障害や精神疾患の原因を解明することが重要な課題となっています。
たんぱく質性蛍光Ca2+センサーは特定の神経細胞種に発現させることができ、長期観察が可能であることから、広く用いられてきています。赤色Ca2+センサーは開発されていたものの感度が低いため、生きた動物個体イメージングに実用化されているのは緑色Ca2+センサーのみであり、これまでは2つの神経細胞種間の関係を検討することは困難でした。また、記憶が成立する際に高頻度の神経発火が重要な役割を果たすことから、脳機能の解明には神経発火頻度を読み解くことが重要であると考えられています。しかし、従来のたんぱく質性蛍光Ca2+センサーは、神経入力の有無もしくは強度のみを検出しており、どのような入力(神経発火の頻度、回数)が起こっているのかを検出する(高頻度神経発火を計測する)には不十分でした。この問題点を解決するためには、①反応速度(キネティクス)が早く、②神経発火回数と蛍光強度の変化との間に線形関係を示すたんぱく質性蛍光Ca2+センサーの開発が望まれていました。②の条件を実現するためにはCa2+濃度と蛍光強度の変化の関係を示すHill係数注4)を『1』に近づけたCa2+センサーを作出することが必要です。しかし、従来の高感度たんぱく質性Ca2+センサーはHill係数が2付近、またはそれ以上であったことから、複数の活動電位注5)に対し非線形的に蛍光強度が変化し、また、広範囲のCa2+濃度を検出するのが困難でした。従って、生きた動物個体内で神経入力の検出が可能なたんぱく質性赤色Ca2+センサーの開発を通して、異なる細胞種間の反応の検出を可能にするシステムの構築が望まれていました。
<研究の内容>
これまで困難であった高頻度神経発火の計測を可能にするには、複数の活動電位シグナルが生じた際に起こる蛍光強度増強を線形性に確保することが重要です。また、緑色のCa2+センサーの改良はこの数年で飛躍的に進んだにもかかわらず、多色同時計測や脳深部などへの応用が期待される赤色Ca2+センサーの開発は遅れていました。そこで本研究では、従来の赤色Ca2+センサーの中で最も高性能なR-CaMP1.07の基本骨格を出発点とし、改良を加える箇所としてカルシウムが結合したたんぱく質のカルモジュリン(CaM)結合領域に着目しました。本研究グループは、これまでにカルシウム・カルモジュリン依存性プロテインキナーゼキナーゼ(CaMKK)のCaM結合領域がCa2+/CaMに対して高親和性であることを示唆する結果を見いだしていました。従来のCa2+センサーのほとんどは、CaM結合領域としてM13というCa2+結合配列が用いられてきましたが、本研究グループは独自の視点を基に、これを抜本的に置換し、CaMKKのCaM結合領域を参考にした全く新規の配列を挿入しました。さらに、複数個所に変異を導入し、合計で150個の候補となる変異体を作製し、高感度赤色Ca2+センサーの開発に有用なCaM結合領域変異体のスクリーニングを行いました。
その結果、既存の赤色Ca2+センサーに比べ感度が3倍向上し、かつHill係数が1付近であることから線形性が圧倒的に高いたんぱく質性高感度赤色Ca2+センサーを作出することに成功しました(R-CaMP2と命名:図1)。
脳組織中の神経活動測定におけるR-CaMP2の有用性を検証するために、遺伝子操作技術を用いてR-CaMP2またはR-CaMP1.07を強制発現させたマウス脳を用いて急性脳皮質スライス注6)を作製しました。急性脳皮質スライスにおいて最小の活動単位である単一活動電位を発生させると、従来のR-CaMP1.07発現神経細胞に比べ、R-CaMP2発現神経細胞において有意に大きい蛍光強度の応答が生じました(図2)。信号対雑音比注7)(SNR:signal to noise ratio)は4.0倍に上昇し、立ち上がり時間は2.6倍早く、減衰時定数は3.4倍早いなど、複数のパラメーターに改善があることを示しました。これらの改善されたパラメーターと一致して、従来のR-CaMP1.07発現細胞に比べ、4~8倍に相当する20~40Hzもの高周波数の発火に追従する世界最高速のたんぱく質性蛍光Ca2+センサーの作出に世界で初めて成功しました(図3)。
次に、生きた動物個体での神経活動測定におけるR-CaMP2の有用性を検証するために、麻酔下で頭部を固定したマウスの大脳皮質(バレル野注8)第2/3層)神経細胞においてCa2+イメージングを行いました(図4A)。その結果、自発的な蛍光強度の増加(Ca2+スパイク)を確実に記録することに成功しました(図4b)。また、R-CaMP2は神経発火の計測に用いるだけでなく、シナプス局所に限局したCa2+信号についても計測可能であることを見いだしました(図4c)。さらに、R-CaMP2は入力回数と蛍光強度の変化の間に強い線形の関係を有することを見いだし、単一活動電位を鋭敏に記録可能な最強の赤色Ca2+センサーであることを示しました。
生きた動物個体で神経活動・シナプス活動をモニター可能なたんぱく質性赤色Ca2+センサーの開発により、従来のCa2+センサーのみでは不可能であった2つの異なる神経細胞種の活動の同時計測が可能かどうか検証しました。その結果、哺乳類脳においてR-CaMP2と緑色Ca2+センサーを用いて、抑制性神経細胞注9)(ソマトスタチン陽性神経細胞注10))と興奮性神経細胞注11)(CaMKII陽性神経細胞注12))の同時活動イメージングに成功しました(図5)。この結果は、これまで電気生理学注13)的手法で見いだされた知見と一致して、ソマトスタチン陽性の抑制性神経細胞同士には活動パターンに強い相関が示されたのに対し、直に接している興奮性神経細胞同士では、活動パターンの同期性に大きなばらつきがあることが証明されました(図6)。この結果は2色のCa2+センサーを用いたイメージング法により、初めて2つの異なる神経細胞種の関係を明らかにできることを示したことになります。
最後に、光のみによる行動制御および神経活動計測が可能であるかどうか検証するために、自由行動中の線虫の運動制御神経細胞(抑制性神経)にチャネルロドプシン注14)と緑色Ca2+センサーを発現させ、一方その投射先である筋細胞にR-CaMP2を発現させて、それぞれの神経活動を同時計測しました。その結果、運動制御神経細胞(抑制性神経)では光照射により活動が上昇する一方で、標的である筋細胞では、Ca2+濃度の急速低下に伴い弛緩が生じ、それまで動いていた線虫を運動停止させることに成功しました(図7)。
<今後の展開>
本研究により、従来では不可能であった生きた動物個体において2つの異なる神経ネットワークの関係を解明することが可能になりました。この方法を用いることにより、行動・記憶の過程において正常な脳がどのように働いているのか調べることが可能となり、将来的には、精神疾患やアルツハイマー病などの高次脳機能障害の解明に役立つことが期待されます(図7)。
本研究は脳神経機能に着目しましたが、Ca2+は全ての細胞において重要であることから、Ca2+動態の異常が関連する循環器疾患、アレルギーなどの原因解明や創薬スクリーニングにつながることが期待されます。
<参考図>
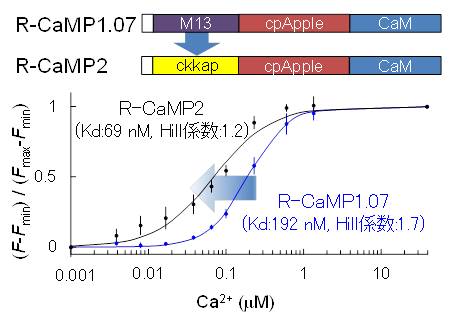
図1 高感度かつHill係数が1付近の赤色Ca2+センサー『R-CaMP2』の開発
従来の赤色Ca2+センサー(R-CaMP1.07)のCa2+結合領域(M13)をCaMKKのCa2+結合配列(ckkap)に置換することにより、Ca2+に対して高親和性かつHill係数が1付近の赤色Ca2+センサーの作出に成功した。
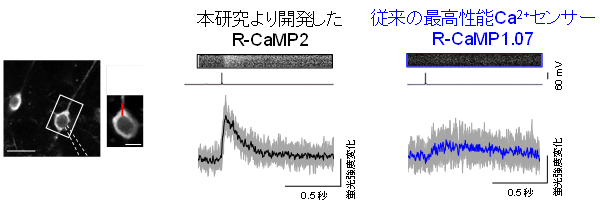
図2 急性脳スライスにおける単一活動電位に伴うCa2+イメージング
R-CaMP2の方が従来の赤色Ca2+センサー(R-CaMP1.07)よりも最小の活動単位である単一活動電位をより高感度・高速で検出できる。
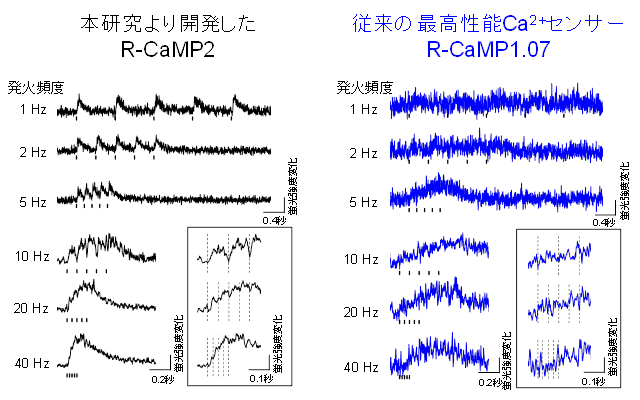
図3 急性脳スライスにおける発火頻度を変えた際のCa2+イメージング
R-CaMP2は、従来の赤色Ca2+センサー(R-CaMP1.07)に比べて8倍に相当する40Hzもの高頻度発火を検出することが可能となった。
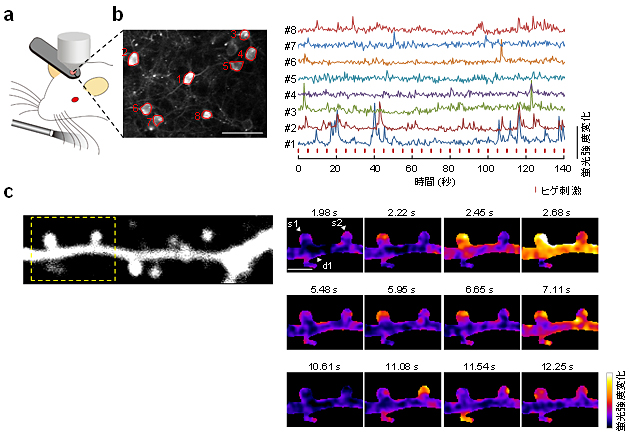
図4 生きた動物個体における大脳皮質神経細胞のCa2+イメージング
- (a) ひげ刺激によるCa2+変動を記録するための実験装置の模式図。右半球のバレル野の神経細胞の活動を記録しながら、短時間の刺激を左側のヒゲに与えた。
- (b) 生きた動物個体において、R-CaMP2は感覚誘発性Ca2+応答を記録できる。
左図:ヒゲ刺激が繰り返し行われる際の神経細胞内の蛍光変化を画像化した。右図:左図から8つの興味領域(#1-#8)のCa2+応答の代表的なトレース。縦線(赤)がヒゲ刺激の時点を示している。
- (c) R-CaMP2は個々の樹状突起スパインにおけるシナプスCa2+応答を検出することができる。
左図:R-CaMP2を発現している第2/3層の樹状突起の代表画像。右図:左図のボックスで囲った領域の時系列データ。Ca2+がスパインに限局して上昇していることがわかる。
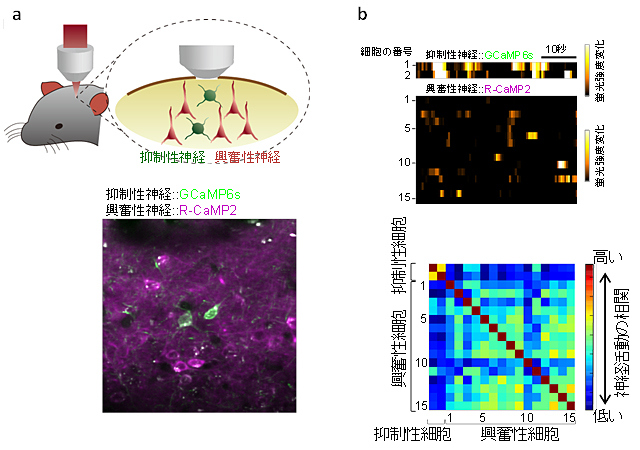
図5 生きた動物個体における2つの細胞種の神経活動の同時イメージング
- (a) 上図:抑制性神経に緑色Ca2+センサー(GCaMP6s)、興奮性神経にR-CaMP2を発現させた模式図。 下図:実際の生きた動物個体におけるイメージングの例。
- (b) 上図:(a)の図の各細胞の神経活動。異なる神経細胞種の活動を同時に可視化することが可能。下図:抑制性神経細胞同士の活動は興奮性神経細胞同士の活動よりも高く同期した神経活動が見られる。これにより、2つの異なる神経細胞種の関係を明らかにできることが示された。
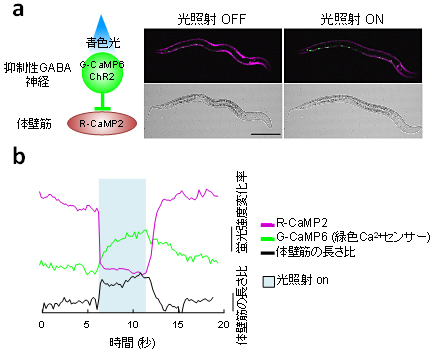
図6 自由行動下の線虫における光操作による2種類の細胞の同時計測と行動制御
- (a) 左図:線虫の運動を制御する細胞集団の模式図。抑制性GABA神経細胞は体壁筋に投射し、運動を制御している。抑制性GABA神経細胞にチャネルロドプシンと緑色Ca2+センサー(G-CaMP6)を発現させ、体壁筋にR-CaMP2を発現させた。右図:左図に従って遺伝子操作を行った線虫を用いた解析結果。抑制性GABA神経細胞は体壁筋の活動を抑制することから、光照射するとGABA抑制神経細胞の活動が上昇し(緑色蛍光増加)、投射先の体壁筋の活動は抑制され(赤色蛍光減弱)、線虫の運動は低下する。
- (b) (a)の代表的なトレースを示す。光照射により、急速に細胞内Ca2+濃度が変化し、体壁筋が弛緩。つまり、実用的な赤色Ca2+センサーの開発により、光のみで行動の制御と2種類の細胞集団の活動を計測できるようになった。
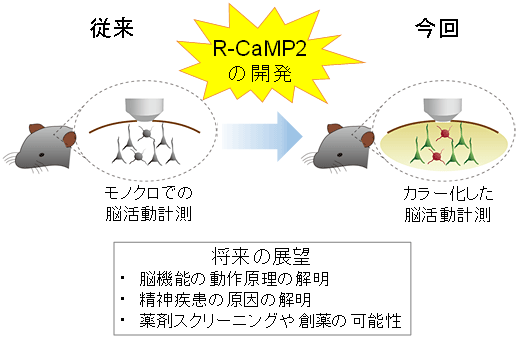
図7 R-CaMP2の開発による本研究の意義
これまで生きた動物個体で測定できるのは緑色Ca2+センサーのみだったため、モノクロの世界であったが、赤色のCa2+センサーのR-CaMP2を開発したことにより、生きた動物個体での脳活動の計測をカラー化することに成功した。これにより、異なる神経細胞種間の関係を明らかにすることが可能となり、行動、記憶の過程における神経回路ネットワークの動作原理をはじめとして精神疾患などの病態を解明することが期待される。また、Ca2+動態の異常が関連する疾患の原因解明や創薬スクリーニングにつながることが期待される。
<用語解説>
- 注1) 高頻度神経発火
- 神経細胞の膜電位が活動電位に達することを発火といい、発火することにより上流の神経細胞から下流の神経細胞へ情報を伝達する。高頻度神経発火時に記憶が成立するなど特定の情報が伝達されるのに重要な役割を担うと考えられている。
- 注2) 光遺伝学
- 光によって活性化されるたんぱく質を特定の細胞に発現させ、その機能を光で操作すること。従来の電気生理学的手法に比べて、特定の神経細胞の活動を高い時空間精度で正確に操作することが可能となる。神経回路機能を解明しようとする研究手法のこと。
- 注3) 線虫
- 1個体が1,000個程度の細胞からなり、そのうち302個の細胞が神経細胞である小さな生物。生きたまま顕微鏡下で観察、同定が可能。神経回路ネットワークが完全に明らかにされており、広く研究に利用されている。
- 注4) Hill係数
- 本研究の場合、Ca2+と蛍光強度変化の協同性を示す指標として用いられる。Hill係数が1より大きいほど協同性が高く、Ca2+に対する蛍光強度は正の協同性が現れ、非線形的な変化を示す。
- 注5) 活動電位
- 神経細胞がほかの神経細胞に情報を伝える際に、0.5-1ミリ秒の間だけ神経細胞の膜電位がマイナスからプラスに変化すること。
- 注6) 急性脳皮質スライス
- 深く麻酔をかけたマウスを安楽死させた後、目的の脳領域を切り出し、切片にしたもの。生存時に近い状態で細胞活動の記録が可能である。
- 注7) 信号対雑音比(=シグナル・ノイズ比)
- 信号(シグナル)に対する雑音(ノイズ)がどの程度かを示す指標。信号対雑音比が大きいほど、シグナルの検出が容易である。
- 注8) バレル野
- 齧歯類に特徴的なヒゲからの情報を処理する大脳皮質領域。バレル野においてヒゲの位置に一致した体性感覚地図を表現している。
- 注9) 抑制性神経細胞
- 抑制性神経伝達物質であるGABAを放出し、ほかの神経細胞の活動を抑制する神経細胞。
- 注10) ソマトスタチン陽性神経細胞
- ソマトスタチンは特定の抑制神経細胞を標識するのに用いられる。抑制性神経細胞には、形態や投射相手、発現分子の異なるサブタイプが存在する。ソマトスタチン陽性細胞は大脳皮質の20%程度を構成する一部の抑制性神経細胞である。
- 注11) 興奮性神経細胞
- 興奮性神経伝達物質であるグルタミン酸を放出し、ほかの神経細胞の活動を興奮させる神経細胞。
- 注12) CaMKII陽性神経細胞
- CaMKII(Ca2+/カルモジュリン依存性プロテインキナーゼII)は、興奮性神経細胞に豊富に存在するたんぱく質であり、興奮性神経細胞を標識するのに用いられる。
- 注13) 電気生理学
- 神経、脳、筋肉、心臓などの組織または細胞の電気的性質と生理機能との関係を解明する学問。特に神経生理学では電気生理学的手法を用いて、脳機能を解明しようと50年以上前から用いられている手法である。
- 注14) チャネルロドプシン
- 緑藻植物のクラミドモナスから単離された光駆動性の陽イオンチャネル。青色の光が当たると外部から陽イオン(ナトリウムイオンなど)を細胞内に通す。神経細胞に強制発現させ、青色光を照射すると、ナトリウムイオンが細胞内に流入し、脱分極により神経細胞が興奮することから、特定の神経細胞の活動を制御するために使用されている。
<論文タイトル>
“Rational design of a high-affinity, fast, red calcium indicator R-CaMP2”
(高感度、高速赤色カルシウムインディケーターの合理的設計による開発)
doi: 10.1038/nmeth.3185
<お問い合わせ先>
<研究に関すること>
尾藤 晴彦(ビトウ ハルヒコ)
東京大学 大学院医学系研究科 脳神経医学専攻 神経生化学分野 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3560 Fax:03-3814-8154
E-mail:
<JST事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
東京大学 大学院医学系研究科 総務係
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3304 (内線:23304)