ポイント
- 線虫が嫌いな刺激に馴れる度合いを基準に、記憶を数値化する装置を開発。
- 嫌いな刺激に馴れるために必要な2つの神経細胞を発見。
- 馴れた状態の維持に関わる新たな神経回路モデルを提案。
JST 戦略的創造研究推進事業において、JSTの杉 拓磨 さきがけ研究者(兼 京都大学 物質-細胞統合システム拠点 特任助教)らは、線虫の記憶を迅速に数値化する装置を開発し、動物が嫌いな刺激に馴れる際の仕組みの一端を解明しました。
動物は、先天的に嫌いで、逃げてしまうような刺激であっても、刺激にさらされ続けると馴れてしまい、次に同じ刺激が訪れた際には行動を変えます。馴れるためには、過去に体験した刺激を学習し、記憶する必要があります。そのため、この「馴れ」の現象は、脳神経科学の分野において、古くから、学習・記憶のメカニズムを解析するモデル系の1つとされてきました。しかし、膨大な数の神経細胞から構成される脳神経系で、「馴れ」に関わる神経細胞を見つけ出し、その細胞だけを特異的に分子レベルで解析することは容易ではありません。また、学習・記憶の度合いを数値化して比較できるシンプルな実験系がほとんどないことから、解析実験に難がありました。
一方、線虫C.エレガンス 注1)も、ほかの動物同様、体験した刺激を学習・記憶する能力があり、先天的に嫌いな刺激でもさらされることで馴れます。そこで、杉研究者は、この線虫の馴化学習・記憶現象注2)に着目し、馴れる前後の行動量を指標として記憶を数値化することを試みました。そして、全自動で迅速に数値化可能な装置の開発に成功し、馴れる前後の行動量を指標に記憶を数値化して比較できるようになりました。また、記憶保持の目印分子CREBのリン酸化注3)を細胞特異的に阻害することで、嫌いな刺激に馴れる際、刺激の記憶に関わる2つの神経細胞を発見しました。そして、これら2つの神経細胞の性質から、馴れた状態を安定的に維持することを可能にする神経回路モデルを提案しました。
線虫の遺伝子の約40%はヒトの遺伝子と同じであり、今回、明らかになった仕組みをさらに解析することで、ヒトの認知機能を解明するための手がかりが得られる可能性があります。
本研究は、京都大学 大学院工学研究科の白川 昌宏 教授、五十嵐 龍治 さきがけ研究者の協力を得て行いました。
本研究成果は、2014年11月17日(米国東部時間)の週に米国科学アカデミー紀要(PNAS)のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「細胞機能の構成的な理解と制御」
(研究総括:上田 泰己 東京大学 大学院医学系研究科) |
| 研究課題名 |
「記憶の具現化」 |
| 研究者 |
杉 拓磨(科学技術振興機構 さきがけ研究者) |
| 研究実施場所 |
京都大学 物質-細胞統合システム拠点 |
| 研究期間 |
平成24年10月~平成28年3月 |
<研究の背景と経緯>
動物は、生まれつき不快に感じるような刺激に対しても、何度もさらされて害がないことを学んで馴れることにより、周囲の環境に適応します。身近な例として、われわれヒトでも、ストレスを感じる環境にあった場合、次第に、これに馴れることがあります。不快な刺激に対し、馴れるという現象の多くは、学習・記憶をベースにした現象です。そのため、馴れの仕組みを明らかにすることは、学習・記憶の仕組みの解明に直結することから、半世紀以上前から、神経科学の分野で精力的に研究が進められてきました。
学習・記憶の研究においては、近年、記憶形成の目印ともいえる転写因子CREBの活性を1つの指標として、記憶を保持する神経細胞の探索が行われてきました。その結果、記憶は脳神経回路内の特定の神経細胞集団により担われ、これらの細胞がネットワークレベルで記憶を保持することが示されてきました。また、ネットワーク内の個々の神経細胞レベルでも記憶を担う可能性が示されています。これらの研究のさらなる進展とともに、脳神経科学における次なる課題は、「記憶を担う神経細胞はいかに記憶を保持するのか」という問いを分子レベルで追求することです。しかし、一般的に、動物の脳神経系は極度に分化した膨大な数の神経細胞から構成されるため、記憶を保持する神経細胞を見つけ、その分子レベルでの仕組みを理解することは容易ではありません。
C.エレガンス と呼ばれる線虫は、たった302個の神経細胞しかないシンプルな神経系にも関わらず、匂い、温度、物理的な刺激などを記憶・学習できる能力をもつことが知られています。線虫の示す記憶現象の中でも、特に、接触刺激や振動などの物理的な刺激を馴化学習し、記憶する能力は、1990年代初頭から知られていました。例えば、線虫の飼育プレートを振動させると、まるで刺激から逃げようとするかのように後ずさりします(図1上)。そして、この物理的な刺激に応答するための神経回路は、過去のレーザーによる神経細胞の破壊実験によって同定されていました(図1下)。このように、線虫の物理的な刺激の馴化学習・記憶現象は実験系として非常に魅力的です。しかし、科学的な解析が難しいことから精力的には研究されておらず、特に分子レベルの解析はほとんど行われていませんでした。
<研究の内容>
線虫は、振動などの物理的な刺激を感じた際の後ずさり行動は、6時間程度、定期的に刺激を与えておくと減少します。そこで、杉研究者らは、後ずさりの際の移動量を数値化したときの値を指標にすることで、記憶を定量化できるのではないかと考えました。ただ、一言で振動刺激を与えると言っても、単にアクチュエータで飼育プレートを叩くだけでは、飼育プレートの変形に伴う刺激の分散が起き、うまく後ずさり行動を確認することはできませんでした。また、馴化のトレーニング時に一定の強さの振動を自動で与え続けることや、移動量を精確に測ることなどに実験者の充分な修練が必要で、しかも修練したとしても、一度に計測できるのは実験者一人当たり1種類の線虫集団だけであるため、全自動で実験を行うことのできる装置を作製しました(図2)。この装置は以下のことが実施可能です。
- 振動刺激を、定期的に精度よく同時に複数の線虫集団(約30個体を9群)に全自動で与える。
- 刺激を受けた複数の線虫集団の全ての移動量を同時に測り、数値化する。
- 細胞特異的に遺伝子を導入した線虫(トランスジェニック線虫注4))が発する蛍光を検出、その遺伝子を持たない線虫(非トランスジェニック線虫)が混在する中から自動で識別する。
この装置を利用して、まず、6時間トレーニングを受けた集団と受けなかった集団に、18時間後再び振動を与え、その移動量を比較しました。その結果、トレーニングを受けた方の線虫集団は、受けなかった方の線虫集団に比べ、明らかに移動量が減少していました(図3)。この移動量の差は、線虫が記憶学習したかどうかの差を示していると捉えられます。
次に、トレーニングによって線虫の神経細胞内で、実際に記憶が形成されているかどうかを調べるため、記憶形成の目印分子CREBのリン酸化が進むかどうかをウエスタン・ブロッティング法注5)により確認しました。その結果、トレーニングの経過とともにCREBのリン酸化が進み、トレーニング終了後もCREBのリン酸化は維持される(図4)ことから、トレーニングの結果として線虫の神経系で、何らかの記憶が行われていることが示されました。
さらに、このリン酸化がどの神経細胞で起こっているのかを明らかにすることを試みました。物理的な刺激に応答するための神経回路内の細胞のそれぞれにCREBのリン酸化を阻害する遺伝子を導入した線虫について、トレーニングありなしの移動量の差を計測しました(図5)。その結果、意外なことに、それぞれの神経細胞内で単独に阻害した線虫はいずれも、トレーニングの結果、阻害していない線虫同様に刺激後の移動量が低下し、刺激に馴れた状態が維持されていました。しかし、AVAとAVDと呼ばれる2つの神経細胞におけるCREBのリン酸化を同時に阻害した線虫は、トレーニング後、移動量が低下せず、馴れた状態が全く維持されていないことが示されました。
この結果から、まず、2つの神経細胞AVAとAVDが馴れの記憶に関与することが示されました。後方移動を促進する中心的な伝達経路(図1下)のうち、2つの神経細胞を同時に阻害した線虫にのみ記憶の異常が見られたことは、刺激への馴れの記憶の冗長性を示していると解釈されます。つまり、仮に、AVD神経細胞で記憶に異常が起こった場合でも、AVA神経細胞の記憶が存在するため、図6の神経伝達は遮断され、後方移動は行われません(馴化状態)。従って、記憶が完全に異常になるのは、AVAとAVDの両方の神経細胞の記憶が異常になる場合のみであることから、記憶の安定的な維持に有利に働くと考えられます。このような神経回路モチーフは哺乳類などでも頻繁に見られることから、本研究で明らかにされた仕組みは、哺乳類における馴れの仕組みと共通していることが期待されます。
<今後の展開>
今回、物理刺激の馴れについてのシンプルな実験系を整備することに成功し、記憶を数値化して迅速に解析することが可能となりました。近年、物理刺激の適応応答に関する研究は、
メカノバイオロジー注6)と呼ばれ、注目されています。未知のことが多く残されていますが、本研究成果によって、今後、解明に向けた研究が加速するものと期待されます。
また、馴れの仕組み、さらには記憶の分子メカニズムの解析については、線虫が物理的な刺激に馴れる際に神経細胞AVAとAVDが記憶を保持する分子メカニズムの解析が進むものと想定されます。例えば、記憶の分子的実体として予想される分子の遺伝子をAVAとAVDの両神経細胞に導入することにより、定期的な刺激を加えずとも、あたかも刺激を記憶したような状態を創りだす構成的な実験を行い、記憶形成に関わる分子の候補を絞り込む実験も可能です。
さらに、記憶は、通常、CREBに代表される転写因子が遺伝子発現を調節することにより制御されることが知られます。従って、最新のゲノム編集技術注7)を応用すれば、記憶が刻まれていると予想される遺伝子領域を人為的に操作し、記憶を再構成する実験が可能となります。これらの実験から記憶の分子的実体に迫ることにより、記憶障害などが関わる疾患の理解と、その分子標的薬の開発につながることが期待されます。
<参考図>
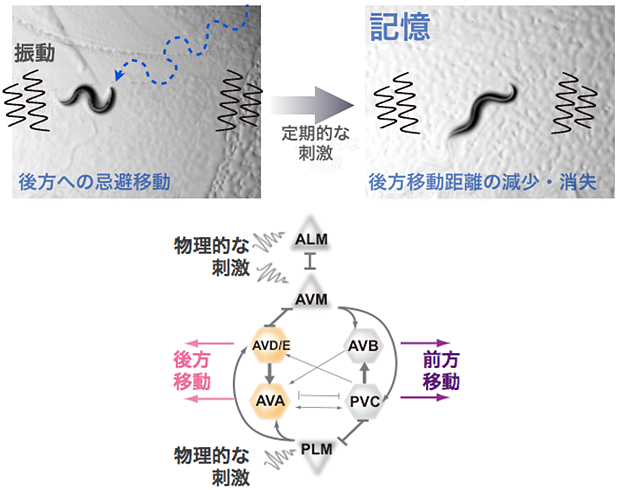
図1 線虫C.エレガンスの物理的な刺激の馴化学習・記憶現象と神経回路
- (上段・左)線虫は、通常、接触刺激や振動などの物理的な刺激を感じると、忌避するように後ずさりする。
- (上段・右)6時間程度断続的に刺激を与え続けると、この刺激に馴れ、18時間後に再び刺激を与えても顕著に後ずさりする量が減少、もしくは消失する。そこで、馴れる前後の移動距離を数値化して比較できれば、線虫の記憶を定量化できると考えた。
- (下段)物理的な刺激への応答行動を司る神経回路。三角形で記した感覚神経細胞ALMとAVMは線虫の前方部分にあり、これらの神経細胞が刺激されると、介在神経細胞AVA、AVD、AVEを介して後方移動が促進される。一方、感覚神経細胞PLMは線虫の後方部分にあり、この神経細胞が刺激されると介在神経細胞AVBとPVCを介して前方移動が促進される。海外の研究グループからは、物理的な刺激に馴れる過程で、AVAとAVDが周囲の神経細胞とのシナプス強度を変化させることが示されている。
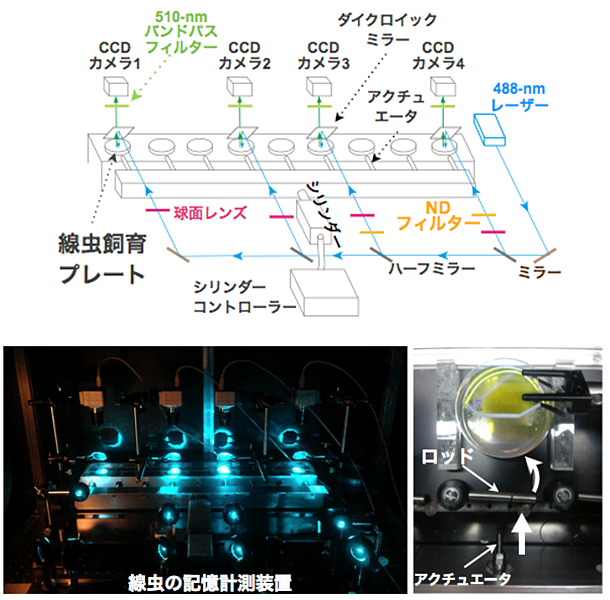
図2 線虫の物理的な刺激の記憶を定量化する装置
- (上段)線虫の記憶計測装置の概略。線虫の飼育プレート上には、約30個体の線虫が同調された状態で飼育されている。9枚の飼育プレートを並列に並べ、全てのプレートに同時に振動刺激を加えることができる。作成したソフトウエアにより、4つのUSB接続型CCDカメラで捉えた飼育プレート上の線虫の刺激応答行動を同時に録画できる。また、レーザー光源を1つ備えており、ミラーで分岐させることで4つの飼育プレートに照射可能。GFP(緑色蛍光たんぱく質)を持つ線虫のみの行動を計測できる。
- (下段・左)線虫の記憶装置の実物写真。
- (下段・右)線虫への振動刺激の付与部分。シリンダー先端部のアクチュエータのピストン運動により、ロッドが回転し、飼育プレートへ物理的な振動刺激が加わる。ロッドとアクチュエータ先端を紐で結ぶことにより、アクチュエータがもとの位置に戻ると同時に、ロッドももとの位置に戻る。
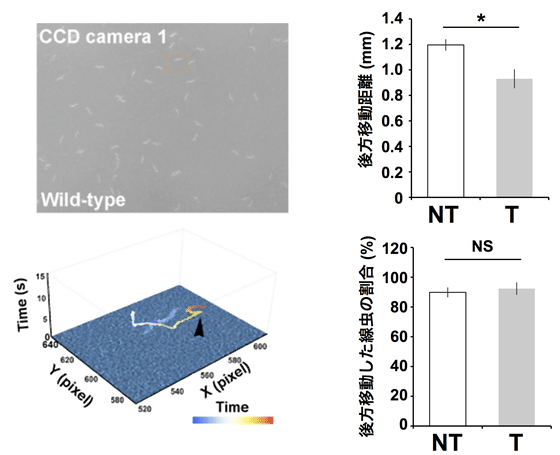
図3 記憶計測装置による、線虫のトラッキングと後ずさりの移動量変化
- (左) 記憶計測装置を用いた線虫の観察像と、観察像から特定の線虫の移動の足跡をプロットしたもの。Z軸は、振動を与えた直後を0秒としたときの経過時間(秒)を表す。黒の矢頭は、後ずさりし終わった箇所を示す。記憶計測装置は、視野内の全ての線虫の動きを追跡し、後ずさりが終わった箇所を自動判定し、その移動量を記録する。
- (右) 6時間トレーニングを受けた線虫集団と受けなかった線虫集団に、18時間後再び振動を与え、その移動量を比較した。トレーニングを受けた方の線虫集団は、受けなかった方の線虫集団に比べ、移動量が減少した。一方で、振動に反応した線虫の割合はトレーニング直後には異なることが知られるが、トレーニングから18時間後には違いが見られなかった。NTはトレーニングなし、Tはトレーニングありをそれぞれ示す。
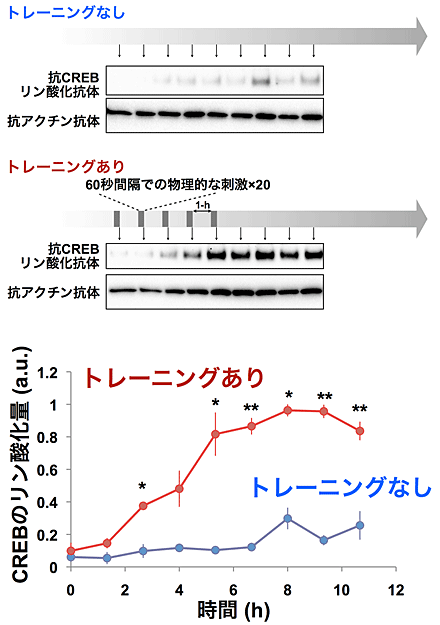
図4 開発した装置による物理刺激に対するトレーニングとCREBのリン酸化の亢進
- (上)物理的な刺激のトレーニングによるCREBリン酸化の亢進。開発した装置を用いて、線虫に対し、振動刺激への馴化トレーニングを行い、80分ごとに線虫を回収し、凍結保存。馴化トレーニングは、60秒に1回の物理的な振動刺激を20回加えるトレーニングを1ブロックとして、1時間おきに5ブロック繰り返した。凍結保存した線虫を同時に破砕し、抗CREB抗体を用いたウエスタン・ブロッティング法により、CREBのリン酸化を検出。時間0は最初のトレーニング直後で5時間40分後までがトレーニング期間。アクチンはコントロール。
- (下)上図のウエスタン・ブロッティングのバンドの濃度を相対的に数値化し、グラフに表す。トレーニングを行わなかった線虫集団はCREBのリン酸化亢進がほとんど起こらなかったが、トレーニングを実施した線虫集団はCREBのリン酸化の亢進が見られる。
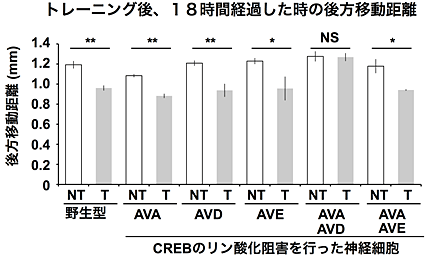
図5 細胞特異的なCREBリン酸化の阻害実験による、馴れの記憶に関わる神経細胞の同定
記載の神経細胞にCREBのリン酸化を阻害する遺伝子を導入し、トランスジェニック線虫株を準備。それぞれの線虫集団を開発した装置によりトレーニングし、18時間経過したあとに、振動刺激を与え、後方移動距離を定量化。本装置により、迅速に実験が行えるため、各トランスジェニック線虫株につき、1度の行動実験で、約30個体の線虫の行動観察を行い、その平均を1回の結果とし、3回以上繰り返し、統計処理。NTはトレーニングなし、Tはトレーニングありをそれぞれ示す。
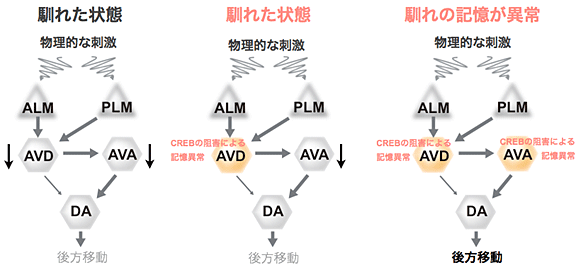
図6 馴れの記憶を安定的に維持する神経回路モデル
- (左)物理的な刺激に馴れていない場合、刺激に対し、ALM(PLM)→AVD→AVA→DAの順に神経活性が伝達され、忌避的な後方移動が引き起こされると考えられている。本研究から、物理的な刺激のトレーニングを受けたあとは、物理的な刺激が与えられても、AVDとAVAの神経活性が上昇しなくなっているために、後方移動が起こらない(馴れた状態)になると考えられた。
- (中央)AVD神経細胞のみのCREBのリン酸化を阻害した場合(AVDのみ記憶形成に関与できない場合)でも、AVA神経細胞の神経活性は上昇しないため、馴化した状態となる。
- (右)AVDとAVAの神経細胞両方のCREBのリン酸化を阻害した場合のみ、馴化記憶に完全に異常となる。
<用語解説>
- 注1) 線虫C.エレガンス
- 土壌に生息する非寄生性の線虫で、正式名称はセノバブダイティス・エレガンス。古くから分子遺伝学的解析に使われており、細胞死の発見、RNA干渉の発見、GFPの個体レベルでの応用により2002年と2006年のノーベル医学生理学賞、2008年のノーベル化学賞の対象となった。1998年には多細胞生物で初めて全ゲノム配列の解読が終了した。ヒトの遺伝子数と同程度の約2万個の遺伝子を持ち、それらの中にはヒトの遺伝子と類似したものが40%弱も含まれる。生命現象の分子メカニズムを解析する上で有用なモデル生物である。体が透明なため、体外から体を傷つけずに蛍光観察できる。
- 注2) 線虫の馴化学習・記憶現象
-
線虫は、通常、接触刺激や振動などの物理的な刺激を感じると、忌避するように後方へ後ずさりする。しかし、6時間程度、定期的に刺激を与え続けると、この刺激に馴れ、24時間後に再び刺激を与えても、後方への移動距離の顕著な減少・消失が見られる。この後方への移動距離の減少量を定量化することにより、線虫の記憶を定量化が可能であることが知られていた。同様の現象は、ほかのモデル生物でも知られ、アメフラシにおける記憶現象の研究からは、転写因子CREBが発見され、2000年のノーベル医学生理学賞の受賞対象となった。
- 注3) CREBのリン酸化
- CREBは、cAMP response element−binding proteinの略で、cAMP response element(CRE)に結合し、転写を制御する転写因子。カルシウムやcAMPなどの細胞内シグナルの下流で、記憶形成に関わる因子として知られる。CREBのリン酸化は転写活性化のスイッチとなり、長期的な記憶の維持を導く。
- 注4) トランスジェニック線虫
- 遺伝子導入により得られた線虫。線虫では、通常、導入遺伝子が染色体に組み込まれず、染色体外で保持されるため、1個体のトランスジェニック線虫からは、導入遺伝子を持つ個体と持たない非トランスジェニック個体の両方が産まれる。
- 注5) ウエスタン・ブロッティング法
- 目的のたんぱく質やたんぱく質内の特定の翻訳後修飾部位を抗原として、それらの抗原に特異的に反応する抗体を用い、抗体-抗原反応により、抗原を検出する方法。生化学的な実験のなかでも代表的な方法として知られる。
- 注6) メカノバイオロジー
- 細胞内もしくは細胞外において発生する物理的な‘力’に対して、生体内分子、細胞や個体が応答する際の仕組みを調べる学問。生物学と工学を融合した新しい研究領域。
- 注7) ゲノム編集技術
- 人工ヌクレアーゼを利用することにより、ゲノム上の目的遺伝子を改変するための技術。近年、さまざまな生物種で利用され、注目を集めている。主な手法としては、古くから確立されていたZFN(Zinc−finger nuclease)、さらには近年、確立されたTALEN、CRISPR/Cas9システムの3つがよく知られる。線虫では、2011年に初めて応用された。ヌクレアーゼの代わりに、VP64などの人工転写活性化ドメインを利用することにより、目的遺伝子の発現制御なども行える。
<論文タイトル>
“High-throughput optical quantification of mechanosensory habituation reveals neurons encoding memory in Caenorhabditis elegans”
(線虫における物理的刺激の馴化学習・記憶の定量化により明らかにされた記憶を担う神経細胞)
doi: 10.1073/pnas.1414867111
<お問い合わせ先>
<研究に関すること>
杉 拓磨(スギ タクマ)
科学技術振興機構 さきがけ研究者
京都大学 物質-細胞統合システム拠点 特任助教
〒615-8530 京都府京都市西京区京都大学桂 桂インテックセンター 308号室
Tel:090-1714-9717 Fax:075-383-2541
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ)、山岸 裕司(ヤマギシ ユウジ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
京都大学物質 細胞統合システム拠点(iCeMS)
〒606-8501 京都府京都市左京区吉田牛ノ宮町 iCeMS本館
Tel:075-753-9755 Fax:075-753-9759
E-mail: