ポイント
- 哺乳類の体内時計は発生分化過程を通して形成されると考えられている。
- 体内時計の発生は、細胞分化と密接に関連したメカニズムによって起こることを発見。
- マウス胚性幹細胞(ES細胞)で体内時計が抑制される仕組みを解明。
- 体内時計と「がん」との関連性の理解に役立つ発見であり、新たな応用法の開発に期待。
京都府立医科大学 大学院医学研究科 八木田 和弘(やぎた かずひろ)教授と梅村 康浩(うめむら やすひろ)助教らの研究グループは、マウス胚性幹細胞(ES細胞)を用いて細胞分化と密接に関連した体内時計の発生メカニズムを解明しました。哺乳類では体内時計は発生過程を通して形成されると考えられていますが、そのメカニズムは不明でした。八木田教授は以前にも、マウスES細胞に体内時計のリズムが見られず、培養皿上で分化誘導培養することにより細胞自律性に体内時計が形成されることを発見していました。今回、マウスES細胞を用い、「細胞分化の制御因子が関わる体内時計発生メカニズム」および「ES細胞で体内時計のリズムが阻害されるメカニズム」を解明するとともに、細胞分化異常によって正常な体内時計が形成されないことを示し、細胞分化と密接に関連する体内時計の発生メカニズムを世界で初めて明らかにしました。
本研究で、細胞分化と体内時計という普遍的な細胞機能に、これまで考えられていなかった新たな関係性を見いだしたことで、混沌として統一的見解が無かった体内時計と「がん」との関係の理解や、新たな体内時計の活用法開発などの応用にもつながると期待されます。
本研究は、米国テキサス大学のジョセフ・タカハシ 教授、大阪大学の安原 徳子 博士(現 医薬基盤研究所)らと共同で行ったものです。
本研究成果は、独立行政法人 科学技術振興機構(JST) 戦略的創造研究推進事業の一環として行われ、2014年11月10日の週(米国東部時間)に米科学雑誌「アメリカ科学アカデミー紀要」のオンライン速報版に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「iPS細胞と生命機能」
(研究総括:西川 伸一 JT生命誌研究館 顧問/NPO オール・アバウト・サイエンス・ジャパン(AASJ) 代表理事) |
| 研究課題名 |
「リプログラミング技術で解く細胞分化と時計機構の関係」 |
| 研究者 |
八木田 和弘(京都府立医科大学 統合生理学 教授) |
| 研究実施場所 |
京都府立医科大学 |
| 研究期間 |
平成22年10月~平成26年3月 |
<研究の背景>
地球上のほとんどの生物に備わる体内時計(生物時計・概日時計)は、「昼と夜」という地球の環境周期を予測し、これに先んじて身体の機能を適応させることで生体機能を維持する役割を担っています。ヒトをはじめとする哺乳類では、睡眠覚醒リズムのみならず、内分泌やエネルギー代謝、循環器機能や消化器機能など様々な生理機能の約24時間周期のリズム(概日リズム)を生み出し、心身の健康維持に必須の生命機能です。シフトワーカーなど、不規則な生活を長年続けることによる体内時計の乱れは、様々な健康問題を引き起こすことが分かっています。
哺乳類の体内時計は、司令塔である視交叉上核注1)のみならず全身のほとんどの細胞に備わっている、普遍的な細胞機能でもあります。体内時計は一生にわたって時を刻み続けますが、発生初期段階では体内時計のリズムが見られず、発生過程を通して形成されると考えられています。しかし、これまで、体内時計の発生メカニズムはほとんど分かっていませんでした。
八木田教授は、これまで、マウスES細胞を用いた独創的なアプローチにより、ES細胞に体内時計のリズムが見られないこと、ところが培養皿上で分化誘導培養することで細胞自律性に約24時間周期の体内時計リズムが形成されること、を世界で初めて発見し、哺乳類体内時計の発生メカニズム研究にブレークスルーをもたらしました(図1)。この研究から、体内時計の発生が細胞分化制御と何らかの関連があるのではないかということが示唆されていました(Yagita et al, PNAS, 2010)。
妊娠中の母親や子どもの生活リズムの乱れが、子どもの心身に影響するのではないかという可能性も指摘されている中で、体内時計の発生メカニズムの解明は極めて重要な医学生物学上の課題です。しかし、その実体はほとんど分かっておらず、メカニズムの解明が待たれていました。
<研究の内容>
八木田教授らは、マウスES細胞を利用し、体内時計が形成される過程を定量的に評価できる「in vitro 体内時計形成法」と名付けた新規培養法を開発しました(図2)。体内時計は、「時計遺伝子」と呼ばれる10数個の遺伝子群が構成する「転写のフィードバックループ」によって分子レベルでの24時間周期のリズムを生み出しています。この時計遺伝子の発現をホタル由来の発光レポーターで可視化し、この発光の強さの変化を測定することで、生きたままの細胞の体内時計をリアルタイムモニターできます。時計遺伝子の発光レポーターを組み込んだマウスES細胞を用いて球状の細胞塊(胚様体)を形成させてプレートに播種します。その後は、ただ2~3日に一度の頻度で培養液を交換するだけで、細胞が自然と分化していくという、極めて簡単な培養法です。この方法で分化させた細胞を発光測定装置で計測するときれいな発光リズムが検出できます(図2)。この培養法は、今後、様々な薬剤や化合物のスクリーニングを行うことを想定して構築したもので、定量性と簡便性を兼ね備えた体内時計評価系として活用できます。
この方法を用い、細胞分化と関連する様々な遺伝子を欠損したES細胞および遺伝子改変ES細胞の分化に伴う体内時計の形成を評価しました。その結果、細胞分化と密接に関連し、DNAメチル化を制御するDnmt1(DNAメチル基転移酵素1)欠損ES細胞やc-Myc発現誘導ES細胞では、分化誘導培養によっても体内時計の形成が見られないことを発見しました。つまり、正常な細胞分化過程から逸脱し、分化異常が起きると体内時計が正常に形成されないことが明らかとなりました。
続いて、未分化のES細胞を含め、これら体内時計リズムが無い細胞に共通する現象を解析した結果、正常な体内時計を持つ線維芽細胞注2)などでは、周期的に核内に蓄積されるはずのタンパク質で体内時計のリズム発振に必須のPERIOD(PER)が細胞質に留まり、その結果核内蓄積が起こらないことが分かりました。この現象は、体内時計がリズムを刻んでいる通常の体細胞では決して見られないもので、ES細胞で時計遺伝子の発現があるにもかかわらず、全くリズムが刻めない理由の一つとなる重要な発見です。
さらに本現象を制御する鍵因子を同定するために、次世代シーケンサーを用いた網羅的遺伝子発現解析を行い、得られた候補因子の中からタンパク質の核内への移行を制御するインポーチンの一種であるKPNA2/Importin-αに注目しました。KPNA2/Importin-α2は細胞分化制御に関わるタンパク質の細胞内局在を調節する働きがあることが知られています。KPNA2/Importin-α2を過剰発現させた細胞では、細胞分化に伴う体内時計の発生が強く阻害され、PERタンパク質の細胞内局在パターンにも異常を来すことが確認されたことから、これが細胞分化に伴う体内時計の発生を制御する鍵因子であると結論づけました。KPNA2/Importin-α2は、細胞分化制御に必須の役割を果たす因子であり、本研究により体内時計の発生と細胞分化が切っても切れない不可分の関係にあることが世界で初めて示されました。
本研究は、Dnmt1欠損ES細胞やc-Myc過剰発現ES細胞では正常な細胞分化ができない、という性質を利用し、細胞分化と体内時計の発生をつなぐ鍵因子を探索するという方法論に基づいたものです(図3)。他にも体内時計の発生に関わる重要なメカニズムはいくつかあると思われますが、今回、世界で初めて細胞分化制御と体内時計の発生をつなぐメカニズムの実体を明らかにすることができました。
<まとめと今後の展開>
本研究成果から、細胞分化に伴う体内時計の発生メカニズムが明らかになり、子どもの心身の発達に深く関わる体内時計のメカニズムの理解が進むことに加えて、体内時計と細胞分化との関係性から細胞を考える新しい視点を提供することができました。これまで、「がん」と体内時計については10年以上にわたって数多くの研究が世界中でなされてきました。しかし、今でも、体内時計と「がん」の関係について統一的な見解は無く混沌としています。今回の研究成果は、細胞分化の視点から体内時計と「がん」の関係を体系的に理解できる可能性を示すものであり、がん研究などへの応用も期待できます。
<参考図>
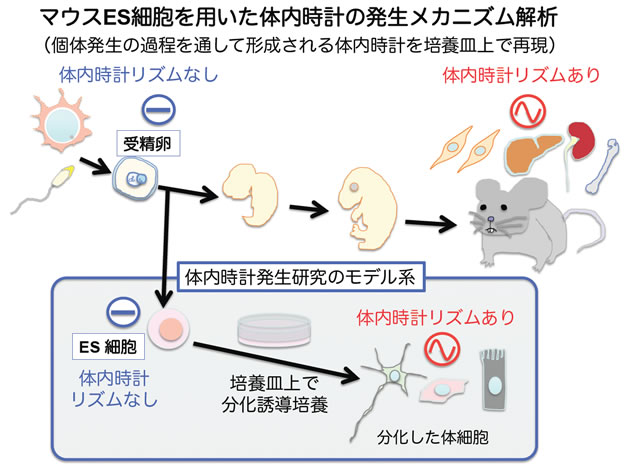
図1 哺乳類における体内時計発生の概要
マウスES細胞を応用した実験系により、体内時計の発生メカニズムを解明する。
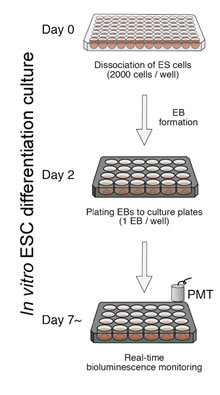
図2 体内時計の発生を定量的に解析するES細胞のin vitro分化誘導培養法
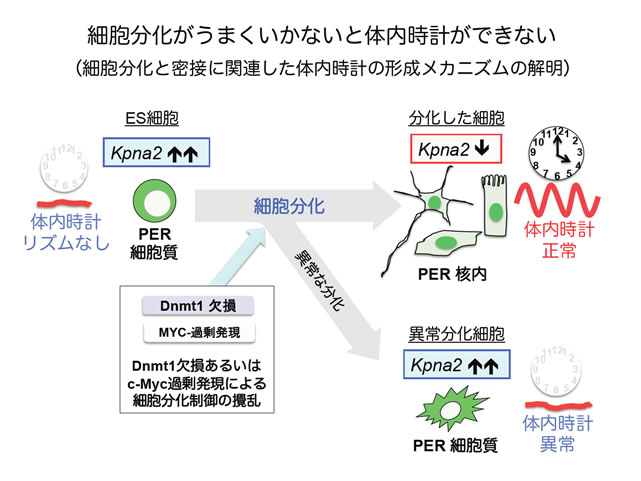
図3 細胞分化制御機構と密接に関連した体内時計発生メカニズム
緑色はPERの細胞内局在を示している。正常な体内時計を持つ線維芽細胞などでは、核内に蓄積されるはずのPERが、Dnmt1が欠損したES細胞やc-Mycを発現誘導したES細胞ではPERが細胞質に留まっている。これは、ES細胞で時計遺伝子の発現があるにもかかわらず、体内時計がリズムを刻めない理由の一つとなる。
<用語解説>
- 注1) 視交叉上核
- 脳の視床下部という部位にある神経核(神経細胞の集まり)。視神経が交叉する視交叉の上に乗っているような形から、視交叉上核と名付けられた。
- 注2) 線維芽細胞
- 結合組織を構成する細胞の一種で、コラーゲンなどの細胞外マトリックスを産生する。
<発表雑誌>
掲載雑誌名:Proceedings of the National Academy of Sciences U.S.A.(アメリカ科学アカデミー紀要)
論文タイトル:“Transcriptional Program of Kpna2/Importin-α2 Regulates Cellular Differentiation-Coupled Circadian Clock Development in Mammalian Cells” by Umemura et al.
doi :10.1073/pnas.1419272111
<お問い合わせ先>
<研究に関すること>
八木田 和弘(ヤギタ カズヒロ)
京都府立医科大学 統合生理学教室 教授
Tel:075-251-5313
E-mail:
<JST事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
京都府立医科大学 研究支援課 企画担当
Tel:075-251-5208
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: