ポイント
- タンパク質AIM注1)は細胞中での中性脂肪の蓄積を阻害するメタボリックシンドロームのブレーキとして働く。
- このタンパク質は肝臓の細胞が癌化すると、細胞の表面に蓄積して癌細胞が除去されやすくする作用があることを今回明らかにした。
- 肝臓癌は有効な抗癌剤がなく治療が困難であるが、今回の発見により、AIMを利用した新規かつ安全な肝臓癌の治療法を開発できるようになることが期待される。
発表概要
東京大学 大学院医学系研究科の宮崎 徹 教授らの研究グループは、本研究グループが発見し、メタボリックシンドロームのブレーキとして働くことが知られているタンパク質AIMが、肝臓に生じた癌細胞を選択的に除去せしめる働きがあることを明らかにした。
AIMは血液中に存在するタンパク質で、通常は脂肪細胞や肝臓の細胞(肝細胞)に取り込まれ、細胞中での中性脂肪の蓄積を阻害することによって肥満や脂肪肝の進行を抑制する、いわばメタボのブレーキとして働いている。ところが今回、研究グループは肝細胞が癌化するとAIMは細胞の中には入って行かず、代わりに細胞の表面に溜まるようになることを確認した。さらに、この表面に蓄積したAIMが目印となり、細菌などから最前線で体を守る免疫の一つである補体注2)が活性化し、癌化した肝細胞を攻撃するようになることをマウスにおいて発見した。この結果、癌化した肝細胞のみが選択的に取り除かれて、肝臓癌の発症が抑えられるのである(図)。AIMを持たないマウスを作製し、このマウスに高カロリー食を食べさせて肝臓に脂肪が蓄積した状態(脂肪肝)にするだけでマウスは100%肝臓癌を発症した。しかし、このマウスにAIMを注射すると肝臓癌の発症を抑えられることが分かった。
近年、メタボリックシンドロームの流行と共に、脂肪肝が進む結果、肝細胞が癌化し肝臓癌が発症するケースが注目されている。ヒトの血液中のAIM値には個人差があり、性別、年齢などによっても異なる。したがってAIM値が低い場合は細胞が癌化しても上手く取り除かれなくなり、ヒトにおいても肝臓癌が発症しやすくなる可能性がある。以上のことから、血液中のAIM値は肝臓癌発症のリスクを予測する目印となり得ると示唆される。また、AIM投与による肝臓癌の新しい治療法を開発できる可能性も高い。特に、肝臓癌は有効な抗癌剤がなく治療が困難であるだけに期待は大きく、AIMは本来よりヒトの血液中に存在するタンパク質であるため、安全性は高いと期待される。
<発表内容>
肝細胞癌(Hepatocellular carcinoma、以後HCC)は癌による死亡原因の第3位であり、有効な抗癌剤がないため治癒が困難な癌の一つである。これまでHCCの発症原因はほとんどがC型肝炎ウイルス感染による慢性肝炎・肝硬変であり、それについでB型肝炎ウイルス、アルコール性肝硬変、ヘモクロマトーシスなどの遺伝性の肝疾患などが知られていた。近年、公衆衛生の向上や慢性肝炎の治療法の進歩により、肝炎ウイルス感染による新たなHCC発症は減少している。しかしそれに代わり注目されてきているのが、脂肪肝を基盤としたHCCである。非アルコール性脂肪肝はメタボリックシンドロームの肝臓における症状であるが、悪化すると炎症や線維化を伴った非アルコール性脂肪肝炎(NASH;non-alcoholic steatohepatitis)とよばれる症状を呈し、HCCへと進行する症例がみられる。メタボリックシンドロームの流行と共に、こうしたNASHに伴うHCCが問題になっており、今後急激に増加すると考えられている。そのため、こうした脂肪肝性のHCCの診断と治療は医学的に重要な課題の一つとなる可能性が高い。
今回東京大学 大学院医学系研究科の宮崎 徹 教授らの研究グループは、研究グループが発見し、これまでに研究を積み重ねてきた血中タンパク質AIMがHCCの新しい治療法となる可能性を明らかにした。AIMはヒトや動物の血液の中に存在するタンパク質で、血中に存在する量は個人差があり、年齢、性別あるいはいくつかの疾患によっても変動する(参考文献1)。AIMは通常、CD36などの受容体注3)を介した細胞外から細胞内への取り込み(エンドサイトーシス)によって脂肪細胞や肝細胞に取り込まれ、細胞内で脂肪酸合成酵素(Fatty Acid Synthase; FASN)の活性を阻害することにより、細胞内での中性脂肪の蓄積を抑制する(参考文献2-5)。したがって、血中のAIMは肥満や脂肪肝の進行を抑制する効果を持つ。実際、AIMを欠損したマウスは高脂肪食を与えられることによりAIMを有する普通のマウス(野生型マウス)よりも肥満や脂肪肝が顕著に認められるようになる。
ところが、この細胞に取り込まれるというAIMの特徴は細胞が癌化すると失われ、代わりに細胞表面に蓄積するようになることが確認された。AIMは本来受容体を介してシグナルを伝達する分子ではないため、AIMの蓄積自体が癌細胞に直接影響を与えることはないが、癌細胞表面上に蓄積したAIMは、体細胞上に発現し補体による傷害を抑制する複数の補体抑制分子(CD55、CD59、CFH、Curryなど)の働きを一様に低下させるため、AIMの蓄積した癌細胞は、補体にとっては体内に侵入した病原菌(菌は補体抑制分子を持たない)と同じように攻撃の対象となり、速やかに細胞死に陥ることが明らかとなった。このように、肝細胞など本来AIMを取り込む細胞が癌化すると、細胞表面に蓄積したAIMの効果により、補体がその細胞を攻撃し除去することで癌発症を抑制し、生体の恒常性が維持されていると示唆された。実際に、AIM欠損マウスでは高脂肪食を長期間与えて脂肪肝を誘導するだけで全マウスがHCCを発症するが、AIMを有する野生型マウスでは脂肪肝だけでほとんどHCC発症は認められない。この結果からヒトにおいても、血中のAIMが低いと脂肪肝からHCCを発症しやすくなると予想される。また、脂肪肝が進展したAIM欠損マウスに精製したAIMを定期的に投与するとHCC発症を抑制できることから、AIMはHCCの予防や治療に対して効果があることが分かった。
以上の研究成果から、AIMはHCCの診断と治療に新しい大きな可能性を持つタンパク質であると期待される。
なお、本研究成果は、以下の事業・研究領域・研究課題によって得られました。
JST 戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」
(研究総括:永井 良三 自治医科大学 学長) |
| 研究課題名 |
「生体内の異物・不要物排除機構の解明とその制御による疾患治療」 |
| 研究代表者 |
宮崎 徹(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成25年10月~平成31年3月 |
科学研究費補助金 基盤研究(A)
| 研究課題名 |
「肥満と肝臓疾患:NASHの病態解明を目指して」 |
| 研究代表者 |
宮崎 徹(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成25年4月~平成28年3月 |
科学研究費補助金 基盤研究(B)
| 研究課題名 |
「AIMの機能制御による炎症抑制によるメタボリックシンドロームの予防・治療法の開発」 |
| 研究代表者 |
新井 郷子(東京大学 大学院医学系研究科 特任准教授) |
| 研究期間 |
平成24年4月~平成27年3月 |
<参考図>
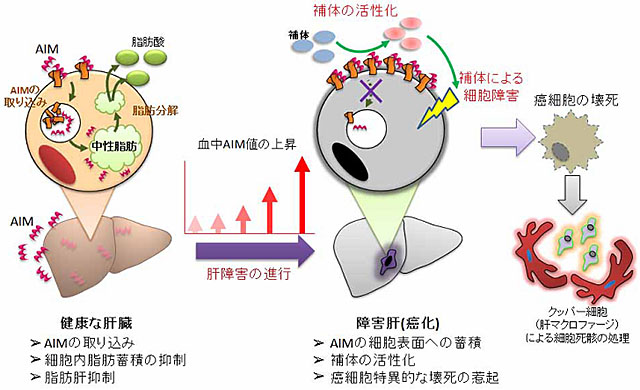
図 AIMによる肝疾患の制御
<用語解説>
- 注1) AIM(Apoptosis Inhibitor of Macrophage)
- 当初マクロファージから分泌され、細胞のアポトーシス(細胞死)を抑制する分子として本研究グループが発見したもの。その後の研究で、アポトーシスを抑制する以外にも作用する細胞の種類などの違いによってさまざまな作用があることが明らかになった。
- 注2) 補体
- 肝臓で合成され、血液中に大量に存在して免疫反応・感染防御などに関与する20種ほどのタンパク質の総称である。通常は抑制タンパク質の働きにより不活性化されており、正常な細胞や組織が補体によって傷害されることはない。何かしらの刺激を受け、かつ抑制タンパク質による不活性化が取り外されるとその活性が増殖し、対象物(病原菌やこの場合は癌細胞など)に対し殺傷性を示す。
- 注3) CD36などの受容体
- スカベンジャー受容体とは、マクロファージや脂肪細胞、肝細胞などの細胞表面やさまざまな組織に発現する膜タンパク質で、変性コレステロールや脂質、それらとタンパク質との複合体を細胞内に取り込む多様な受容体の総称であり、CD36はその一種である。AIMはCD36に結合することで細胞内に取り込まれることが分かっている。
<文献>
1.Yamazaki, T. et al. PLoS ONE
2.Miyazaki, T. et al. J. Exp. Med. 189: 413-422 (1999)
3.Kurokawa, J. et al. Cell Metab. 11: 479-492 (2010)
4.Arai, S. et al. Cell Rep. 3: 1187-1198 (2013)
5.Arai, S. & Miyazaki, T. Semin. Immunopathol. 36: 3-12 (2014). Review.
<発表雑誌>
| 雑誌名 |
「Cell Reports」(オンライン版:10月9日) |
| 論文タイトル |
“Circulating AIM prevents hepatocellular carcinoma through complement activation” |
| 著者 |
前原 奈津美、新井 郷子、森 真弓、岩村 善博(以上、co-first author)、黒川 淳、甲斐 敏裕、楠 俊輔、谷口 香織、宮崎 徹(corresponding author)、以上東京大学。 |
| 池田 和孝(慶應大学)、小原 收(かずさDNA研究所)、山村 研一(熊本大学) |
| doi |
10.1016/j.celrep.2014.08.058 |
<お問い合わせ先>
<研究に関すること>
東京大学 大学院医学系研究科附属 疾患生命工学センター 分子病態医科学部門
教授 宮崎 徹 E-mail:
秘書 井上 志保、井上 ゆかり E-mail:
Tel:03-5841-1436 Fax:03-5841-1438
<JST事業に関すること>
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
川口 貴史
Tel:03-3512-3524
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: