ポイント
静岡大学の粟井 光一郎 准教授ら研究グループは、光合成反応を行う光合成膜に普遍的に存在するガラクト脂質が、これまでの常識と異なり光合成に必須ではないことを明らかにしました。
植物や藻類、シアノバクテリア注1)などの酸素発生型光合成をする生物では、光合成反応の場である光合成膜注2)は、ガラクト脂質注3)でできています。植物では脂質の骨格にガラクトース注4)を転移してガラクト脂質を合成するのに対し、シアノバクテリアでは脂質の骨格に一度グルコースを転移した後、ガラクトースに変換して合成することが知られています。
粟井准教授らは、これまで不明であったグルコースからガラクトースに変換する酵素の遺伝子mgdE 注5)を明らかにし、その遺伝子破壊株注6)を作成しました。遺伝子破壊株では、ガラクト脂質の代わりにグルコースを持つ脂質が蓄積していましたが、光合成膜が形成され、光合成活性も維持していることがわかりました。このことは、ガラクト脂質が光合成膜に必須ではないことを示しています。
今回の発見は、ガラクト脂質が光合成に必須であるという、これまでの常識を覆す結果であり、光合成膜の機能解明に大きな進展をもたらす成果です。今後、光合成に必須のタンパク質群の構造や安定性に膜脂質が与える影響を明らかにすることで、光合成システムの精密な理解を促進し、エネルギー物質生産の効率化に役立つことが期待されます。
本研究は、東京大学の佐藤 直樹 教授、東京工業大学の太田 啓之 教授と共同で行ったものです。
本研究成果は、米国科学アカデミー紀要(PNAS)のオンライン速報版で2014年9月1日の週(米国東部時間)に公開される予定です。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「藻類・水圏微生物の機能解明と制御によるバイオエネルギー創成のための基盤技術の創出」
(研究総括:松永 是 東京農工大学 学長) |
| 研究課題名 |
「ラン藻ポリケチド合成酵素を用いた脂質生産」 |
| 研究者 |
粟井 光一郎(静岡大学 大学院理学研究科 生物科学専攻 准教授) |
| 研究期間 |
平成24年10月~平成28年3月 |
JSTはこの領域で、藻類・水圏微生物には、高い脂質・糖類蓄積能力や多様な炭化水素の産生能力、高い増殖能力を持つものがあることに着目し、これらのポテンシャルを活かした、バイオエネルギー創成のための革新的な基盤技術の創出を目指しています。
<研究の背景と経緯>
植物や藻類など、我々の身近に存在する光合成生物は、酸素発生型と呼ばれる光合成反応、つまり光エネルギーを使って水から酸素を作り、二酸化炭素を取り込む反応を行います。この反応は、植物や藻類では細胞中の葉緑体のなかにある光合成膜(チラコイド膜)と呼ばれる膜を介して行われます。このチラコイド膜は、光合成反応を行うタンパク質複合体と膜脂質と呼ばれる分子からできていて、その比率はおよそ5:5であるといわれています。膜脂質は膜を形作る役割を担っていることから、光合成反応を行うためには、反応を行うタンパク質だけでなく、膜脂質も必要です。
チラコイド膜を作る膜脂質の種類は、他の膜とは異なることが知られています。たとえば、ヒトの細胞にある膜のほとんどはリン脂質と呼ばれる、分子の中にリンを含む膜脂質でできています。一方、チラコイド膜のほとんど(全体の9割)が分子の中に糖を含む膜脂質(糖脂質)でできています。中でもガラクトースを持つ糖脂質(ガラクト脂質)は全体の8割を占めており、このうち1分子のガラクトースを持つ糖脂質モノガラクトシルジアシルグリセロール(MGDG)がチラコイド膜のおよそ5割、2分子のガラクトースを持つ糖脂質ジガラクトシルジアシルグリセロール(DGDG)が3割を占めています。地球上には、地表の植物や海中の藻類など、非常に多くの光合成生物が存在していることから、特にMGDGは地球で最も多く存在する膜脂質であると言われています。この特徴的な脂質組成は酸素発生型光合成を行う生物に保存されていることから、ガラクトースを持つ膜脂質は光合成反応に必須であると考えられてきました。しかし、なぜガラクトースを持つ糖脂質が多量に存在するのかは、わかっていませんでした。
ガラクトースは、生体内ではそれほど多く存在する糖ではありません。生体内では、特にグルコースの存在量が多く、ガラクトースはグルコースの数百分の一しか存在していません。ガラクトースとグルコースの違いはわずかで、C4位の水酸基の配位が異なるだけです(図1)。ガラクトースの存在量は、植物や藻類の細胞だけ少ないわけではなくヒトの細胞でも同様で、実際ヒトが食物から吸収するガラクトースのほとんどは、MGDGやDGDGなどのヒトが食べる植物や藻類に含まれるチラコイド膜糖脂質由来だといわれています。
チラコイド膜にガラクト脂質が必須かどうかを調べるため、研究グループは植物や藻類と同じ酸素発生型光合成を行うシアノバクテリアに着目しました。シアノバクテリアはMGDGとDGDGを持ち、チラコイド膜を構築して光合成を行いますが、これらガラクト脂質の合成経路が植物と異なることがわかっていました(図2)。植物では膜脂質の骨格であるジアシルグリセロール(DAG)にガラクトースを転移してMGDGを合成するのに対し、シアノバクテリアではDAGにまずグルコースを転移し、合成されたモノグルコシルジアシルグリセロール(GlcDG)を糖異性化酵素によってMGDGへと変換します。シアノバクテリアのガラクト脂質合成経路のうち、この糖異性化酵素の遺伝子(mgdE )が不明でした。そこで、この遺伝子を同定し、遺伝子破壊株を作成することでMGDGへの異性化反応を止め、MGDGがGlcDGで置き換え可能かを調べることで、ガラクトースを持つ膜脂質が光合成に必須であるかを調べることを計画しました。
<研究の内容>
本研究では、シアノバクテリアSynechocystis sp.PCC6803を用いて、mgdE 遺伝子の同定を行いました。まず、詳細なデータベース解析の結果、最近明らかとなったPaulinella chromatophora のクロマトフォアゲノムでも、シアノバクテリア型の脂質合成酵素遺伝子が全て保存されていることを見出しました。P.chromatophora はリザリア下界ケルコゾア門ユーグリファ目に分類される単細胞動物で、細胞は30μm程度のアメーバ状であり、ケイ酸質の鱗片で構築された卵型の外殻を持ちます。この生物の特徴的な点は、細胞内にクロマトフォアと呼ばれる青緑色の共生シアノバクテリア様の構造が存在することです。このクロマトフォアには約800遺伝子がコードされているゲノムDNAが保存されており、解析の結果これまでに明らかとなっているシアノバクテリア型の脂質合成酵素遺伝子が全て保存されていることがわかりました。そこで、このゲノムにも目的のmgdE 遺伝子が保存されていると考え、約800遺伝子のうち、他のシアノバクテリアゲノムでも保存されている遺伝子を抽出し、その中から糖代謝関連モチーフを持つもの、糖異性化反応と関係する酸化還元モチーフを持つものを選び出し、その遺伝子破壊株をシアノバクテリアで作成しました。その結果、遺伝子破壊株ではMGDGの蓄積が見られず、GlcDGが多量に蓄積していることが確認できました。この結果から、この遺伝子が目的のGlcDG異性化酵素遺伝子(mgdE )であることが明らかとなりました。
単離したmgdE 遺伝子破壊株は、野生株と比べ成育速度がおよそ半分程度であり、クロロフィル含量も7割程度に低下していました。実際、顕微鏡で観察するとクロロフィルの含量が少ない白化した細胞も散見されます(図3)。次に、脂質組成がどのように変化しているかを調べたところ、MGDGとDGDGが検出されず、それに代わりGlcDGが多量に蓄積していることがわかりました。次に、mgdE 遺伝子破壊株の光合成活性を調べたところ、飽和光下では野生株と同等の酸素発生能を持つことが分かりました。さらに、電子顕微鏡を用いて内部構造を観察したところ、野生株と同様、mgdE 遺伝子破壊株でもチラコイド膜が形成されていました(図4)。これらの結果は、GlcDGがMGDGとDGDGの機能を相補して、光合成活性をはじめとするシアノバクテリアの機能を維持しているだけでなく、チラコイド膜の構築でもガラクト脂質の機能を相補できること、つまりチラコイド膜にはガラクト脂質が必須ではないということを示しています。
<今後の展開>
本研究では、長らく未知であったGlcDG異性化酵素遺伝子を同定し、その遺伝子破壊株を作成、解析することでチラコイド膜においてガラクト脂質は必須ではないということを証明しました。これは、酸素発生型光合成生物のチラコイド膜にはガラクト脂質が必須であるというこれまでの常識を根本から覆す成果です。今後は、酸素発生型光合成生物全般でのガラクト脂質の必須性を明らかにするため、シアノバクテリアのガラクト脂質合成経路を藻類や植物に導入し、合成経路を置き換えた株を作出・解析することで、それらの生物でもグルコ脂質で機能代替が可能かを検証していきたいと考えています。また、ガラクト脂質は、チラコイド膜の構築だけではく、光合成反応を行うタンパク質複合体の内部にも存在し、それらタンパク質複合体の活性や構造に影響を与えていることが明らかとなってきました。今回単離した遺伝子破壊株を解析することで、糖の構造変化が光合成に必須のタンパク質群の構造や安定性に与える影響を明らかにし、それが光合成システムの精密な理解、ひいてはエネルギー物質生産の効率化に繋がることも期待されます。
<参考図>
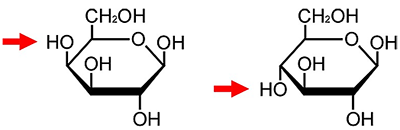
図1
ガラクトースとグルコースの構造。C4位の水酸基の向きが異なる(矢印)。左:ガラクトース、右:グルコース
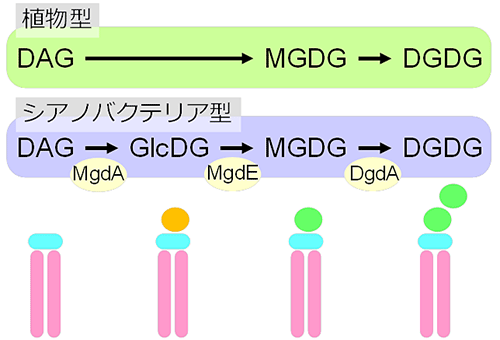
図2
植物とシアノバクテリアにおけるガラクト脂質合成経路の違い。植物や藻類ではジアシルグリセロール(DAG)にガラクトースを付加することでMGDGを合成するが、シアノバクテリアでは、まずグルコースを転移し、それを異性化することでMGDGを合成する。矢印下の黄色の楕円は、その反応を担う酵素の名前を示す。MgdA:DAGにグルコースを転移する酵素、MgdE:GlcDGのグルコースをガラクトースに異性化する酵素、DgdA:MGDGにもう1分子のガラクトースを付加する酵素。下段は膜脂質の構造を模式化した図。ピンク部は脂肪酸、水色部はグリセロール、橙色部はグルコース、緑色部はガラクトースを示す。
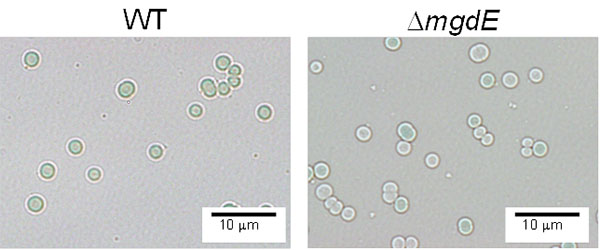
図3
mgdE 遺伝子破壊株(ΔmgdE 株)の形態。ΔmgdE 株では、緑色と白色の細胞が観察された。WT:野生株
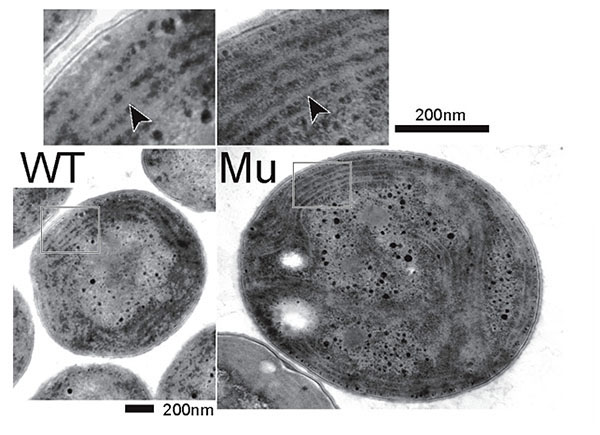
図4
mgdE 遺伝子破壊株(ΔmgdE 株)の内部構造。電子顕微鏡による観察から、遺伝子破壊株でもチラコイド膜が構築されていることがわかる(矢印)。WT:野生株、Mu:ΔmgdE 株。
<用語解説>
- 注1) シアノバクテリア
- 植物や藻類と同じ酸素発生型光合成を行うバクテリア。葉緑体と共通の起源を持つ(祖先が同じ)と考えられている。
- 注2) 光合成膜
- 光合成反応を行う生体膜。チラコイド膜と呼ばれる。ガラクト脂質が8割を占める。
- 注3) ガラクト脂質
- 生体膜を形作る膜脂質のうち、糖の一種であるガラクトースを持つもの。植物や藻類、シアノバクテリアなどの酸素発生型光合成を行う生物に広く保存されている。
- 注4) ガラクトース
- 糖の一種。化学式はグルコースと同じだが、4番目の炭素原子に付く水酸基(-OH)の向きが異なる。図1参照。
- 注5) mgdE
- 今回明らかにした糖脂質異性化酵素遺伝子。遺伝子を示す場合は3文字目までを小文字で斜体(mgdE )、タンパク質を示すときは1文字目を大文字にし、正体で示す(MgdE)。
- 注6) 遺伝子破壊株
- 目的の遺伝子を破壊し、その機能を阻害した株。今回の研究では、糖脂質異性化酵素遺伝子(mgdE )の遺伝子破壊株を用いている。
<論文タイトル>
“Oxygenic photosynthesis without galactolipids”
(ガラクト脂質を介さない酸素発生型光合成)
doi: 10.1073/pnas.1403708111
<お問い合わせ先>
<研究に関すること>
粟井 光一郎(アワイ コウイチロウ)
静岡大学 大学院理学研究科 生物科学専攻 准教授
〒422-8529 静岡市駿河区大谷836
Tel:054-238-3339
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、古川 雅士(フルカワ マサシ)、松丸 健一(マツマル ケンイチ)
科学技術振興機構 戦略研究推進部 グリーンイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2063
E-mail:
<報道担当>
静岡大学 総務部 広報室
〒422-8529 静岡市駿河区大谷836
秋山 和廣(アキヤマ カズヒロ)
Tel:054-238-5179 Fax:054-237-0089
吉岡 美智子(ヨシオカ ミチコ)
Tel:054-238-3046
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: