ポイント
- 病原体を貪食する免疫細胞が細菌感染を感知する重要な分子を発見しました。
- この免疫分子の介在により貪食細胞が感染局所に集積するメカニズムの一端を解明しました。
- これにより、敗血症などの重症感染症の予防や治療の技術開発が期待されます。
国立大学法人 筑波大学 医学医療系 渋谷 彰 教授らの研究グループは、病原体を貪食する免疫細胞の感染局所への集積に重要な役割を担う免疫分子を発見し、そのメカニズムを世界に先駆けて解明しました。
細菌、ウイルス、寄生虫などの病原体が人体に侵入し感染すると、血液中を流れている炎症性単球注1)と呼ばれる免疫細胞が血管壁を通過し、感染局所に集積します。炎症性単球は、そこで病原体を貪食するなどして感染から体を守る重要な働きをしています。しかし、炎症性単球がどのようなメカニズムで感染局所に集積するかについては長い間、未解明のままでした。
本研究グループは、感染した細菌から放出される菌体成分を感知した炎症性単球が、トル様受容体(TLR4)注2)とメア2(MAIR-II)注3)と呼ばれる炎症性単球の細胞膜上に存在する分子を介して、炎症局所の血管の内壁に強固に接着し、感染局所に集積することを発見しました。また、TLR4やMAIR-IIを欠損させたマウスで、細菌の感染が進展しショックで死亡する敗血症注4)を誘導すると、野生型マウスと比較し、およそ9倍も高い確率で死亡することを見いだしました。これらの結果は、これまで不明であった病原体の感染を免疫細胞がコントロールするメカニズムの一端を世界で初めて明らかにしたものです。
この研究成果に基づいて、今後、炎症性単球をより強力に働かせる技術が確立されれば、敗血症などを含む種々の重篤な感染症に対する新しい予防法や治療法の開発につながります。
本研究の成果は、2014年8月19日付「Nature Communications」で公開される予定です。
本研究成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長) |
| 研究課題名 |
「ヒト肥満細胞活性化制御技術の開発によるアレルギー疾患の克服」 |
| 研究代表者 |
渋谷 彰(筑波大学 医学医療系 教授) |
| 研究期間 |
平成22年10月~平成28年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。上記研究課題では、アレルギーの原因となる化学物質の放出を抑制する免疫系受容体の探索とその仕組みを解明することで、花粉症や喘息などに対する革新的医薬品の開発を目指します。
<研究の背景>
細菌、ウイルス、寄生虫などの病原体が人体に侵入し感染すると、血液中を流れている炎症性単球と呼ばれる免疫細胞が血管壁を通過し、感染局所に集積します(図1)。炎症性単球は、そこで病原体を貪食するマクロファージ注1)と呼ばれる細胞に分化して感染から体を守る重要な働きをしています。しかし、炎症性単球がどのようなメカニズムで血液中から感染局所に集積するかについてはこれまで長い間、未解明のままでした。
本研究グループは、すでにMAIR-IIと名付けたマクロファージなどの細胞膜上に存在する分子を発見していました(参考文献1)。しかし、MAIR-IIがマクロファージでどのような働きをするかはわかっていませんでした。今回、MAIR-IIが血液中に存在する炎症性単球の細胞膜上にも存在することを見いだし、その働きを解析しました。
<研究内容と成果>
MAIR-IIがマクロファージのほか、炎症性単球にも存在することから、マクロファージや炎症性単球が感染防御に重要な役割をになう敗血症のモデルマウスを用いて、MAIR-IIの機能を解析しました。野生型マウスとMAIR-II遺伝子欠損マウスを用いて、細菌による腹膜炎が全身に進展しショックで死亡する敗血症を誘導しました。その結果、野生型マウスでは生存率が90%であったのに対し、MAIR-II遺伝子欠損マウスでは10%しか生存しませんでした。この際、野生型マウスに比較し、MAIR-II遺伝子欠損マウスで腹腔内のマクロファージの数が有意に減少していました(図2)。そこで、野生型マウスとMAIR-II遺伝子欠損マウスから炎症性単球を分離し、これをそれぞれMAIR-II遺伝子欠損マウスの血管内に注入しました。その後、腹膜炎による敗血症を誘導すると、MAIR-II遺伝子欠損マウス由来の炎症性単球を注入したマウスでは腹腔内のマクロファージの数が少なく、10%しか生存しなかったのに対し、野生型マウス由来の炎症性単球を注入したマウスでは、有意に腹腔内のマクロファージの数が増加し、生存率も70%へと有意に高くなりました(図3)。以上の結果から、炎症性単球の感染局所である腹腔内への集積に、炎症性単球のMAIR-IIが重要な役割を担っていることが明らかとなりました。
次に、炎症性単球がどのようなメカニズムで腹腔内に集積するかを解析しました。はじめに、炎症性単球が細菌由来の何らかのシグナルを感知しているのではないかと仮定し、敗血症を引き起こす細菌の菌体成分であるエンドトキシン注2)を感知するトル様受容体 (TLR4)に着目しました。そこで野生型マウスとTLR4の遺伝子欠損マウスから同様に炎症性単球を分離し、これをもともと炎症性単球の腹腔内への集積に異常があるMAIR-II遺伝子欠損マウスの静脈内に注入してから、敗血症を誘導しました。その結果、野生型マウス由来の炎症性単球を注入したマウスでは腹腔内のマクロファージの数が増加したのに対し、TLR4遺伝子欠損マウス由来の炎症性単球を注入したマウスでは有意に腹腔内のマクロファージの数が少なく、死亡率も有意に高いことが判明しました(図4)。以上の結果から、炎症性単球はエンドトキシンを感知し、感染局所に集積することが判明しました。また、炎症性単球の感染局所である腹腔内への集積に、MAIR-IIに加えてTLR4も重要な役割を担っていることが初めて明らかとなりました。
MAIR-IIとTLR4が同じような働きを示すことから、MAIR-IIとTLR4との関係を解析したところ、炎症性単球のTLR4がエンドトキシンを感知すると、TLR4がMAIR-IIに結合し、その結果細胞内で信号が伝わり、最終的にVLA-4注5)と呼ばれる接着分子が活性化し、炎症性単球が血管の内壁に強固に接着することがわかりました(図5)。以上の結果をまとめると、血液中の炎症性単球は細菌から放出される菌体成分であるエンドトキシンを感知し、炎症性単球の細胞内でTLR4とMAIR-IIを介した信号により血管の内壁に強固に接着し、感染局所に集まって行くことが明らかとなりました(図6)。これらの一連の現象は、これまで不明であった病原体の感染を免疫がコントロールしているメカニズムの一端を世界で初めて示したものになります。
<今後の展開>
本研究により、感染した細菌、ウイルス、寄生虫などの病原体を貪食して生体防御を担う炎症性単球の感染局所への集積のメカニズムが明らかになったことより、この炎症性単球をより強力に働かせる技術の開発が今後の課題となります。たとえば、TLRやMAIR-IIに結合し、これらを刺激する抗体などが可能性として考えられます。これが確立されれば、敗血症などを含む種々の感染症に対する新しい予防法や治療法につながります。
一方、炎症性単球は感染症のみならず、血管壁、癌組織などにも浸潤し、動脈硬化、心筋梗塞やがんの発症メカニズムに深く関与していることが知られています。炎症性単球のそれぞれの局所への集積を自由にコントロールすることができれば、これらの疾患の治療にも応用できる可能性があります。
<参考図>
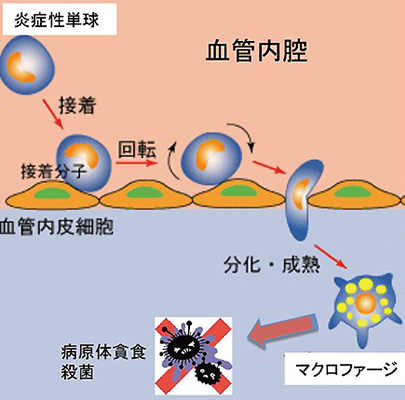
図1 炎症性単球の感染局所への集積
血液中を循環する炎症性単球は、病原体の感染する部位を感知し、血管内壁(血管内皮細胞)の接着した後に、これを通過し、組織に侵入しマクロファージとなる。マクロファージは感染した細菌、ウイルス、寄生虫などの病原体を貪食するなどして、感染から生体を守る。
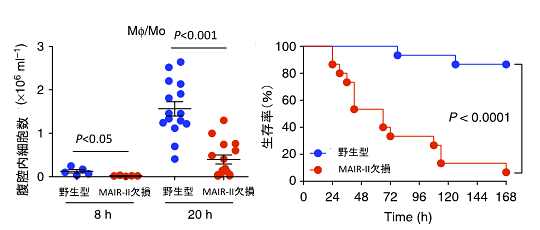
図2 MAIR-II遺伝子欠損マウスにおける腹膜炎の悪化と敗血症による死亡率の亢進
(上)虫垂結索穿孔注4)により腹膜炎、敗血症を誘導したところ、MAIR-II遺伝子欠損マウスで腹膜炎が著明に悪化。(下左)腹膜炎の誘導後、腹腔内のマクロファージの数を測定すると、MAIR-II遺伝子欠損マウスで有意に少なかった。(下右)腹膜炎の誘導後、敗血症での生存率を比較すると、MAIR-II遺伝子欠損マウスで有意に低かった。
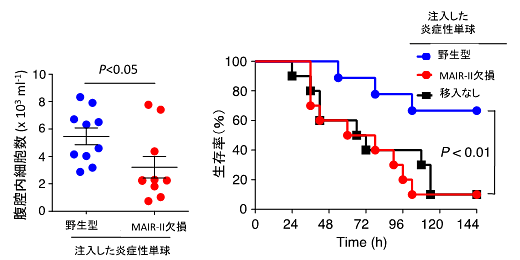
図3 炎症性単球の腹腔内への集積と生存率にMAIR-IIが重要
野生型マウスとMAIR-II遺伝子欠損マウスから炎症性単球を分離し、これをそれぞれMAIR-II遺伝子欠損マウスの血管内に注入した後に、腹膜炎による敗血症を誘導した。腹腔内のマクロファージの数を測定すると、MAIR-II遺伝子欠損マウス由来の炎症性単球を注入したマウスで有意に少なく、生存率も低かった。
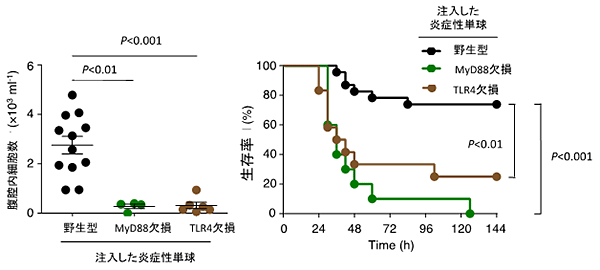
図4 炎症性単球の腹腔内への集積と生存率にTLR4が重要
野生型マウス、TLR4遺伝子欠損マウスおよびMyD88(TLR4のシグナル伝達を行う蛋白)遺伝子欠損マウスから炎症性単球を分離し、これをそれぞれMAIR-II遺伝子欠損マウスの血管内に注入した後に、腹膜炎による敗血症を誘導した。腹腔内のマクロファージの数を測定すると、TLR4遺伝子欠損マウス由来およびMyD88遺伝子欠損マウス由来の炎症性単球を注入したマウスで有意に少なく、生存率も低かった。
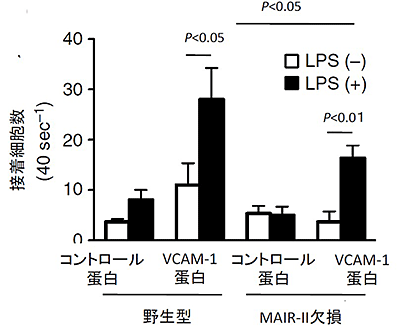
図5 炎症性単球上のVLA-4が血管内皮に存在するVCAM-1への結合にMAIR-IIが重要
野生型マウスとMAIR-II遺伝子欠損マウスから炎症性単球を分離し、エンドトキシンで刺激した(LPS(+))。エンドトキシンで刺激しない炎症性単球をコントロールとした(LPS(-))。これらの炎症性単球を、それぞれVCAM-1蛋白またはコントロール蛋白を付着させた直径0.69mmのガラス管に一定の圧力を加えて流し込み、付着した細胞数を数えた。LPSで刺激すると、どちらの炎症性単球もVCAM-1への接着が亢進したが、MAIR-II遺伝子欠損マウス由来の炎症性単球は、野生型に比較して、VCAM-1への接着が少なかった。
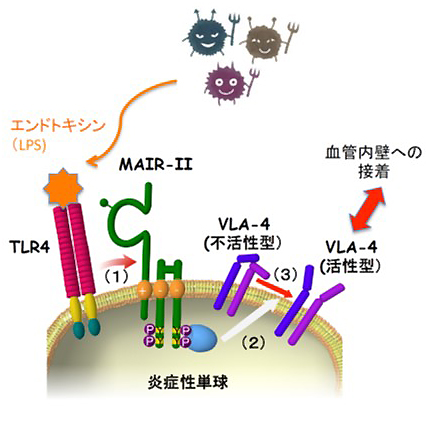
図6 まとめ
炎症性単球細の胞膜上に存在するTLR4が、細菌から放出される菌体成分のエンドトキシン(LPS)を感知すると、MAIR-IIと結合する(1)。一方で、TLR4は特定の遺伝子発現を介してMAIR-IIを活性化し、最終的に接着分子であるVLA-4への信号が伝達され(2)、VLA-4が活性化される(3)。その結果、炎症性単球は血管内壁への接着が亢進し、血管壁を通過していく。
<用語解説>
- 注1) 炎症性単球、マクロファージ
- 炎症性単球は血液中を循環している免疫細胞(=白血球)の一種。感染や炎症があると、血管壁を通過し、組織に移行し、マクロファージや樹状細胞と呼ばれる細胞に分化する。
- マクロファージは血液中の単球から由来し、組織に移行して分化した細胞。主に異物や病原体などを貪食する働きがある一方、炎症などにも関与する。
- 注2) トル様受容体(TLR4)、エンドトキシン
- トル様受容体(Toll-like receptor;TLR)と呼ばれる一群(ヒトではTLR1-TLR10までの10種類が知られている)の免疫細胞膜上に存在する分子のひとつ。TLRは種々の病原体を感知する働きを持つが、そのうちTLR4は大腸菌などの細菌の菌体成分であるリポポリサッカライド(LPS)(エンドトキシンとも呼ばれる)の受容体として結合し、細胞内に信号を伝え炎症反応を起こす。
- 注3) メア2(MAIR-II)
- 本研究グループが発見し、2003年に報告した免疫細胞膜上に存在する分子(参考文献1)。Myeloid-associated immunoglobulin-like receptor-IIの略。別名としてCLM-4またはLMIR2とも呼ばれる。
- 注4) 敗血症、虫垂結索穿孔
- 細菌感染症が全身に波及したもので非常に重篤な状態であり、無治療ではショック、多臓器不全などから早晩死に至る。毎年、米国だけでも100万人が死亡する。
- 本研究で作製したマウスでの敗血症モデルは、虫垂結索穿孔法(腹腔内から虫垂を取り出し、根元を縛ってから先端に針で穴をあけ腹腔内に戻すと、穴から糞便が漏れることによって大腸菌による腹膜炎が生じ、全身に広がり敗血症が誘導されるモデル)によるものであり、広く用いられている。
- 注5) VLA-4
- 免疫細胞膜上に存在する接着分子の一種。接着分子は、接着する相手方の細胞に存在する別の接着分子に結合し、細胞同士を結びつける。本研究では、炎症性単球に存在するVLA-4は血管内壁の細胞(血管内皮)の細胞膜上に存在するVCAM-1と呼ばれる接着分子に結合する。
<参考文献>
1.Yotsumoto, K. et al. Paired activating and inhibitory immunoglobulin-like receptors, MAIR-I and MAIR-II, regulate mast cell and macrophage activation. J Exp Med 198, 223-233 (2003).
<掲載論文>
| タイトル |
“Toll-like receptor 4 and MAIR-II/CLM-4/LMIR2 immunoreceptor regulate VLA-4-mediated inflammatory monocyte migration”
(トル様受容体4とMAIR-II/CLM-4/LMIR2はVLA-4を介した炎症性単球の移動を制御する) |
| 著者 |
Naoya Totsuka, Yun-Gi Kim, Kazumasa Kanemaru, Kouta Niizuma, Eiji Umemoto, Kei Nagai,Satoko
Tahara-Hanaoka, Chigusa Nakahasi-Oda, Shin-ichiro Honda, Masayuki Miyasaka, Kazuko Shibuya & Akira
Shibuya
|
| 掲載誌 |
Nature Communications (ネイチャー コミュニケーションズ) |
| doi |
10.1038/ncomms5710 |
<お問い合わせ先>
<研究に関すること>
渋谷 彰(シブヤ アキラ)
筑波大学 医学医療系・生命領域学際研究センター 教授
〒305-8572 茨城県つくば市天王台1-1-1
Tel:029-853-3281/080-6547-5472
E-mail:
<JST事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
筑波大学 広報室
〒305-8577 茨城県つくば市天王台1-1-1
Tel:029-853-2039 Fax:029-853-2014
E-mail:
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: