ポイント
- 薬剤標的である膜輸送体の活性を計測する方法の高感度化・定量化が求められていた。
- 高度に集積化された人工生体膜チップの開発により、計測感度が従来法の100万倍向上した。
- 本手法は創薬候補および薬剤標的の効率的探索方法への応用に期待できる。
JST 戦略的創造研究推進事業において、東京大学 大学院工学系研究科 応用化学専攻の渡邉 力也 助教らは、薬剤標的として注目される膜輸送体注1)の輸送活性注2)計測感度を従来のパッチクランプ法注3)と比べて約100万倍向上させる超高感度活性計測技術を開発しました。
膜たんぱく質は細胞膜上にあり、情報伝達やエネルギー合成などの重要な役割を担っているたんぱく質です。市販薬の大半は膜たんぱく質を標的としており、なかでも生体膜を介して細胞内外の基質の取り込みや排出を行う膜輸送体は、近年特に注目されている薬剤標的です。膜輸送体を創薬の標的とする場合、その輸送活性を定量的に計測することが薬効を評価する上で重要ですが、従来汎用されてきたパッチクランプ法では、検出感度の問題と計測対象が限られていることから、大半の膜輸送体の活性を計測することは極めて困難でした。
渡邉助教らは検出感度向上のため、①安定性と膜たんぱく質との高い親和性を兼ね備えた人工生体膜注4)の量産技術の開発、②その人工生体膜で被われた微小水滴を10万個以上集積化させた超高密度人工生体膜チップの開発、③これを用いて膜輸送体の超高感度活性計測技術を確立しました。現在までに、F型ATP合成酵素注5)やα溶血素注6)などの膜輸送体の働きを1分子単位で計測できるほどの高感度化に世界で初めて成功し、基質の取り込みや排出を、パッチクランプ法の約100万倍の超高感度かつ定量的に計測することを可能にしました。
今回開発された人工生体膜チップは、さまざまな膜たんぱく質を標的とした創薬候補を超効率的に探索する上で最適な基盤技術になることが期待されます。
なお、本研究の一部は東京大学 大学院工学系研究科 応用化学専攻の野地 博行 教授、東京大学 大学院理学系研究科 化学専攻の菅 裕明 教授と共同で行ったものです。
本研究成果は、2014年7月24日(英国時間)発行の科学誌「Nature Communications」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:若槻 壮市 米国SLAC国立加速器研究所 光科学部門 教授) |
| 研究課題名 |
「膜タンパク質の構造変化と物質輸送の1分子同時計測技術の開発」 |
| 研究者 |
渡邉 力也(東京大学 大学院工学系研究科 助教) |
| 研究期間 |
平成25年10月~平成29年3月 |
<研究の背景と経緯>
細胞の表面には、膜たんぱく質と呼ばれるたんぱく質が存在していて、生理的に重要なため市販薬の大半が標的としています。そのなかでも、細胞内外の基質の取り込みや排出を担う膜輸送体は近年特に注目されている薬剤標的であり、その輸送活性を定量的に計測することで、薬効を評価する試みがなされています。従来、膜輸送体の活性計測にはパッチクランプ法が広く用いられてきました。しかし、パッチクランプ法は、原理的に計測対象が限られていることが欠点でした。すなわち、電荷を帯びた基質を毎秒10万個以上輸送するイオンチャネルと呼ばれる膜輸送体などしか計測対象となりえませんでした。これは、ヒトが持つ膜輸送体のうちの約25%でしかなく、多種多様な膜輸送体の活性を高感度かつ定量的に計測できる技術の開発が急務とされていました。
<研究の内容>
膜輸送体の活性計測を高感度・定量化するために渡邉助教らは、超高密度な人工生体膜チップの新規開発と、これを用いた膜輸送体の超高感度活性計測技術の確立を目指しました。具体的には、独自の人工生体膜の量産技術を応用して、人工生体膜で被われた微小水滴を高度に集積化した超高密度人工生体膜チップを開発しました。そして、この微小水滴を検出器として用いることで、膜輸送体の輸送活性が低くても、輸送基質の濃度変化を劇的に増大させることに成功し、膜輸送体の超高感度・定量活性計測を可能にしました。
1.超高密度人工生体膜チップの新規開発
人工生体膜で被われた容積7フェムトリットル(フェムトは10の15乗分の1リットル)の微小水滴を約10万個集積した超高密度人工生体膜チップ(大きさ:24mm×32mm)を新規開発しました(図1)。このチップでは、従来100個程度しか集積されなかった人工生体膜チップと比較して、約1,000倍高い密度で人工生体膜を集積化することができました。また従来の人工生体膜は、イオンなどの輸送基質が数分の内に透過することから、輸送活性を正確に計測できない問題がありましたが、この超高密度人工生体膜チップは、2時間以上にわたり物質の透過を抑えることに成功しており、膜輸送体の活性を高感度、高効率、定量的に計測する上で最適な基盤技術といえます。
2.膜輸送体の高感度活性検出技術の確立
新規開発した超高密度人工生体膜チップを用いて、膜輸送体の高感度活性計測技術を確立しました(図2)。まず、活性の計測のため、微小水滴の上にある人工生体膜へ膜輸送体を組み込み、膜輸送体を介して輸送基質を水滴のなかへ取り込ませます(図2左のH+が取り込まれている)。また、あらかじめ輸送基質を水滴の中に封入し、膜輸送体によって基質を排出させることも可能です(図2右の蛍光輸送基質が排出されている)。輸送基質は、微小な水滴のなかで濃縮(図2左のH+)または排出される(図2右の蛍光輸送基質)ため、膜輸送体の働きが弱くても、基質の濃度変化は顕著に増大します。すなわち、基質の濃度変化に応答する蛍光指示薬注7)を利用すると、膜輸送体の活性を高感度かつ定量的に検出できるようになります(図3)。現在までに、F型ATP合成酵素やα溶血素などを含む多種多様な膜輸送体の活性を1分子単位で検出できるほどの高感度化に成功しており、毎秒2個程度しか基質が輸送されなくても、その輸送活性を定量的に計測できるようになりました(図3、図4)。このように、超高密度人工生体膜チップにより検出感度が従来法と比較して約100万倍向上し、多くの膜輸送体の活性を定量的に計測できるようになりました。
<今後の展開>
本研究で開発された超高密度人工生体膜チップは、生体膜を介したさまざまな生体分子反応(膜輸送・膜透過)の高感度・定量検出への応用が考えられます。そのため、多種多様な膜たんぱく質を標的とした創薬候補の高速スクリーニングおよび、薬剤標的となる膜たんぱく質の大規模な探索に最適なプラットフォームになることが強く期待されます。本成果は特許出願済みであり(特願2013-171493)、今後は実用化を希望する企業との研究開発を進めていく予定です。
<参考図>
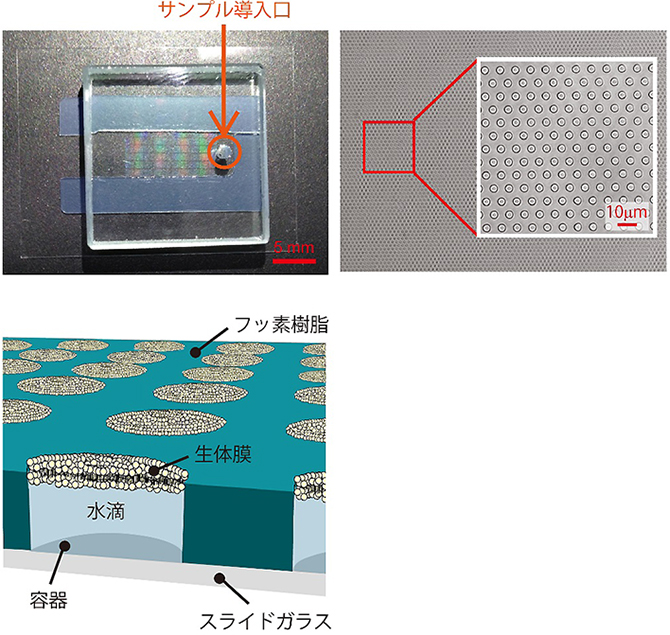
図1 超高密度人工生体膜チップ写真および模式図
- (左上図)超高密度人工生体膜チップの外観を示す。
- (右上図)直径4μm、高さ500nmの容器が高密度に集積している。
- (左下図)容器は人工生体膜で被われており、その下に微小量の水滴(7フェムトリットル)が封入されている。
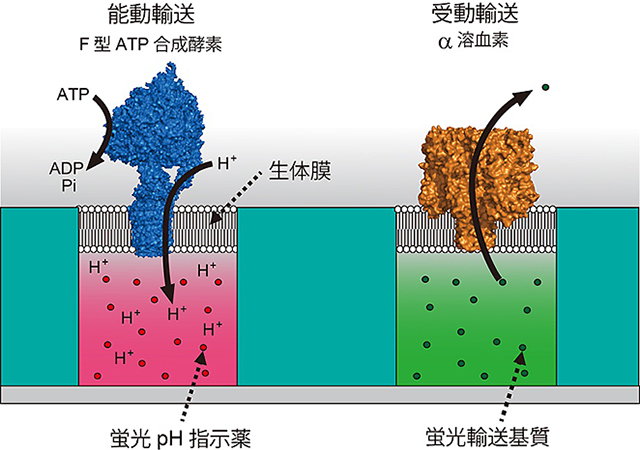
図2 超高密度人工生体膜チップを利用した膜輸送体の高感度活性検出法
膜輸送体を人工生体膜に組み込み、蛍光指示薬(蛍光pH指示薬や蛍光輸送基質)の蛍光強度の変化から輸送活性を高感度に検出する。
- (左図)人工生体膜内に組み込まれたF型ATP合成酵素を介して微小水滴中に取り込まれたH+が、蛍光pH指示薬と反応する。
- (右図)人工生体膜内に組み込まれたα溶血素を介して蛍光輸送基質が微小水滴外に排出され、蛍光強度が弱くなる。

図3 膜輸送体(α溶血素)による輸送活性の超高感度検出例
異なる分子数のα溶血素を人工生体膜に組み込み、微小水滴中の緑色の基質(蛍光輸送基質)の蛍光強度を蛍光顕微鏡で観察した。
- (左図) 0秒では緑色の蛍光(蛍光輸送基質)の光が確認できる。
- (中央図)3000秒後では緑色の蛍光の強さが弱まっており、蛍光輸送基質が人工生体膜から排出されたことが分かる。
- (右図) 0秒と3000秒後の緑色の蛍光の強度差を示す。α溶血素の分子数が多い微小水滴ほど、強度差が大きくなっている。
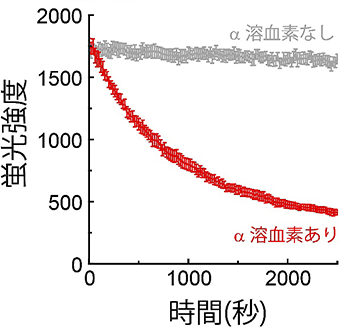
図4 膜輸送対(α溶血素)の輸送に伴った蛍光強度の変化例
α溶血素を組み込んだ人工生体膜(赤線)と組み込んでいない人工生体膜(灰色線)の微小水滴中の緑色の基質(蛍光輸送基質)の蛍光強度の変化を、横軸を時間としてグラフにした。α溶血素があると、蛍光指示薬が排出されるため、蛍光強度は減少する。
<用語解説>
- 注1) 膜輸送体
- 生体膜を介した基質の取り込みや排出を行う膜たんぱく質の総称。情報伝達やエネルギー合成などの生理的に重要な役割を担っている。輸送形態に応じて、受動輸送体、能動輸送体の2種類に分類される。
- 注2) 輸送活性
- 膜輸送体が基質を細胞の内外に取り込み・排出する能力のこと。
- 注3) パッチクランプ法
- ガラス電極と生体膜の間に非常に高いシールを形成することで、膜輸送体の輸送活性を電気信号として検出する技術。検出対象は、イオンなどの電荷を帯びた基質を輸送する膜輸送体に限定される。
- 注4) 人工生体膜
- リン脂質を利用して人工的に形成される脂質2重膜の総称。
- 注5) F型ATP合成酵素
- ATPの加水分解で得られるエネルギーを利用して能動的にH+を輸送する膜たんぱく質。H+を能動的(基質の濃度にかかわらず決まった方向)に輸送するため、能動輸送体に分類される。
- 注6) α溶血素
- 生体膜に突き刺さり直径1ナノメートル程度の穴を形成する膜たんぱく質。穴を通じて基質を受動的(基質の濃度が濃い側から薄い側)に輸送するため、受動輸送体に分類される。
- 注7) 蛍光指示薬
- 特定の基質と結合および解離して蛍光強度を変化させる試薬の総称。
<論文タイトル>
“Arrayed Lipid Bilayer Chambers Allow Single-Molecule Analysis of Membrane Transporter Activity”
(超高密度人工生体膜チップを利用した膜輸送体の1分子活性解析)
doi: 10.1038/ncomms5519
<お問い合わせ先>
<研究に関すること>
渡邉 力也(ワタナベ リキヤ)
東京大学 大学院工学系研究科 応用化学専攻 助教
〒133-8656 東京都文京区本郷7-3-1 工学部3号館6B03
Tel:03-5841-7252 Fax:03-5841-1872
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ)、落合 恵子(オチアイ ケイコ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
東京大学 大学院工学系研究科 広報室
〒113-8656 東京都文京区本郷7-3-1
Tel:03-5841-1790 Fax:03-5841-0529