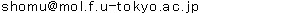ポイント
- オメガ3脂肪酸には心臓保護作用があることが知られている。
- マクロファージがオメガ3脂肪酸から生成する代謝物18-HEPEにより、心臓の炎症や線維化が抑制され、心機能を改善する。
- 18-HEPEを起点とした心不全に対する新たな心機能改善薬への展開が期待される。
JST 戦略的創造研究推進事業において、理化学研究所 統合生命医科学研究センター(RIKEN-IMS)の有田 誠 チームリーダー(元 東京大学 大学院薬学系研究科 准教授)らは、オメガ3脂肪酸注1)の心臓保護作用に関わる代謝産物18-HEPEを同定し、この代謝産物を心不全モデルマウスに投与し、顕著な予防・治療効果を見いだしました。
魚油に多く含まれるエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などのオメガ3脂肪酸はヒトを含む哺乳類は体内で生成できませんが、食べ物から摂取することで心臓を保護する作用があることが栄養学的には知られています。しかし、その作用メカニズムは不明でした。
有田チームリーダーらは、オメガ3脂肪酸を生合成できるように遺伝子改変したマウスを用い、オメガ3脂肪酸の心臓保護作用には心臓に存在するマクロファージの機能が重要であることを示しました。また、マクロファージが生成する脂肪酸代謝物のメタボローム解析注2)から、EPA由来の抗炎症性代謝物18-HEPEを見いだしました。さらに、18-HEPEを心不全モデルマウスに投与することで、炎症や線維化が顕著に抑制されました。
本研究成果は、心臓の組織学的な変化(リモデリング)の背景にある慢性炎症および線維化を積極的に抑制し、心機能を改善する治療法に役立つことが期待されます。
本研究は、慶応義塾大学 病院予防医療センターの遠藤 仁 助教(元 日本学術振興会 特別研究員PD)らと共同で行ったものです。
本研究成果は、2014年7月21日(米国東部時間)に米国科学誌「The Journal of Experimental Medicine」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「炎症の収束機構の分子基盤の確立と慢性疾患への適用」 |
| 研究者 |
有田 誠(理化学研究所 統合生命医科学研究センター メタボローム研究チーム チームリーダー) |
| 研究期間 |
平成23年4月~平成28年3月 |
<研究の背景と経緯>
魚油に多く含まれるEPAやDHAなどのオメガ3脂肪酸には心臓保護作用があることが知られており、栄養学的な観点から研究が進められてきました。また、オメガ3脂肪酸には炎症抑制作用があることが知られていますが、分子的なメカニズムに関して最近新たな発見がなされ、注目を集めています。これまで、オメガ3脂肪酸は、主に炎症作用のあるアラキドン酸注3)代謝系の酵素と競合することで炎症を抑制すると考えられてきましたが、最近新たにオメガ3脂肪酸から生成される抗炎症性代謝物が見いだされたためです。このような背景のもと有田チームリーダーらは、アラキドン酸およびオメガ3脂肪酸由来の代謝物を包括的にとらえる目的で、高速液体クロマトグラフィー・タンデム質量分析システム(LC-MS/MS)注4)を用いた脂肪酸代謝物の包括的メタボローム解析システムを確立しました(図1)。また、哺乳類では持たない機能であるオメガ3脂肪酸合成能を持たせるため、線虫由来のオメガ3脂肪酸合成酵素(Fat-1)を遺伝子導入したトランスジェニックマウス(Fat-1 Tg)を用いました(図2)。このマウスを用いることにより、これまで栄養学的な解析しかなされてこなかったオメガ3脂肪酸の生理機能に対して分子レベルでの解析が可能になります。これらを用いて、オメガ3脂肪酸の抗炎症作用に関わる代謝経路および新規の生理活性物質の同定を目指した研究をこれまで行ってきました。
今回の研究では、オメガ3脂肪酸による心臓機能保護作用、とくに心不全時の病態において重要な病変である心筋組織の線維化などの組織学的な変化(リモデリング)を抑制する作用について検証し、さらにこれまでの栄養学的手法では解明が困難であった“オメガ3脂肪酸の心臓保護効果が生体内のどの細胞によって、どのような機構を介して作用を発揮するのか”という問題に取り組みました。
<研究の内容>
有田チームリーダーらは、大動脈縮窄(だいどうみゃくしゅくさく)注5)により心臓への圧負荷を増大させ心肥大、心不全を起こす動物モデルを用いました。圧力の負荷を受けると心臓は、心筋肥大、炎症細胞浸潤、間質の線維化などの組織学的な変化(リモデリング)が起き、最終的には心機能が低下し心不全となります(図3)。Fat-1 Tgマウスに大動脈縮窄を手術により強制的に起こすと、心筋細胞の肥大については遺伝子改変されていない通常のマウス(野生型マウス)と差はありませんでしたが、心臓の収縮能は圧負荷後4週以降(心不全期)でも低下せず維持されており、間質の線維化および炎症細胞であるマクロファージの増加(浸潤)が顕著に抑えられていました(図4)。
次に研究者らは、オメガ3脂肪酸が心臓リモデリングを抑制する作用が一体どの細胞を介しているのか明らかにするため、野生型マウスにFat-1 Tgマウスの骨髄細胞を移植しました。すると、心臓リモデリングが抑制されたことから、オメガ3脂肪酸の心臓保護作用が、骨髄から動員される間質細胞(そのほとんどがマクロファージマーカーCD68陽性)を介するものであることが明らかになりました(図5)。
その分子メカニズムをさらに詳細に調べる目的で、マクロファージと心臓線維芽細胞の共培養の実験を行った結果、線維芽細胞の活性化を抑制する何らかの因子が、Fat-1 Tgマウス由来のマクロファージの培養上清中に存在することを見いだしました(図6)。この活性成分について、Fat-1 Tgマクロファージの培養上清に含まれる脂肪酸代謝物について、LC-MS/MSを用いたメタボローム解析を行ったところ、EPA由来の代謝産物、中でも18-HEPEがFat-1 Tgマクロファージで顕著に増加していること(図7)、さらに18-HEPEを心線維芽細胞に作用させると、用量依存的な抑制効果がナノモルレベルの微量で認められました(図8)。さらに、18-HEPEを大動脈縮窄術を施した野生型マウスに、圧負荷後一週間目から隔日で腹腔内投与したところ、心臓リモデリングや心機能低下に対する顕著な抑制効果が認められ、18-HEPEの新しい創薬シードとしての可能性が示されました(図9)。
<今後の展開>
以上のように、オメガ3脂肪酸の心臓保護作用について、Fat-1 Tgマウスとメタボローム解析を組み合わせることで、活性を担う細胞(マクロファージ)と代謝物を新規に同定することができました。オメガ3脂肪酸の心臓保護効果にはマクロファージが重要な役割を担い、それらが心臓局所で18-HEPEを産生して、心臓リモデリングの背景にある慢性炎症および線維化を積極的に抑制し、心機能の悪化を抑制していると考えられます(図10)。18-HEPEはオメガ3脂肪酸を摂取すると体内で生成する代謝物で、オメガ3脂肪酸の心臓保護作用に積極的に関わる内因性の炎症制御分子であると考えられます。今後、18-HEPEあるいはその誘導体を起点とした創薬展開を行うことで、心臓をはじめとする臓器の線維化(リモデリング)を抑制し、慢性炎症を制御する新規治療法に結びつくことが期待されます。
<参考図>
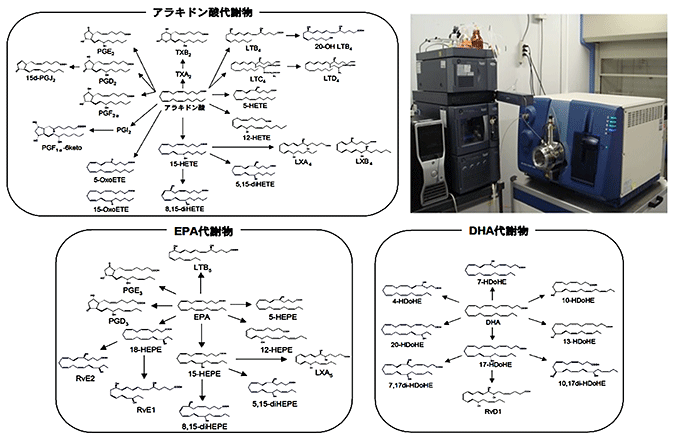
図1 脂肪酸代謝物とそれらの包括的メタボローム解析システム
アラキドン酸、EPAやDHAなどの脂肪酸は体内で代謝され種々の代謝産物となる。オメガ6脂肪酸であるアラキドン酸の代謝産物であるプロスタグランジン類(PGE2、PGD2など)やロイコトリエン類(LTB4、LTD4など)は炎症を引き起こす物質として知られている。一方で、EPAやDHAの代謝産物は抗炎症作用があることが知られている。それら種々の脂肪酸代謝産物をLC-MS/MSを用いて同時に測定するシステム(右上写真)を確立して実験に用いた。
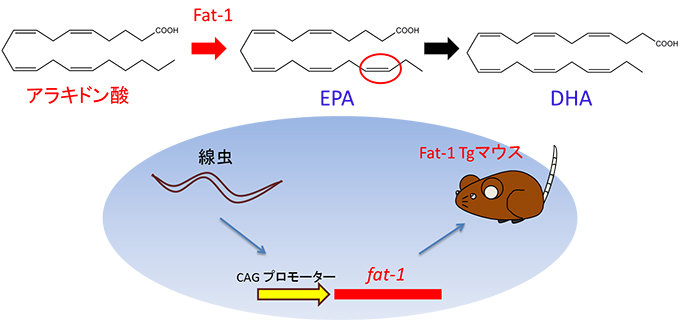
図2 オメガ3脂肪酸を体内で合成できるトランスジェニックマウス(Fat-1 Tg)
線虫はアラキドン酸からEPAを生成する酵素の遺伝子(fat-1)を持つ(哺乳類は持たない)。この遺伝子をマウスに導入したトランスジェニックマウス(Fat-1 Tg)を用いて実験を行った。
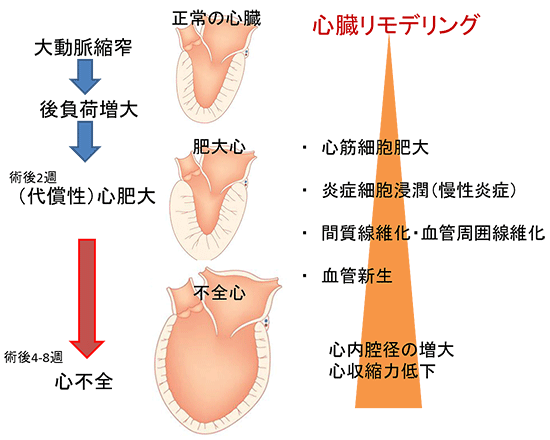
図3 心臓リモデリング
マウスの大動脈を狭める手術(大動脈縮窄術)を行うと左心室の圧負荷が増大し、心肥大を起こす。この時、心筋細胞は肥大するとともに心組織には炎症性の細胞が浸潤し炎症状態となり、それが慢性化すると心臓組織が線維化するといった心組織の変化(心臓リモデリング)が生じて、心収縮力などの心機能が低下して心不全となる。
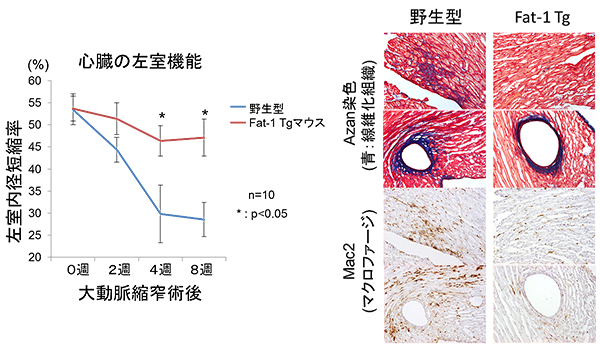
図4 Fat-1 Tgマウスでは圧負荷による心臓リモデリングが抑えられ、心機能が保持された
- (左)左心室の収縮機能を左心室内径短縮率として測定した。正常であれば短縮率が維持される。大動脈縮窄術を行った野生型マウスでは術後4週目から顕著な短縮率の低下が認められたが、Fat-1 Tgマウスでは心機能の低下が抑えられていた。(野生型マウスと比較して統計学的有意差あり * P<0.05)
- (右)圧負荷後のFat-1 Tgマウスでは、心臓間質および血管周囲の線維化(青色)が抑えられ(上)、マクロファージ(茶色)の数も少なかった(下)。
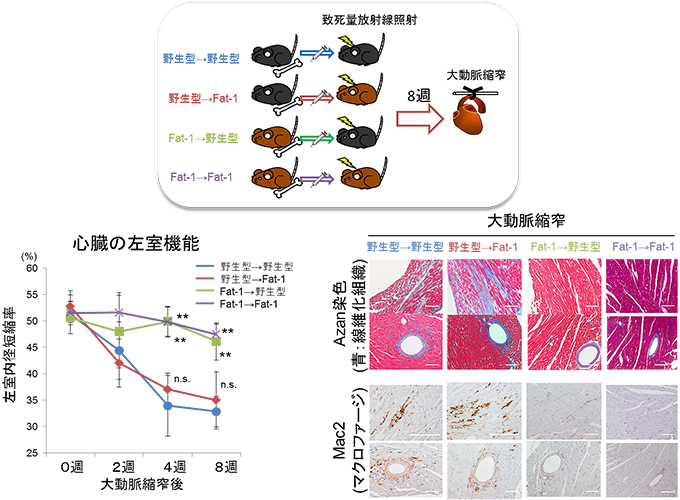
図5 Fat-1 Tgマウスの骨髄を移植したマウスは心臓リモデリングに対し抵抗性を示した
- (上)野生型あるいはFat-1 Tgマウスから採取した骨髄細胞を致死量の放射線を照射して造血系を破壊した野生型あるいはFat-1 Tgマウスに移植して骨髄細胞移植キメラを作製し、移植を受けたマウスの造血系を移植した骨髄細胞によって入れ替えた。移植後8週目にそれら4種の群のマウスに大動脈窄術を行った。
- (下)骨髄細胞がFat-1 Tgマウス由来のマウスにおいて、術後4週目以降の左心室機能が維持され(左)、心組織の線維化やマクロファージ浸潤の抑制(右)が認められた。実験法は図4と同様(野生型→野生型と比較して統計学的有意差あり ** P<0.01、有意差なし n.s.)。
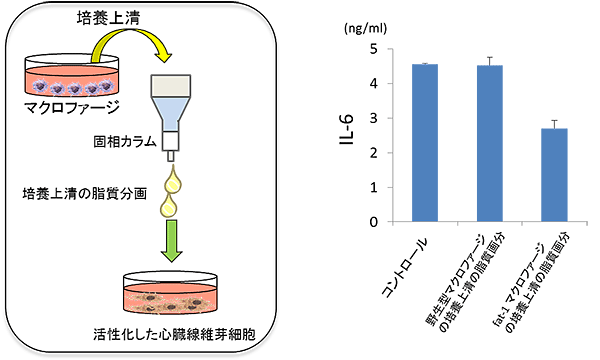
図6 Fat-1 Tgマウス由来マクロファージの培養上清中の脂肪酸分画に、線維芽細胞の活性化を抑制する因子が含まれていた
- (左)野生型あるいはFat-1 Tgマウスからマクロファージを取得して培養し、その培養上清から固相カラムにより脂肪酸分画を取得した。野生型マクロファージの培養上清を用いて線維芽細胞を活性化する際に、それら脂肪酸分画を添加した。
- (右)活性化した線維芽細胞は炎症性のサイトカインであるIL-6注6)を産生するが、Fat-1 Tgマウスのマクロファージの脂肪酸分画を添加して培養すると、産生量が減った。
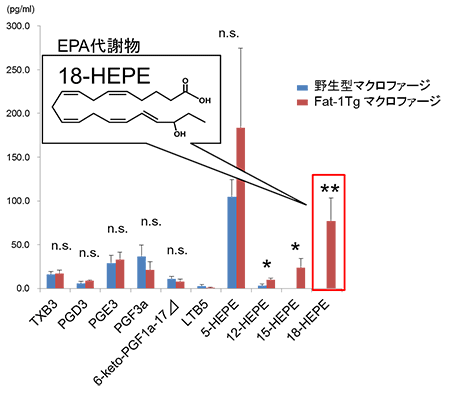
図7 マクロファージの脂肪酸分画のLC-MS/MSを用いたメタボローム解析
野生型とFat-1 Tgのマクロファージ培養上清中の脂肪酸分画における、EPA代謝物の量を分析した。いくつかの代謝物の量が有意に異なっていたが、特にEPA由来の18-HEPEがFat-1 Tgマクロファージで顕著に増加していた(野生型マクロファージと比較して統計学的有意差あり * P<0.05、** P<0.01、有意差なし n.s.)。
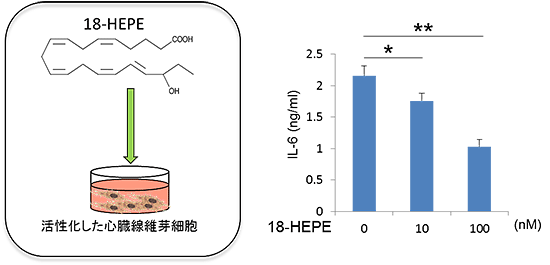
図8 18-HEPEはナノモルレベルで線維芽細胞の活性化を抑制した
- (左)Fat-1 Tgマクロファージの培養上清中の増加していた18-HEPEを図6と同様に試験管内で線維芽細胞の活性化時に添加した。
- (右)ナノモルレベルで線維芽細胞の活性化を抑制した(0ナノモルと比較して統計学的有意差あり * P<0.05、** P<0.01)。
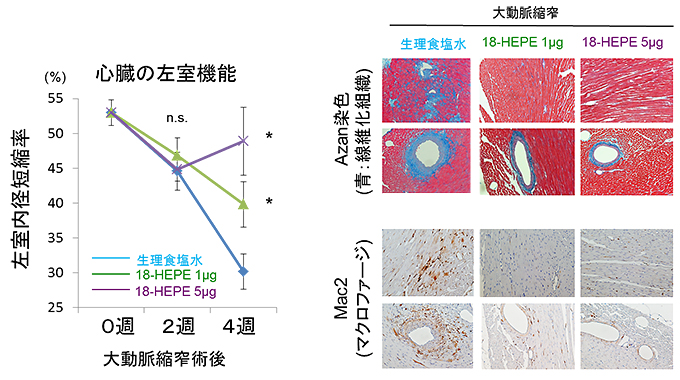
図9 18-HEPEの投与によって圧負荷による心臓リモデリングが抑制された
- (左)大動脈縮窄術(圧負荷)後一週間目から隔日で腹腔内に18-HEPEを投与したところ、顕著に心機能の低下を抑えることができた(生理食塩水と比較して統計学的有意差あり * P<0.05、有意差なし n.s.)。
- (右)18-HEPEの投与により、心臓の線維化とマクロファージの集積が抑制された。実験法は図4と同様。
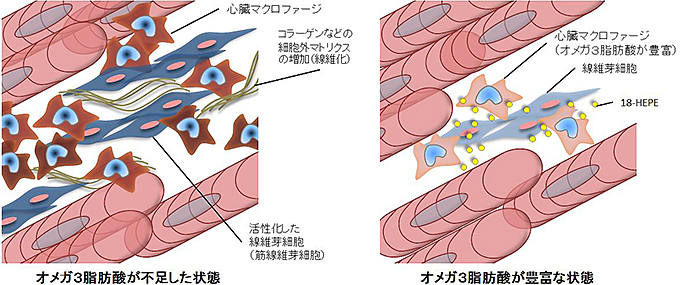
図10 オメガ3脂肪酸の心臓リモデリング抑制作用のメカニズム
今回の研究で、オメガ3脂肪酸の心臓保護効果にはマクロファージの機能が重要であることが分かった。マクロファージが心臓局所で産生する18-HEPEが、継続する圧負荷により最終的に心不全へと至る原因となる心臓リモデリングの背景にある慢性炎症および線維化を抑制し、心機能を改善すると考えられる。
<用語解説>
- 注1) オメガ3脂肪酸
- オメガ3位に二重結合を持つ不飽和脂肪酸の総称で、αリノレン酸、エイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などがこれに含まれる。
- 注2) メタボローム解析
- 生体内に存在する代謝物を網羅的に解析する手法のこと。
- 注3) アラキドン酸
- オメガ6脂肪酸に分類される必須脂肪酸であり、プロスタグランジンやロイコトリエンなどの脂質メディエーターの前駆体である。
- 注4) 高速液体クロマトグラフィー・タンデム質量分析システム(LC-MS/MS)
- 液体クロマトグラフィーによる分離と質量分析を組み合わせることにより、高感度化および化合物の構造に対して特異性の高い分析を可能にしたシステムのこと。メタボローム解析における主要な分析手法の1つである。
- 注5) 大動脈縮窄(だいどうみゃくしゅくさく)
- 大動脈内腔の限局的な狭窄により左心室に持続的な圧負荷がかかる状態のこと。
- 注6) IL-6
- 代表的な炎症性サイトカインであり、心不全患者でこの血中濃度が上昇しており生命予後と関連するという報告がある。また、心臓リモデリングにおいて、活性化した心臓線維芽細胞(筋線維芽細胞)が、これを含むさまざまなサイトカインを産生することが知られている。
<論文タイトル>
“18-HEPE, an n-3 fatty acid metabolite released by macrophages, prevents pressure overload-induced maladaptive cardiac remodeling”
(マクロファージが生成するオメガ3脂肪酸代謝物18-HEPEは圧負荷による心臓リモデリングを抑制する)
doi: 10.1084/jem.20132011
<お問い合わせ先>
<研究に関すること>
有田 誠(アリタ マコト)
理化学研究所 統合生命医科学研究センター(IMS) メタボローム研究チーム チームリーダー
〒230-0045 神奈川県横浜市鶴見区末広町1-7-22
Tel:045-503-7055 Fax:045-503-7054
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:
理化学研究所 広報室 報道担当
〒351-0198 埼玉県和光市広沢2-1
Tel:048-467-9272 Fax:048-462-4715
E-mail:
東京大学 大学院薬学系研究科 庶務チーム
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4719 Fax:03-5841-4711
E-mail: