名古屋大学 大学院工学研究科 化学・生物工学専攻の石原 一彰 教授、ウヤヌク・ムハメット 助教、林 裕樹 (博士後期課程2年生)は、光学活性次亜ヨウ素酸塩触媒による不斉注1)酸化的六員環化反応注2)を開発し、天然型ビタミンE(α—トコフェロール類)に代表される生物活性を有するクロマン類の形式的不斉全合成注3)を達成しました。
抗酸化作用を持つビタミンEに代表されるクロマン類の多くはキラル化合物であり、望む薬理活性が強い光学異性体を選択的に合成することが求められます。石原教授らは毒性・資源不足が懸念される遷移金属の代替元素として、日本の豊富な資源であるヨウ素に着目し、環境に優しい光学活性次亜ヨウ素酸塩触媒を用いる酸化的エーテル六員環化反応注4)を開発しました。本法の開発により、ビタミンEの全成分(α-,β-,γ-,δ-トコフェロール及びそれらのトコトリエノール体)や様々な生物活性クロマン類の光学活性注5)鍵合成中間体注6)を高収率かつ高選択的に不斉合成できるようになりました。また、反応系に炭酸カリウムを添加することにより、触媒回転数(TON)を10倍以上に向上させることに成功し、触媒量の削減を実現しました。
これらの成果は医薬品製造プロセスや新薬の開発研究に生かされるものと大いに期待されます。
本研究成果は、2014年7月18日(米国東部時間)に米国科学雑誌「Science」で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「プロセスインテグレーションに向けた高機能ナノ構造体の創出」
(研究総括:入江 正浩 立教大学 理学部 教授) |
| 研究課題名 |
「酸・塩基複合型超分子動的錯体を鍵とする高機能触媒の創製」 |
| 研究代表者 |
石原 一彰(名古屋大学 大学院工学研究科 教授) |
| 研究期間 |
平成21年10月~平成27年3月 |
JSTはこの領域で、自己組織化に代表される従来のボトムアッププロセスに、分子レベルでの精緻な機能を利用して自己構造化や自己修復などの新たな手法を取り込んで一段の高度化を図ることによって新規高機能ナノ構造体の創出を目指しています。
<研究の背景と経緯>
天然物のなかにはクロマン骨格を有する生物活性物質が多く見つかっており、その多彩な生物活性及び構造的特徴のため、様々な光学活性クロマン化合物が医薬品として製造されています(図1)。図1に示すクロマン誘導体の赤色で示される分子構造を一般にクロマンと呼びます。その代表的な例として、抗酸化作用を有するα—トコフェロール(ビタミンEの主成分)、トロロックスやMDL-73404、チロシナーゼ活性阻害剤注7)であるジヒドロダエダリンA、抗がん作用を示すMerck社のC48やクルシフォリオール、高血圧の治療薬であるネビボロール、アルドース還元酵素阻害作用を持つSNK-860などを挙げることができます。
その中でも特に、α—トコフェロールは医薬品、食品、飼料などに広く含まれており、疾病の治療、栄養補給、酸化防止剤として利用されています。市販のα—トコフェロールの9割以上は合成品(DL-α-トコフェロール)で、3つのキラル注8)炭素原子がすべてラセミ注9)の8種類の異性体混合物です(図2)。一方、市販の光学活性体D-α—トコフェロールのほとんどは植物油から抽出したα—,β—,γ—,δ-トコフェロールの混合物をメチル化する半合成法で製造されています。トコフェロールの生理活性はクロマン環の2位の立体化学によって大きく異なり、D-α-体が最も強いことがわかっています。α—トコフェロールを含むクロマン化合物の不斉合成法については、これまでに数多く報告されてきましたが、その多くは遷移金属触媒によるカップリング反応注10)であり、これらの触媒に含まれる金属種を最終生成物から完全に除くのが困難であるため、毒性が懸念されます。また製造コストなどでの課題もあり、実用的とはいえませんでした。
一方、石原教授らは、安全性が比較的高く安価な過酸化水素水またはtert-ブチルヒドロペロキシド(TBHP)を酸化剤に用い、遷移金属を含まない毒性の少ない第四級アンモニウムヨージド(R4NI)からin situ注11)で調製される次亜ヨウ素酸塩(R4NOI)を触媒とする酸化的カップリング反応(脱水素型カップリング反応)の開発に世界に先駆けて成功しました(図3)。この酸化反応では有害な物質を副生せず、室温という穏やかな条件で反応が進行する点が大きな利点であり、極めて環境にやさしい反応といえます。
この酸化反応ではヨージド(I–)の対カチオンにキラリティーを導入することで原理的に不斉酸誘導が可能になります。例えば、2010年に触媒量のキラル第四級アンモニウムヨージドを用いてβ-ヒドロキシフェニルケトンの不斉酸化的エーテル五員環化反応を行ない、光学活性2-アシル-2,3-ジヒドロベンゾフラン誘導体を高い不斉収率で定量的に得ることに成功しました(図4)。この研究成果はサイエンス誌に掲載され(Science,2010,328,1376)、世界の学術及び産業に大きなインパクトを与えました。その結果、この研究成果は当該分野の大きなブレークとなり関連研究が世界中で急速な広がりを示しています。なお、基質のカルボニル基の隣接基をN-フェニルイミダゾリル基にすることで、高い不斉収率を達成しました。また、キラル第四級アンモニウムカチオンの設計には、京都大学の丸岡 啓二 教授らによって開発されたキラル相間移動触媒注12)のスピロ型注13)第四級アンモニウムカチオンが最適でした。
<研究の内容>
今回、研究グループは2010年の研究成果(図4)をもとに、メチレン鎖の一つ長いγ-ヒドロキシフェニルケトンを基質として用いることができれば、光学活性2-アシルクロマン誘導体の不斉合成も可能であると考えて研究をスタートしました。しかし、実際には多くの課題が発生しました(図5)。例えば、(1)五員環化反応に比べ六員環化反応は極めて遅いことがわかりました。(2)反応性の低いγ-ヒドロキシフェニルケトンを基質に用いると触媒活性種が失活する傾向があり、五員環化反応と同条件(触媒Aと過酸化水素水を使用)では、長時間撹拌しても反応がほとんど進行しませんでした。(3)たとえ反応が進行しても[触媒Aとtert-ブチルヒドロペルオキシド(TBHP,t-BuOOH)を使用]、エナンチオ選択性注14)は中程度でした。(4)ビタミンEの主成分であるα-トコフェロールをターゲットにしたトリメチルヒドロキノン誘導体を基質に用いた場合、電子豊富なフェノール部位は非常に酸化されやく、副反応が優先しました。
図6に示す予想される反応機構を考察し種々検討した結果、これらの課題解決には、触媒や基質のデザイン及び適切な反応剤(共酸化剤、添加剤)の選択が重要であることがわかりました(図7)。まず、基質のフェノール水酸基(OH)の保護基を電子求引性基(Ts)にすることで、副反応を抑えることができました。また、触媒の対カチオンに長鎖のペルフルオロヘキシル基を導入した触媒B(図8)、酸化剤として工業的に有用なクメンヒドロペルオキシド(CHP)を用いることで2-アシルクロマン誘導体を高収率及び高選択的に得ました。
次に、触媒量を削減する検討を行いました。触媒量を従来の10分の1(1mol%)に減らすと、反応は全く進行しなくなりました。その理由を明らかにするために、本反応の触媒活性種と不活性種をラマン分光注15)測定によって分析しました。その結果、不安定な次亜ヨウ素酸(IOH or IO-)が活性種、安定なトリヨージド(I3–)が不活性種であることが判明しました。トリヨージドはアルカリ条件下で分化され、次亜ヨウ素酸塩と平衡状態になり、そしてそれがさらにヨウ素酸塩(R4NOIO2)へと不均化することが知られています。触媒反応系でも適切な塩基存在下で、活性種の不活性化が抑えられる、あるいは不活性種から活性種への再活性化が可能ではないかと考え種々検討しました。その結果、炭酸カリウムのような無機塩基を添加すると触媒量を0.5mol%まで減らせました(触媒回転数(TON)が200まで向上)。また、反応性の高い五員環化ではTONが2000まで向上しました。こうして塩基が本触媒サイクルの効率化に大きく効果を発揮し、触媒量を大幅に低減させることに成功しました。尚、これらの反応はスケールアップが可能であり、実用化には期待ができます。
本法は他のトコフェロールやクロマン類の合成にも適用できました(図7下)。ビタミンEの全成分(α-,β-,γ-,δ-トコフェロール及びそれらのトコトリエノール体)をそれぞれ高収率、高選択的に合成することに成功しました。特に、γ-とδ-トコフェロールはトコフェロールの中でも高い抗がん作用を持つことが報告されており、最近注目されています。また、チロシナーゼ活性阻害剤であるジヒドロダエダリンAや抗がん作用を示すMerck社のC48の前駆体も同様に合成できました。
興味深いことに、ブロモ基を有する四置換フェノールの基質では、3,3’位の置換基の異なる同じ軸不斉注16)を持つ触媒AとBを用いて、S体とR体注17)の環化生成物をそれぞれ高選択的に合成することができました。これらは両方とも結晶化によって99%eeより高い光学純度注18)にすることができました。エナンチオ選択性についてはペルフルオロヘキシル基を置換基として導入した触媒Bが特に効果的でした。
今回、次亜ヨウ素酸アニオンが触媒活性種であることはわかりましたが、この対アニオンと対カチオンが反応遷移状態においてどの位置に存在するかはまだ不明です。また、カップリング反応の反応機構自体も明らかになっていません。しかし、対カチオンの窒素原子近傍の不斉環境がカップリング反応の不斉誘導に重要な役割を果たしていることは間違いありません。ジヒドロベンゾフラン合成に有効な触媒Aに比べて、かさ高いクロマン合成に有効な触媒Bでは大きなサイズの不斉環境をペルフルオロアルキル鎖で構築しており、より広くて深い鍵穴がアンモニウムカチオン中心近傍にできており、その配座柔軟性注19)が有効に働いたと考察することができます(図8)。
本反応の生成物は、抗酸化作用を示すα-トコフェロールやトロロックス、抗がん作用を示すC48、チロシナーゼ活性阻害剤であるジヒドロダエダリンAなどを全合成するための光学活性鍵合成中間体として有用です。補助基のイミダゾリル基はエステルやアミドなど様々な官能基へ容易に変換することができます。例えば、(1)O-トルエンスルホニル基の脱保護、(2)一回の再結晶操作、(3)イミダゾリル基のエステル変換によってα-トコフェロール、α-トコトリエノール及びトロロックスの光学活性共通鍵合成中間体を99%eeより高い光学純度で合成することに成功しました(図9)。図7に示すその他の前駆体も同様に、それぞれの生物活性物質へと誘導可能であり、本技術は新薬の開発や医薬品の製造プロセスとして利用できると期待されます。
<今後の展開>
環境問題や資源不足などの社会問題が深刻化するなか、遷移金属などのレアメタルや重金属などの毒性の強い金属資源を反応剤や触媒に用いる従来型の有機合成化学からの脱却が求められています。こうした背景のもと、近年、金属を含まない有機分子触媒の開発が国内外で精力的に進められています。しかし、そのほとんどが酸あるいは塩基触媒であり、酸化・還元型の有機分子触媒の開発は遅れています。我が国は資源少国でありながら、世界のヨウ素の1/3を産出しています。このヨウ素に着目し、2007年から遷移金属の代替元素としてヨウ素化合物を触媒的に利用するための研究を行っています。本研究成果で用いられる触媒量のヨウ素化合物は希薄条件下、in situで調製してそのまま反応に用いるので、安全に取り扱うことができ、レアメタルの代替元素としてほとんど毒性をもたない日本に豊富なヨウ素の有用性を強く示すものです。本触媒反応は、遷移金属を全く使用せず、副生成物は水と酸化剤由来のアルコールのみであり、温和な条件下で反応が進行するなどの様々な特長があり、理想の環境低負荷型反応に極めて近いものです。
今後の展望として、実用化に向けた技術の確立が期待されます。本技術は従来技術に比較し、爆発性を有する有機過酸や毒性を有する遷移金属触媒を用いない点に大きな特徴があり、産業界でも環境面からも大きなメリットがあります。また、TBHPやCHP(クメンヒドロペルオキシド)は工業的な酸化剤であり、特別な反応条件を必要としないので、工業的にスケールアップが可能なプロセス技術への展開が期待されます。
<参考図>
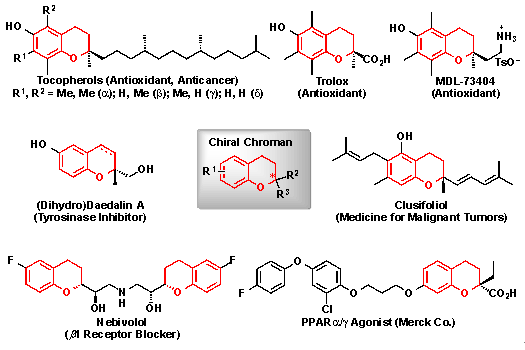
図1 医薬品として利用されているクロマン誘導体の例
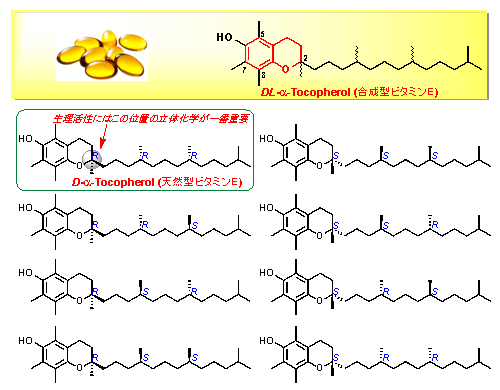
図2 α—トコフェロールの8種類の異性体
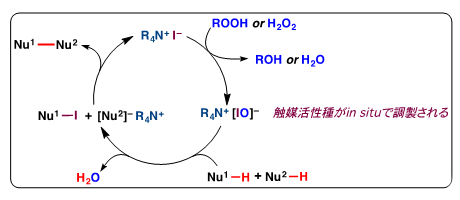
図3 次亜ヨウ素酸塩を触媒とする酸化的カップリング反応
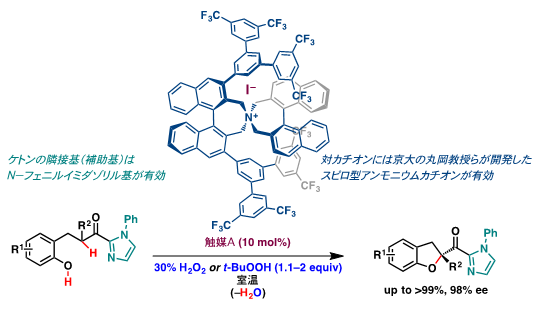
図4 キラル第四級アンモニウムヨージドを用いるβ-ヒドロキシフェニルケトンの
不斉酸化的エーテル五員環化反応
(M. Uyanik, H. Okamoto, T. Yasui, K. Ishihara Science 2010, 328, 1376)
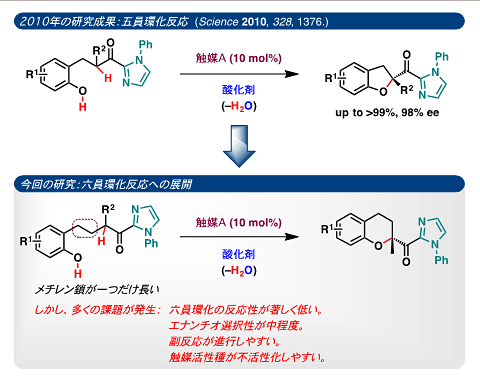
図5 2010年の五員環化反応と六員環化反応の違い
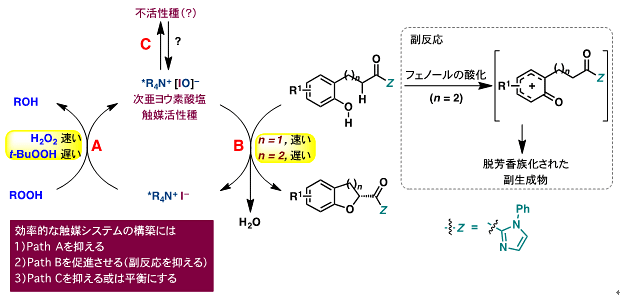
図6 予想される反応機構
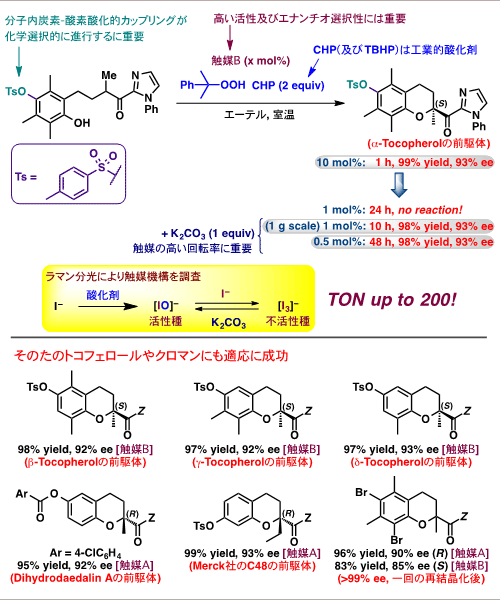
図7 最適条件下での基質適用例
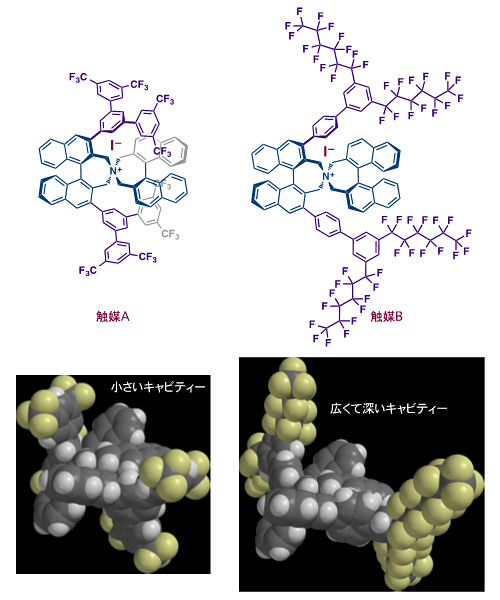
図8 2010年の触媒A及び今回設計した触媒B
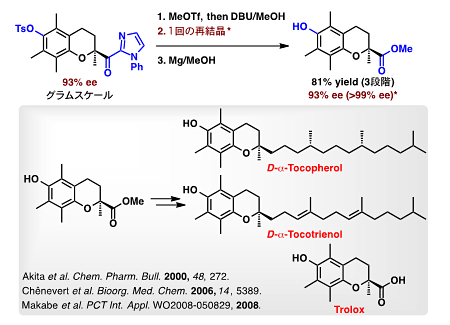
図9 環化生成物のN-フェニルイミダゾリル基の除去と生物活性物質への誘導
<用語解説>
- 注1) 不斉
- 分子などが立体構造に対称性を欠く現象。
- 注2) 酸化的六員環化反応
- 6個の原子からなる鎖状化合物の両末端水素を引き抜いて両末端原子どうしを結合させることにより6員環化する反応。
- 注3)形式的不斉全合成
- 標的物質の全合成の一部を新たに開発し、既知の合成法と組み合わせることで達成する不斉全合成を形式的不斉全合成という。
- 注4)酸化的エーテル六員環化反応
- 6個の原子からなる鎖状化合物の両末端水素を引き抜いて両末端の酸素原子と炭素原子どうしをエーテル結合させることにより6員環化する反応。
- 注5)光学活性
- 鏡像異性体の混合比がどちらかに偏っている状態。
- 注6)鍵合成中間体
- 全合成する際の途中の段階で得られる化合物を合成中間体という。いくつかある合成中間体のなかで重要なものを鍵合成中間体という。
- 注7チロシナーゼ活性阻害剤
- チロシナーゼはメラニン色素をつくり出す酸化酵素です。チロシンというアミノ酸に紫外線が当たるとチロシナーゼが働きメラニンに変化します。チロシナーゼ阻害剤は黒色メラニンの生成を防ぐ効果があります。
- 注8)キラル
- 自らの鏡像と重ね合わすことのできない分子をキラルであるという。
- 注9)ラセミ体
- 鏡像異性体が1:1の混合物。
- 注10)カップリング反応
- 2つの化合物を共有結合でつなぐ反応。分子内カップリングとは一つの化合物のなかに2つの反応点が存在する場合、その2つの反応点どうしでカップリングすることによって環状化合物を合成する反応。
- 注11)In situ
- 「その場」という意味で、ここでは反応フラスコ内で触媒を調製し、単離することなく、そのまま触媒溶液として反応に用いる意味で使用しています。
- 注12)相間移動触媒
- 油相/液相のように異なる二相間で起こる反応を促進する物質。
- 注13)スピロ型
- 8字のように一点で2つの環がつながった構造。
- 注14)エナンチオ選択性
- キラル化合物を合成する際、その両鏡像異性体のどちらか一方を得る選択性。エナンチオ選択性は一般に不斉収率(光学純度)で示す。
- 注15)ラマン分光法
- 物質に単色光を当てて散乱されるとラマン線が現れる。ラマン線の波長や散乱強度を測定して、物質のエネルギー準位を求めたり、物質の同定や定量を行う分光法をラマン分光法と呼ぶ。
- 注16)軸不斉
- キラリティー軸(置換基の組がその鏡像と重ね合わせることができない空間的配置に固定されている軸)を有する分子のキラリティーのことです。
- 注17)S体・R体
- 鏡像異性体(エナンチオマー)の絶対配置を意味する。
- 注18)光学純度
- 鏡像異性体の純度。例えば、S 体が90%、R 体が10%の混合物の場合、光学純度(またはエナンチオ過剰率(enantiomeric excess))は80%eeです。
- 注19)配座柔軟性
- 単結合についての回転や孤立電子対を持つ原子についての立体反転によって相互に変換可能な空間的な原子の配置を立体配座(コンフォメーション)という。その立体配座の柔軟性が配座柔軟性である。
<論文名>
“High-Turnover Hypoiodite Catalysis for Asymmetric Synthesis of Tocopherols”
(高活性次亜ヨウ素酸塩触媒を用いるトコフェロール類の不斉合成)
doi: 10.1126/science.1254976
<お問い合わせ先>
<研究に関すること>
石原 一彰(イシハラ カズアキ)
名古屋大学 大学院工学研究科 化学・生物工学専攻 生物機能工学分野 バイオマテリアル講座 生体機能物質化学研究グループ
〒464-8603愛知県名古屋市千種区不老町 B2-3(611)
Tel:052-789-3331 Fax:052-789-3222
E-mail:
<JST事業に関すること>
古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail:
<報道担当>
名古屋大学 総務部広報渉外課
Tel:052-789-2016 Fax:052-788-6272
E-mail:
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail: