ポイント
- 貪食細胞が体内の異物を「食べ」て除去する現象の分子機序の詳細は明らかとなっていない。
- 特定たんぱく質の細胞表面の局在を分単位で発現・制御できるDISplay法を開発し、「食べる」活性の低い細胞に「食べ」させることに成功。
- 本手法は、複雑な分子経路によって制御されるさまざまな生命現象の研究に応用できる。
JST 戦略的創造研究推進事業において、ジョンズホプキンス大学の井上 尊生 准教授、東京大学 大学院薬学系研究科の小松 徹 特任助教らは、薬によって細胞同士の相互作用を制御する新たな仕組みを確立し、これによって、本来ほかの細胞を「食べる」能力を持たない細胞にこの機能を付与できることを明らかにしました。
貪食(どんしょく)細胞と呼ばれる細胞は、体内に侵入した異物や死細胞を「食べる」能力を持ち、生体防御機構の一翼を担っています。貪食細胞だけが持つ、この「食べる」機能は「ファゴサイトーシス注1)」と呼ばれます。ファゴサイトーシス開始の鍵は、食べるべき対象に、細胞の表面にある各種分子を使って接着することで、これまでに接着分子がいくつか特定されています。
井上准教授らは、どの分子を発現させた時にファゴサイトーシスが起こるのか確かめるためのツールとして、画期的な「DISplay(ディスプレイ)」法を開発しました。本手法では、従来法では困難だった、分単位での細胞表面の発現分子の制御が可能です。さらにこの手法を用いることで、ファゴサイトーシス活性が低い細胞にも「食べ」させることができると分かりました。
本研究手法は、ファゴサイトーシスの分子機構を解明できるだけでなく、細胞同士の相互作用が鍵となるさまざまな生命現象の理解における重要な方法論を提唱するものです。
本研究成果は、2014年7月15日(米国東部時間)発行の米国科学誌「Science Signaling」に掲載されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「細胞機能の構成的な理解と制御」
(研究総括:上田 泰己 東京大学 大学院医学系研究科 教授) |
| 研究代表者 |
井上 尊生(ジョンズホプキンス大学 医学系研究科 准教授) |
| 研究課題名 |
「細胞走化性の再構築」 |
| 研究期間 |
平成23年10月~平成27年3月 |
<研究の背景と経緯>
細胞は、多数のシグナル分子が複雑なシステムを形成し、恒常性を維持しています。例えば、不要になった細胞は、貪食細胞と呼ばれる細胞のファゴサイトーシスという現象によって「食べ」られ、貪食細胞内で消化、除去されます。こうした動的なシステムの成り立ちを理解する目的で、細胞内の構成因子の働きに積極的な変動(摂動)を加え、その応答を調べる研究手法が広く用いられています。遺伝子発現、ノックダウンといった転写レベルで標的たんぱく質のレベルを制御する手法は最も有用なものですが、その摂動にかかる時間が非常に長いことが、秒、分、時間のオーダーでダイナミックに制御される生命現象の理解を目指す目的に不適であるという場面がしばしば訪れます(図1A)。これに対し、有機小分子を用いてたんぱく質を迅速に結合させることによって、より速い時間スケールでの摂動を可能とする実験系が近年相次いで開発され、非常に有用な研究ツールとして発展を遂げています(参考文献1)。この代表的なものは、FKBP、FRBという2つのたんぱく質の相互作用を利用したツールです。FKBP、FRBは、有機小分子ラパマイシン(rapamycin)の添加によって結合する性質を持っています。このような実験系に基づいて、これまでに「細胞内部」の重要な生命現象を速い時間スケールで制御する実験系の開発が精力的に行われてきました。その一方で「細胞表面」の情報伝達を速い時間スケールで制御する実験系というのは、これまでにほとんど開発が行われておらず(参考文献2)、有用な手法の確立が強く望まれていました。
<研究の内容>
細胞表面は、シグナル伝達の授受の場であり、また、細胞がほかの細胞や細胞外基質と相互作用する場であることから、細胞の恒常性の維持に非常に重要な役割を果たしています。そこで、競合の実験系に比べ反応速度の点で優位性を持つFRB-FKBP系をカスタマイズして、細胞外環境と細胞表面の細胞外の生命現象に摂動を加える実験系の開発に着手しました。カスタマイズにあたっての難しさは、細胞膜を透過して細胞の外側に機能性たんぱく質を露出させることが必要である、という点に集約されます(図1B)。そこで、井上准教授らは、目的とする機能性たんぱく質を、細胞内小器官であるゴルジ体注2)の膜上に集積させておき、任意のタイミングで細胞膜に輸送されるたんぱく質と結合させることで、細胞膜外に発現させる実験系を構築することを目指しました。
井上准教授らは、ゴルジ体に留まるたんぱく質(滞在型たんぱく質)と、細胞外膜に輸送されるたんぱく質(輸送型たんぱく質)を結合させれば、滞在たんぱく質も細胞外膜に輸送されるようになるのではないかと考えました(図1C)。そこで、効率的に細胞膜に輸送される組み合わせを探し出すため、滞在型と輸送型のさまざまなたんぱく質をFKBPやFRBに結合したキメラたんぱく質の組み合わせを全6種類作製し、その全ての組み合わせの輸送効率を試しました。その結果、Giantin(ジャイアンティン)のゴルジ体膜貫通部位とK-Ras(K-ラス)の細胞膜標的配列の組み合わせであれば輸送効率が高いことを見いだしました(表1)。膜輸送を利用するという性質上、この局在の変化を伴う摂動系は15分~45分という時間を要しますが、現在ある細胞表面提示の摂動系としては最も速いものです。井上准教授らはこの手法をDISplay(dimerization-induced surface display)と名づけました。
続いてDISplay法をファゴサイトーシスに応用し、本来はファゴサイトーシスが得意でない細胞の表面に必要最小限の関連分子を発現させ、ファゴサイトーシスを誘導できるかを確かめました。具体的には、死細胞の表面にのみ発現する特定の膜脂質を認識して結合する、MFG-E8注3)たんぱく質の一部分(C2ドメイン注4))を、HeLa細胞やCOS-7細胞(どちらも本来はファゴサイトーシスが得意でない)の細胞膜表面に、DISplay法を用いて提示する仕組みを構築しました。この細胞はラパマイシンの添加後1時間以内に、標的となる死細胞と接着することが分かりました。しかし、死細胞をファゴサイトーシスするには至りませんでした(図2)。
先行研究(J.Cell Sci.113,2955(2000))から細胞表面に小さなビーズを付着させておいて、細胞内にあるRac1注5)たんぱく質を活性化させると細胞がビーズを「食べる」ことが分かっていました。ファゴサイトーシスでは、死細胞を取込むため細胞の形状を大きく変える必要がありますが、Rac1たんぱく質は細胞骨格注6)であるアクチンの再編成を促します。そこでDISplay法を適用した細胞内で、Rac1を活性化させることとしました。すると、C2ドメインが細胞表面にあり、かつRac1が活性化した細胞は、死細胞を細胞内に取り込んでおり、ファゴサイトーシス現象が起こることが分かりました。
<今後の展開>
今回の研究で、死細胞との接着およびRac1による細胞骨格の活性化という2つの刺激のみによって、ファゴサイトーシス活性の低い細胞であっても、ファゴサイトーシスを開始させることができると分かりました(図3、図4)。これは、複雑なファゴサイトーシス過程の分子経路を解明するうえで重要な示唆を与えるものです。
また、「DISplay」法は、有機小分子の添加によって細胞現象を任意のタイミングで、分単位で発現制御できるツールです。ファゴサイトーシスだけではなく、細胞同士の相互作用が鍵となるさまざまな生命現象(例えば受精、神経網形成、血管形成、創傷治癒、免疫反応)についての研究にも応用でき、複雑な分子経路の解明や制御を行う際に大いに役立つものと考えられます。
細胞の機能を改変することにより、生命現象の成り立ちを明らかにし、これを基礎研究、医療に役立てることを目指す合成生物学研究の重要性が、強く提唱されています。特に、海外の先端的な研究では、これに基づいて創り出される「人工細胞」の医療への応用可能性を示す研究成果が多数報告されてきており、その実現可能性が議論される段階となっています(参考文献3)。「DISplay」法は、細胞に付与した新しい機能を分単位で発現させることを可能とする点で非常に画期的といえます(参考文献4)。今後の展開としては、DISplay法をさらに改良することでファゴサイトーシスの効率と精度を高めること、またそうした次世代型DISplay法を適用することで、将来的にがん細胞などの病原細胞を生体内でファゴサイトーシスできるような人工細胞を作製し治療に応用することが挙げられます。
<参考図>
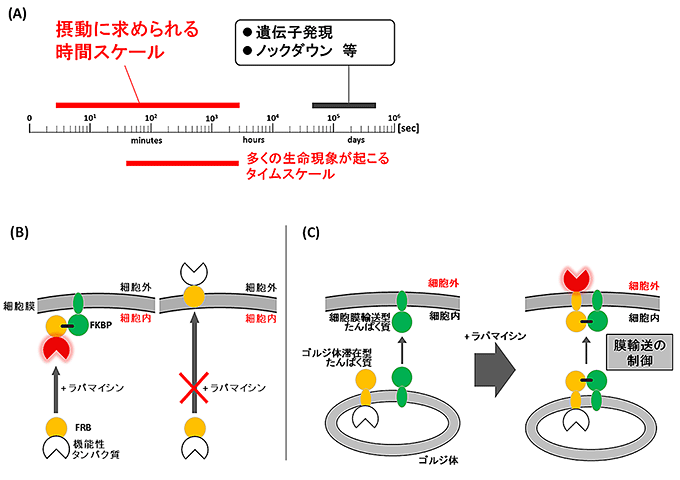
図1 DISplay法の時間スケールとその仕組み
-
(A)生命現象の摂動に求められる時間スケールと遺伝学的手法による摂動の時間スケール。
-
(B)緑の丸はFKBP。黄色の丸はFRB。チューリップ形は標的たんぱく質で、機能発現を、白色から赤色への変化で示している。
-
- (左)有機小分子によるFRB-FKBP相互作用系を利用して細胞膜の内側でシグナル伝達を制御する仕組み。FKBPを細胞内の膜構造に結合させた形、FRBを細胞膜に移行すると活性化する標的たんぱく質をつなげた形で、それぞれ細胞内に発現させておく。任意のタイミングでラパマイシンを添加するとFRBがFKBPと結合するので、FRBにつなげたたんぱく質も細胞膜の内側に移動して活性化する。これまでに、さまざまな分子の働きを秒~分単位で活性化する実験系の開発が進んでいる。
- (右)この実験系をカスタマイズして細胞外の生命現象を操作するには、細胞膜の外側に標的たんぱく質を発現させるため、細胞膜を透過させる仕組みを考案する必要がある。
-
(C)「DISplay」のコンセプト。緑の丸はFKBP、緑の楕円はK-Rasの細胞膜標的配列、黄色の丸はFRB、黄色の楕円はGiantinのゴルジ体膜標的配列。チューリップ形はMFG-E8たんぱく質の一部分(C2ドメイン)で、機能発現を白色から赤色への変化で示している。膜たんぱく質は遺伝子から翻訳されたあと、細胞内小器官のゴルジ体で加工を受けてから細胞膜に輸送される。一方、たんぱく質の中には、ずっとゴルジ体に滞在して蓄積するものもある。そこで、ゴルジ体滞在型たんぱく質とFRBをつなげたたんぱく質と、細胞膜輸送型たんぱく質とFKBPをつなげたたんぱく質を細胞中に発現させる。たんぱく質の組み合わせを検討し、ラパマイシンを投与するとFRBとFKBPが結合し、細胞膜に輸送される系を構築できた。FRBにさらに機能性たんぱく質をつなげておけば、輸送によって活性化することとなる。
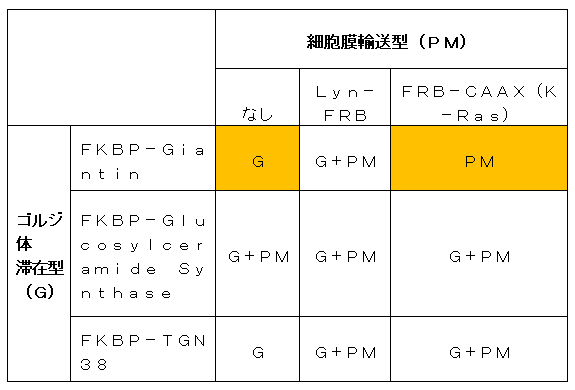
表1 「DISplay」法開発にあたって検討したたんぱく質の組み合わせ
ゴルジ体滞在型たんぱく質として3種類(Giantin、Glucosylceramide Synthase、TGN38)、細胞膜輸送型たんぱく質として2種類(Lyn、K-Ras)、計6通りの組み合わせを検討した。その結果、Giantin(ジャイアンティン)のゴルジ体膜標的配列とK-Ras(K-ラス)の細胞膜標的配列の組み合わせでは、Giantinだけではゴルジ膜に滞在する(G)ところ、細胞膜へ輸送されるようになった(PM)。
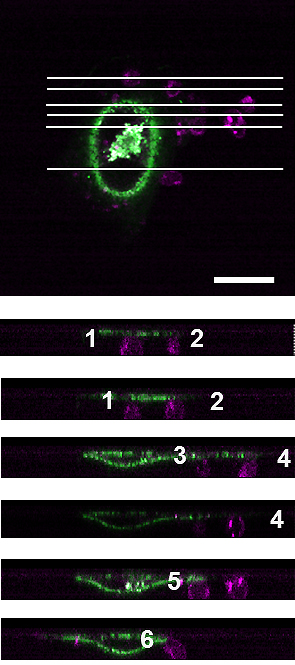
図2 MFG-E8たんぱく質は細胞を死細胞へ誘導するが、「食べ」させるに至らない
死細胞(ピンク)がDISplay法を施したHeLa細胞(緑)に結合はしているが、細胞内にはないことを示している。一番上の図は細胞群を上から観察したもので、白い太線は20マイクロメートルを示す。下図は細胞を横から眺めたもの。それぞれの図は上図の細胞を横切る細い線に対応する(上図の線と下図の並び順は同じ)。横から見ることで死細胞が表面に結合はしているが中には存在してない、すなわちファゴサイトーシスが起きていないことを示している。数字は結合した死細胞。全部で6個の死細胞が1つのHeLa細胞に結合している。
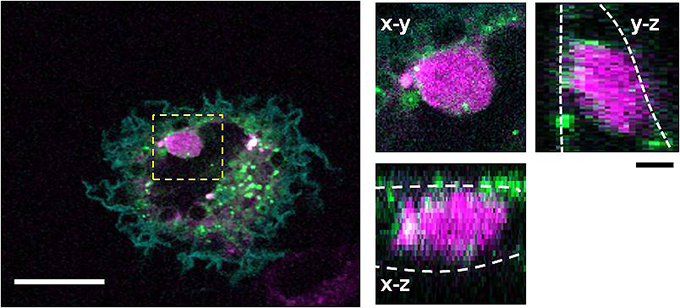
図3 MFG-E8たんぱく質のC2ドメイン提示とRac活性化により細胞が死細胞を「食べ」た
死細胞(ピンク)がDISplay法を施したHeLa細胞(緑)の内部に存在することを示している。左図は細胞を上から観察したもので、白い太線は20マイクロメートルを示す。右図は左図の黄色い点線の部分を拡大し、さらにさまざまな角度から眺めたもの。それぞれの図はx-y、y-z、x-z面から細胞を観察したもので、白い点線はHeLa細胞の細胞膜の位置を示す。死細胞が上下の細胞膜の間に存在することが確認できる。すなわちファゴサイトーシスがおきていることを示している。黒い太線は4マイクロメートルを示す。
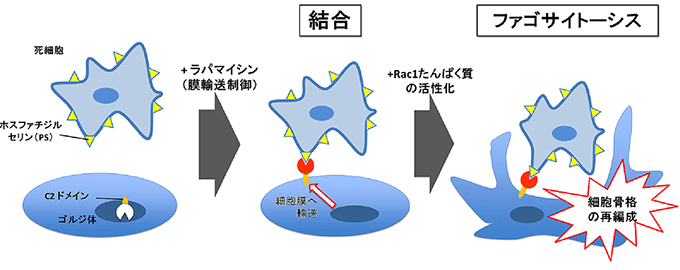
図4 有機小分子の添加による死細胞への結合とファゴサイトーシス開始過程制御の概略
C2ドメインを細胞膜上に発現させることで死細胞(アポトーシス細胞)との接着を制御することが可能であり、ここで低分子量Gたんぱく質Rac1が活性化されていると、ファゴサイトーシスが引き起こされることが確かめられた。
<用語解説>
- 注1) ファゴサイトーシス
- 外部から侵入した異物や生体内の死細胞などを細胞内に取込む仕組みのこと。免疫担当細胞であるマクロファージなど一部の細胞のみが行う。マクロファージのファゴサイトーシス開始過程においては、細胞表面に発現する膜たんぱく質(MFG E-8やTim4やGas6)を通して標的となる死細胞へ結合し、インテグリン受容体下流のエフェクターの活性化が起こるなど、非常にたくさんの分子が相互作用している(参考文献5)。
- 注2) ゴルジ体
- 細胞の郵便局。小胞体で作られたたんぱく質を標的配列(住所)に応じて仕分けする。
- 注3) MFG-E8
- マクロファージの表面に発現しているインテグリン受容体と死細胞表面にのみ発現している標識の2つに同時に結合するたんぱく質。生体内で起こる効率的なファゴサイトーシスに必要不可欠。
- 注4) C2ドメイン
- MFG―E8の一部分で死細胞表面にのみ発現している標識(フォスファチジルセリン)に結合する。
- 注5) Rac1
- 低分子量Gたんぱく質でアクチンを基礎とする細胞骨格の再編成を行う。一般的に細胞の運動性を司る。
- 注6) 細胞骨格
- 細胞の屋台骨の役割をになう構造。代表的なものがアクチン、微小管、中間径フィラメントの3種類で、細胞の形や運動性を制御している。
<論文タイトル>
“Rapidly rendering cells phagocytic through a cell-surface display technique and concurrent Rac activation”
(ディスプレイ法とRac活性化により細胞に食べる機能を付与)
doi: 10.1126/scisignal.2005123
<参考文献>
1.研究代表者が主著者となっている代表的な研究成果として、Nat.Methods 2、415-418(2005),Science,314,1454-1457(2006)、Nat.Methods 7,206-208(2010)などが挙げられる。
2.細胞表面の制御に関する先行研究は主に2つ。Science 287,2007(2000)では、生きた細胞の表面をシュタウディンガー反応という有機化学処理により、有機小分子で修飾した例がある。しかしこの手法は有機小分子への適用に限定され、また3日間というとても長い反応時間が必要。2例目はJ.Cell Biol.201,631(2013)で、光照射を刺激として、細胞の小胞体からゴルジ体を経て細胞膜表面にたんぱく質を輸送する手法が報告されている。この手法の限界は、312ナノメートルとかなり毒性の強いUV光をあてること、また時間が2-3時間かかること、そして比較的新しい研究のため、まだ応用例がないことが挙げられる。
3.関係する研究例としては、Nature 488、384-(2012)、Science 332、1565-1568(2011)などが挙げられ、関連するレビューとしてはSci.Trans.Med. 5、179-、(2013)などが挙げられる。
4.DISplay法のより詳しい説明は、「生体の科学」(医学書院)の特集「生命動態システム科学」の記事で紹介予定。
5.Trends in cell Biology(2006)16,189
<お問い合わせ先>
井上 尊生(イノウエ タカナリ)
ジョンズホプキンス大学 医学系研究科 准教授
855 N.Wolfe St.453 Rangos,Baltimore,MD,21205
Tel:1-443-287-7668
E-mail:
Website:http://www.jhu.edu/inouelab
小松 徹(コマツ トオル)
東京大学 大学院薬学系研究科 特任助教
東京都文京区本郷7-3-1
Tel:03-5841-1075
E-mail:
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、山岸 裕司(ヤマギシ ユウジ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
東京大学 大学院薬学系研究科 庶務チーム
Tel:03-5841-4719