ポイント
- 単純ヘルペスウイルスは哺乳類の免疫細胞表面にあるたんぱく質のPILRαを利用し
て、免疫応答を抑えることで細胞に感染します。
- PILRαが単純ヘルペスウイルス表面の糖鎖とペプチドを同時に認識する分子機構を
世界で初めて解明しました。
- 感染症・免疫などの生命現象の理解につながるとともに、新規抗ウイルス薬、免疫調節薬、ワクチンの効果を高める薬(免疫賦活化剤、アジュバント)などを開発するための基盤となります。
JST 課題達成型基礎研究の一環として、北海道大学 大学院薬学研究院の前仲 勝実 教授、大阪大学 免疫学フロンティア研究センター/微生物病研究所の荒瀬 尚 教授らの研究グループは、単純ヘルペスウイルスが宿主の免疫細胞から排除されることなく、体内へ入り込む巧妙な感染機構を解明しました。
単純ヘルペスウイルスは脳炎や口唇ヘルペス、性器ヘルペス、皮膚疾患、眼疾患、小児ヘルペスなど、多様な疾患を引き起こす難治性の病原性ウイルスであり、日本だけでも年間約7万人が治療を受けていると言われています。特に、性器ヘルペスは既存の抗ウイルス薬では完治が不可能で、ヘルペス脳炎では致死的もしくは重度の後遺症が残る場合があります。単純ヘルペスウイルスの感染機構の解明は、これらの感染症を制御するうえで大変重要です。
単純ヘルペスウイルスの表面にはさまざまな糖たんぱく質が存在し、その中でもglycoprotein B(gB)が、宿主の免疫細胞表面にあるPILRαたんぱく質と結合すると、それが免疫細胞の攻撃を抑えるスイッチの役割を果たし、単純ヘルペスウイルスは難なく細胞へ侵入します。しかし、それらの結合機構の構造的な基盤は解明されていませんでした。
本研究では、PILRαたんぱく質と、PILRαとgBが結合した複合体の立体構造を世界で初めて明らかにすることによって、原子レベルで結合機構を解明しました。その結果、PILRαはこれまでgBの糖部分を認識していると考えられていましたが、実際は糖部分とたんぱく質(ペプチド)部分の両方を同時に認識していました。さらに、PILRαたんぱく質に結合する7アミノ酸からなる糖ペプチドを加えると、PILRαたんぱく質を競合阻害し、単純ヘルペス感染を阻害できることが判明しました。
PILRαは免疫系、神経系、ウイルス感染において幅広く機能を発揮しており、今回明らかとなった新しい認識機構は、ウイルス侵入メカニズムの理解や侵入阻害剤の開発だけでなく、PILRαによる広範な免疫の調節機構の理解とその調整薬やワクチンの効果を高める薬(免疫賦活化剤、アジュバント)の開発につながると考えられます。
本研究成果は、2014年6月2日(米国東部時間)の週に米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「アレルギー疾患・自己免疫疾患などの発症機構と治療技術」
(研究総括:菅村 和夫 宮城県立病院機構 理事長) |
| 研究課題名 |
「ペア型レセプターを標的とした免疫・感染制御技術の開発」 |
| 研究代表者 |
荒瀬 尚(大阪大学 微生物病研究所 教授) |
| 共同研究者 |
前仲 勝実(北海道大学 大学院薬学研究院 教授) |
| 研究期間 |
平成21年10月~平成27年3月 |
JSTはこの領域で、アレルギー疾患や自己免疫疾患を中心とするヒトの免疫疾患を予防・診断・治療することを目的に、免疫システムを適正に機能させる基盤技術の構築を目指しています。
上記研究課題では、病原体などに対する生体防御や自己免疫疾患などの発症に重要な役割を持つと考えられている、抑制化と活性化の両方のレセプターからなるペア型レセプターを標的として、その免疫制御機構を解明するとともに、病原体や腫瘍、あるいは自己免疫疾患やアレルギー疾患の新たな治療法の開発を目指します。
<研究の背景と経緯>
DNAからつくられたたんぱく質はその後、糖鎖やその他分子が付加されることで、生体内で機能するようになります。翻訳後修飾の1つであるO型(オー型)糖鎖注1)修飾は、生理学的事象で非常に重要ですが、構造的に複雑で多様で不均一であるため、その詳細な機能について理解することは困難でした。一方で、複雑な構造であるために、生体内では細胞の状態のマーカーとして機能しています。例として、腫瘍形成・転移および免疫システム、感染症、血液型、発生・分化において、さらにバイオ医薬においてもその機能の重要性が近年注目されています。
単純ヘルペスウイルスは、好中球やマクロファージなどの免疫細胞表面にある抑制型免疫受容体PILRαを利用して宿主の免疫系に排除されず、宿主に感染しています。これまでに、ウイルス膜表面に存在するエンベロープ分子注2)gBたんぱく質の、安定な構造をとっていないフレキシブルな領域に含まれるO型糖鎖修飾部位にPILRαが結合することによって、細胞侵入が誘導されることが分かっていました(図1)。しかし、PILRαが不均一なO型糖鎖と非構造的なペプチド領域をどのように特異的に認識しているのか、その立体構造や認識機構についての知見は得られておらず、詳細は不明のままでした。
<研究の内容>
今回研究グループは、リガンド結合前のPILRα(PILRα単体)、および結合後のPILRα(複合体)の結晶構造を決定することに成功しました。
まず、ウイルス表面のgBたんぱく質のうち、PILRα結合に必要な部位の同定を行いました。さまざまな構造の糖やgBたんぱく質のPILRα結合領域(図1)周辺の糖ペプチドを用いて、PILRαがgBたんぱく質を認識するために必要なユニット構造を同定しました。その結果PILRαは特定のgBペプチド(Gly-3Pro-2Ala-1Thr+1Pro+2Ala+3Pro+4)を含むシアル化O型糖鎖注3)を認識することが分かりました。逆に、単純ヘルペスウイルスが侵入する際に、この7つのアミノ酸からなる糖ペプチドを添加すると、PILRαのgB結合部位がふさがれ、侵入阻害剤として利用できることが分かりました。
構造解析のためにPILRα単独およびこの糖ペプチドを混合したPILRαの結晶化を行い、高エネルギー加速器研究機構の放射光施設Photon Factory、および理化学研究所のSPring-8においてX線回折データを収集しました。その結果、PILRα単独の結晶構造は1.3Å(オングストローム)の分解能で決定することができました(図2左)。PILRαは典型的な免疫グロブリン様ß-サンドイッチ構造注4)を持っていることが分かり、既知構造ではシアル酸注5)を認識する受容体Siglecファミリー注6)の1つ、Siglec-1/sialoadhesinと最も高い相同性を示しました。また、Siglecファミリーで保存され、シアル酸認識に必須であるアルギニン残基、“essential R”がPILRαでも保存されており、糖との結合に寄与していることが予測されました。
次に、単純ヘルペスウイルスgBたんぱく質由来の糖ペプチドとの複合体構造を決定しました(図2中央・右)。PILRαは糖部分だけではなく、ペプチド領域も同時に認識するというユニークな結合をしていました(図2右)。また、結合に伴い、PILRαは大きく構造変化しており、変化した部分は糖ペプチドの認識に直接関わっていました(図2)。また、“essential R”に相当する126番目のアルギニン残基(Arg126)はリガンドである糖ペプチドのシアル酸と直接作用しており(図3)、PILRαにおいても、“essential R”が糖認識において必須であることを結晶構造から明らかにすることができました。さらに、結晶構造解析によって分子レベル、細胞レベルで変異体解析注7)を行い、糖ペプチドとPILRαの相互作用には糖、ペプチドの両方が必要であること、“essential R”がシアル酸認識に必須であることを確認しました。さらに、PILRαに結合する複数のたんぱく質の共通モチーフについては今まで不明でしたが、今回得られた構造情報からその結合モチーフを推定しました。
<今後の展開>
PILRαのリガンドとなるO型糖鎖修飾たんぱく質は近年続々と同定され、PILRαリガンドファミリーを形成しています。それらは、①シアル化が必須であること、②シアル酸を含む糖鎖の構造が重要であること、③O型糖鎖修飾されたペプチド配列にも特異性があること、というユニークな特徴を示しています。また、免疫細胞に発現するものだけではなく、神経細胞に発現するものも存在し、PILRαを介するシグナルの幅広い機能が示唆されています。今回その認識機構は、他の糖認識受容体とは異なり、糖だけでなく糖とペプチドの両方を同時に認識していることが明らかになりました。PILRαは、免疫系、神経系、ウイルス感染において幅広く機能を発揮しており、PILRαを阻害する単純ヘルペスウイルスの侵入阻害剤の開発のみでなく、PILRαを介する免疫の調節を行う薬剤の開発に必須となるデータを得られたことになります。今後、抗ウイルス薬や免疫調節薬・ワクチンの効果を高める薬(免疫賦活化剤、アジュバント)の開発における基盤情報として利用していく予定です。
<参考図>
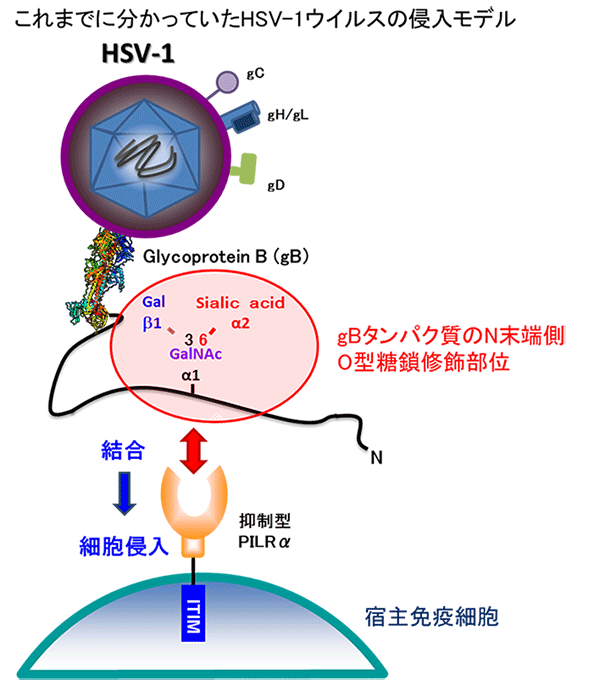
図1 これまでに分かっていた単純ヘルペスウイルス(HSV-1)の細胞侵入機構
単純ヘルペスウイルスは、宿主の免疫細胞上の抑制型受容体PILRαに結合することによって宿主細胞へ侵入し、感染が成立する。これまでにPILRαは、gBたんぱく質の構造的部位ではなく、フレキシブル領域のO型糖鎖および修飾されているペプチド領域に結合することをすでに報告してきた。
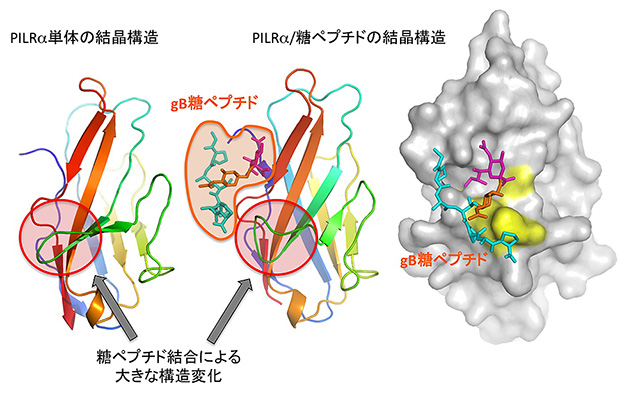
図2 今回明らかにしたPILRα単独および糖ペプチド複合体の結晶構造
単純ヘルペスウイルスgBたんぱく質の一部である糖ペプチドを結合前(左)と結合後(真中および右)のPILRα構造をリボンモデルで示しました。黄色で囲ったスティックモデル表示の糖ペプチドが結合することによって、PILRαの全体構造は変化しませんが、赤色で囲った部分が大きく構造変化(主に黄緑色のリボンの構造変化)していることが分かります。右図では、糖鎖(マジェンタとオレンジ色)とペプチド(シアン)が同時にPILRαに認識されていることが分かります。
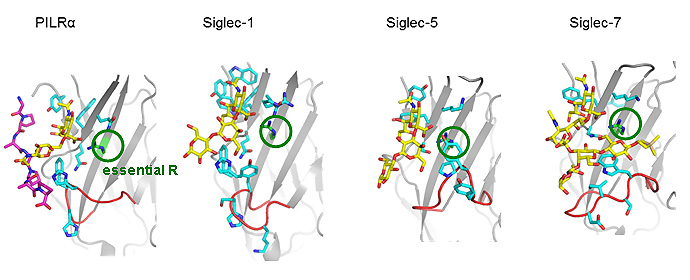
図3 PILRαと構造類似性の高いSiglecファミリー/糖リガンドとの構造比較
受容体(PILRαとSiglecファミリー)をリボンモデル、糖リガンドをスティックモデルで表示し、Siglecファミリーで高度に保存されているリガンド結合部位のアルギニン残基“essential R”を緑色で囲みました。黄色で示した糖の認識にどの受容体においてもessential Rが直接関与していることが分かります。PILRαとSiglecファミリーの配列相同性は高くありませんが、全体構造およびリガンド認識における重要残基は保存されていました。
<用語解説>
- 注1) O型糖鎖
- たんぱく質のセリンまたはスレオニン残基に結合している糖鎖。一方、アスパラギン残基に結合している糖鎖はN型糖鎖と呼ぶ。
- 注2) エンベロープ分子
- 単純ヘルペスウイルス、インフルエンザウイルス、ヒト免疫不全ウイルスなどのウイルス粒子を覆っている表面の膜構造に埋まっているたんぱく質。宿主細胞への感染時に重要な役割を果たしている。
- 注3) シアル化O型糖鎖
- シアル酸を含むO型糖鎖。
- 注4) 免疫グロブリン様ß-サンドイッチ構造
- 免疫グロブリン様分子に特徴的なß-シートが、互いに向かい合って球状ドメインを形成する構造。
- 注5) シアル酸
- 細胞表面の糖鎖の末端に付加している糖の一種。最も一般的なシアル酸はNeu5Acで、生体内には多数のシアル酸誘導体が存在する。
- 注6) Siglecファミリー
- Sialic acid binding Immunoglobulin-like lectin(Siglec)ファミリーは、シアル酸に特異的に結合するレクチンの一種。複数のIgドメインから構成されるI型膜たんぱく質であり、ヒトではこれまでに14種類のSiglecが同定されている。
- 注7) 変異体解析
- たんぱく質の機能的に重要だと思われる部位のアミノ酸残基を本来とは異なるアミノ酸に置換することによって、機能の消失または維持を調べる方法。本研究では、糖ペプチド結合に関与すると予想されるPILRαのアミノ酸残基をAlaに置換し、結合能と感染能の変化を調べた。
<論文タイトル>
“Structural basis for simultaneous recognition of an O-glycan and its attached peptide of mucin family by immune receptor PILRα”
(免疫受容体PILRαによるムチンファミリーのO型糖鎖とそれに結合したペプチドの同時認識機構の構造基盤)
doi: 10.1073/pnas.1324105111
<お問い合わせ先>
<研究に関すること>
前仲 勝実(マエナカ カツミ)
北海道大学 大学院薬学研究院 教授
〒060-0812 北海道札幌市北区北12条西6丁目
Tel:011-706-3970 Fax:011-706-4986
E-mail:
荒瀬 尚(アラセ ヒサシ)
大阪大学 微生物病研究所/免疫学フロンティア研究センター 教授
〒565-0871 大阪府吹田市山田丘3−1
Tel:06-6879-8291 Fax:06-6879-8290
E-mail:
WEB:https://immchem.biken.osaka-u.ac.jp
<JST事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: