ポイント
- 糖尿病やメタボリックシンドロームでは、しばしば血管の障害と細胞老化が合併する。
- 血管老化によって筋肉の代謝機能が低下して、エネルギー消費が阻害されることを発見。
- 糖尿病の血管病変による老化が、さらに肥満や糖尿病を悪化させている可能性を示す。
JST 課題達成型基礎研究の一環として、新潟大学の南野 徹 教授らは、高カロリー食投与によって引き起こされた血管老化が、筋肉でのエネルギー消費を阻害することをマウスの実験で発見しました。
糖尿病やメタボリックシンドローム注1)では、動脈硬化に伴って血管の老化が進んでいることが、これまでの本研究グループの報告などで知られていました。しかし、その逆に血管の老化が、糖尿病やメタボリックシンドロームにどのような影響を及ぼしているかはよく分かっていませんでした。
今回、老化した血管が骨格筋におけるエネルギー消費を妨げることを発見しました。通常筋肉では、血流から糖(グルコース)を取り込んで、細胞内のミトコンドリア注2)と呼ばれる小器官でエネルギーを作り出します。しかし、高カロリーの食事を投与された糖尿病病態モデルマウスでは、血管細胞が老化することで、筋肉への糖輸送や、筋肉におけるミトコンドリアの合成能が障害されていることが分かりました。この障害によって余剰となったカロリーが内臓脂肪として蓄積し、肥満や糖尿病がさらに悪化すると考えられます。
これまで、糖尿病で合併する血管障害は、糖尿病の病態の結果と考えられていました。しかし今回の成果で、血管の細胞老化注3)によって肥満や糖尿病がさらに進行する悪循環を引き起こしている可能性を示しました。
本研究は、千葉大学と共同で行われたものです。本研究成果は、2014年5月22日(米国東部時間)に米国科学誌「Cell Reports」でオンライン公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長) |
| 研究課題名 |
「長寿・老化モデルマウスを用いた慢性炎症機構の解明」 |
| 研 究 者 |
南野 徹(新潟大学 医学部 循環器内科学分野 教授) |
| 研究期間 |
平成23年10月~平成27年3月 |
<研究の背景と経緯>
細胞は過度のストレスを受けると、細胞老化と呼ばれる増殖停止状態が誘導されます。この現象は、遺伝子が障害を受けて細胞ががん化することを防ぐためと考えられていますが、身体全体の老化にも影響し、さまざまな加齢関連疾患の発症にも関与していることが分かってきています。
現代社会の生活習慣により、糖尿病やメタボリックシンドローム、肥満といった病態は、大きな社会問題となりつつあります。これまでに多くの研究で、肥満により内臓脂肪組織に脂肪が蓄積すると脂肪組織が慢性の炎症状態になり、糖代謝が抑制されて糖尿病を引き起こすことが分かっています。そして、糖尿病やメタボリックシンドロームは、心臓病や脳卒中・腎不全など多くの合併症を引き起こす疾患ですが、これらの合併症の多くに血管病変が関与しています。血管病変に基づく糖尿病の合併症として糖尿病網膜症や糖尿病腎症などがよく知られています。また、この血管病変において、細胞が老化していることが近年分かってきました。しかし、そうした血管の細胞老化が肥満・糖尿病といった慢性の代謝性疾患に対しどのような影響を及ぼすのか知られていませんでした。そこで南野教授らは、新たな治療標的の可能性を考え、肥満・糖尿病における血管老化の役割を解明することにしました。
<研究の内容>
南野教授らは、まず細胞老化経路における鍵分子p53注4)に着目し、肥満・糖尿病モデルでの機能解析に取り組みました。老化分子p53は、細胞が度重なる細胞分裂や放射線・酸化ストレスなどの刺激を受けて発現上昇/活性化し、機能異常を起こした細胞の分裂を停止させたり、細胞自殺に追い込んだりすることが分かっています。この老化分子p53の発現量をマウスで観察するために、高カロリー食を与えることで糖尿病を発症させました。すると、この糖尿病マウスは、血管細胞における老化分子p53の発現が上昇していました(図1)。
次に、血管細胞におけるp53の発現が、糖尿病発症過程においてどのような役割を果たしているのかを調べるために、血管細胞だけでp53を欠損(血管老化抑制)させたマウスを作製し、高カロリー食を投与しました。その結果、このマウスでは野生型糖尿病マウスと比較して糖代謝機能の悪化度が少なく、肥満も野生型糖尿病マウスより抑えられていました(図2)。血管細胞でのp53活性化は、肥満・糖尿病に悪影響を及ぼしていたことになります。
続いて、血管細胞でのp53分子が、糖代謝機能の変化の過程においてどのような機能を果たしているのか、糖代謝に関わるさまざまな経路を探索しました。まず、エネルギー消費量の変化を調べたところ、血管老化抑制マウスは野生型マウスより酸素消費量が多く(図3)、筋肉へのグルコース取り込み量が高いことが分かりました(図4)。
さらに、筋肉へのグルコース輸送機能について調べたところ、糖尿病を発症させた野生型マウスは、血管細胞において、グルコース輸送の一部を担う輸送分子Glut1注5)の発現が減少しましたが、血管老化抑制マウスでは変化がありませんでした。そして、血管老化抑制マウスのGlut1の発現を抑制すると、筋肉へのグルコースの取り込みが抑制されました(図5)。このことは、高カロリー食の摂取による血管細胞でのp53発現がGlut1の発現を抑制し、血管から筋肉へのグルコース供給が抑制されることを示しています。
また、野生型マウスでは、糖尿病を発症させると、血管細胞での一酸化窒素(NO)産生が低下していました。NOは筋肉細胞に働いてミトコンドリアの合成を促す分子ですが、そのNO産生量の低下によって筋肉細胞内でのミトコンドリアの合成が抑制され(図6)、エネルギー消費量の低下を招いていることも確認しました。
マウスに高カロリー食を与えると、血管細胞内で、老化の鍵分子p53が活性化します。p53の活性化はNOの産生を妨げ、これは筋肉細胞でのミトコンドリアの合成を障害します。同時に、p53の活性化により血管細胞内のグルコース輸送分子Glut1の産生も障害され、筋肉細胞にグルコースが届きにくくなります(図7)。これら2つの経路障害により、余剰となったカロリーが、内臓脂肪として蓄積されるようになります。このような脂肪組織では炎症が生じて、肥満や糖尿病がさらに進行すると考えられます。つまり、糖尿病の血管病変では老化が進むことから、肥満や糖尿病がさらに悪化する悪循環を引き起こしていると考えられます(図8)。
<今後の展開>
これまで、一般に糖尿病でしばしば合併する血管障害は、糖尿病の病態の結果と考えられていました。しかし今回の成果では、血管の細胞老化が筋肉というほかの組織でのエネルギー代謝に作用して糖尿病を悪化させるという、全く新しい可能性を示しています。細胞老化の鍵因子p53はがん抑制遺伝子でもあるため、p53そのものを治療標的とすることは難しいと思われますが、今後この側面からの研究進展は、「血管老化から肥満や糖尿病の進行へ」という悪循環を断ち切るための新たな治療法開発に役立つ可能性があります。
<参考図>
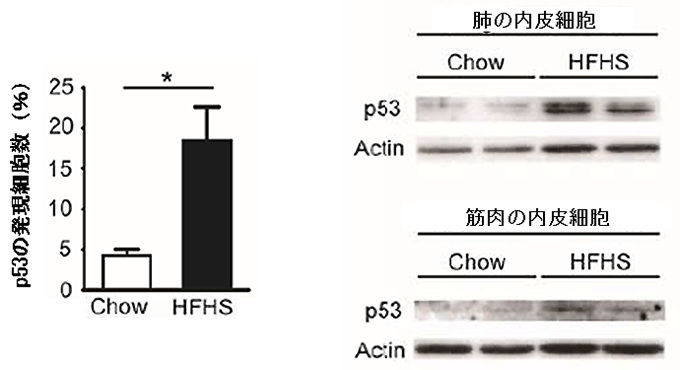
図1 高カロリー食摂取マウスの血管におけるp53発現の上昇
- 左図) 大動脈におけるp53たんぱく質発現細胞の割合は、高カロリー食(HFHS)を与えると、普通食(Chow)より顕著に上昇した。
- 右図) 肺と筋肉から取り出した内皮細胞のp53たんぱく質の発現量は、高カロリー食(HFHS)を与えたマウスで上昇した(ウエスタンブロット法)。
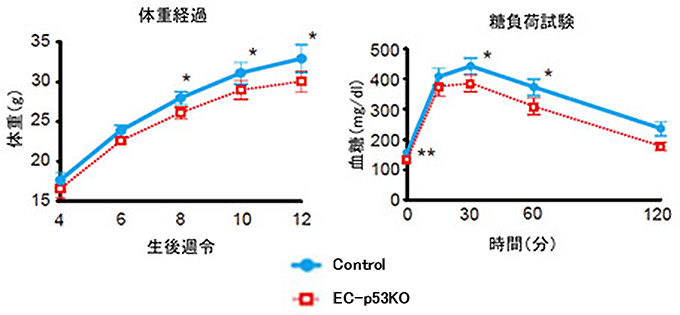
図2 血管のp53は肥満を促進し血糖消費を抑制する
- 左図) 4~12週齢まで高カロリー食を与えた野生型マウス(Control)の体重の増加(肥満進行)が、血管細胞p53欠損マウス(EC-p53KO)では抑制された。つまり、血管細胞のp53は高カロリー食投与による肥満を促進していることを示す。
- 右図) 糖尿病の進行に伴い増加する糖負荷による血糖(グルコース)上昇が、血管細胞p53欠損マウスでは軽減した(12週齢時)。つまり、血管細胞のp53は血糖消費を抑制している。
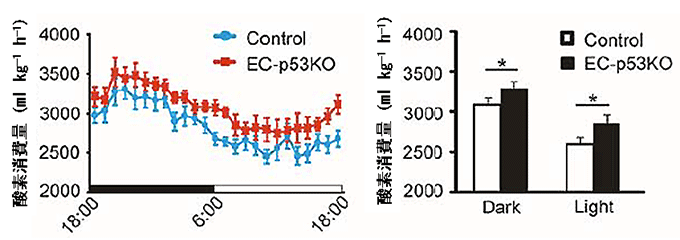
図3 血管細胞p53欠損マウスは酸素消費量が多い
- 左図) 高カロリー食摂取下で、夜18:00から1日間における経時的な酸素消費量を測定すると、血管細胞p53欠損マウス(EC-p53KO)の方が同腹の野生型マウス(Control)より常に高い酸素消費量であった。なお、マウスは夜行性である。
- 右図) 夜(Dark、18:00-6:00)と日中(Light、6:00-18:00)における酸素消費量をそれぞれ計算すると、血管細胞p53欠損マウス(EC-p53KO)の酸素消費量が有意に多かった。
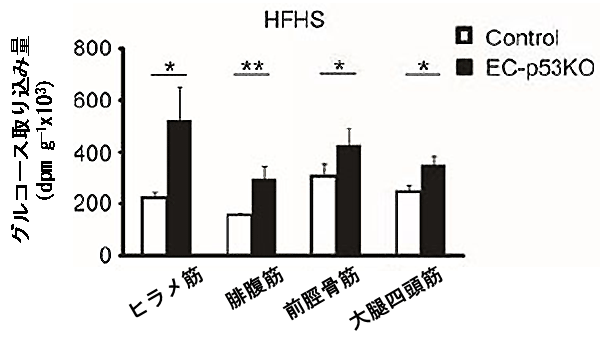
図4 血管細胞p53欠損により筋肉におけるグルコースの取り込みが増加
高カロリー食摂取していた血管細胞p53欠損マウス(EC-p53KO)では、各種の筋肉(骨格筋)におけるグルコースの取り込み量が、同腹の野生型マウス(Control)より顕著に多かった。
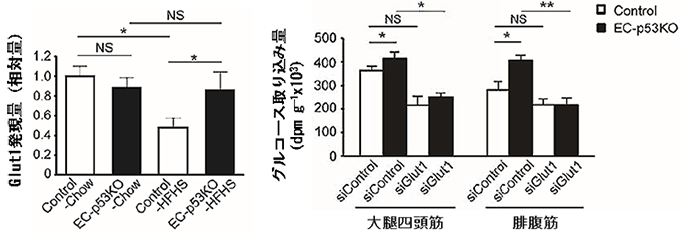
図5 血管細胞p53欠損による血管Glut1発現量の増加と、Glut1抑制による
筋肉へのグルコースの取り込み低下
- 左図) 高カロリー食(HFHS)を摂取した場合、野生型マウス(Control)では大動脈における血管Glut1発現量が減少するが、血管細胞p53欠損マウス(EC-p53KO)では減少しなかった。普通食(Chow)の摂取では野生型と差がなかった(real-time PCRでRNAの発現量を測定)。
- 右図) Glut1の発現を抑制するsiRNA(siGlut1)を投与すると、筋肉(下肢の骨格筋)へのグルコースの取り込みが低下した。siControlはGlut1の発現に無関係なコントロールのsiRNA。
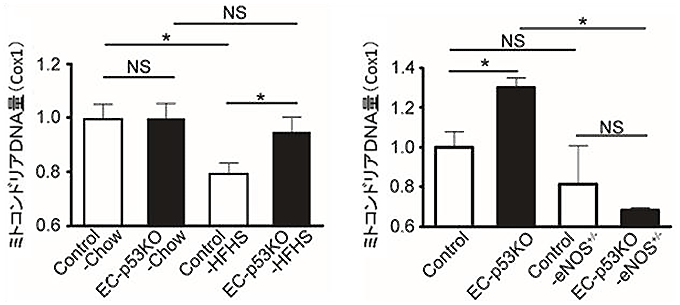
図6 高カロリー食摂取により骨格筋のミトコンドリア量は内皮p53依存的に減少し、
ミトコンドリア量の維持には血管内皮細胞で産生されるNOが必要
Cox1(ミトコンドリアゲノム中の遺伝子)の発現量を指標としてミトコンドリアDNA量を計測し、ミトコンドリア合成の変化を確かめた(なお、左図では、野生型マウス(Control)に普通食(Chow)を摂取させた方を1とし、右図では野生型マウス(Control)に高カロリー食(HFHS)を摂取させた方を1として比較した)。
- 左図) 野生型マウス(Control)の場合、高カロリー食(HFHS)摂取により、普通食(Chow)摂取と比較して骨格筋のミトコンドリア量が減少する。しかし、血管内皮細胞p53欠損マウス(EC-p53KO)は、こうした減少が阻止される。
- 右図) 血管内皮細胞特異的にp53を欠損させて同時にNO産生細胞を障害させたマウス(EC-p53KO-eNOS+/-)の場合、EC-p53KOと異なり、高カロリー食摂取による骨格筋細胞中のミトコンドリア量減少の阻止が認められなくなった。
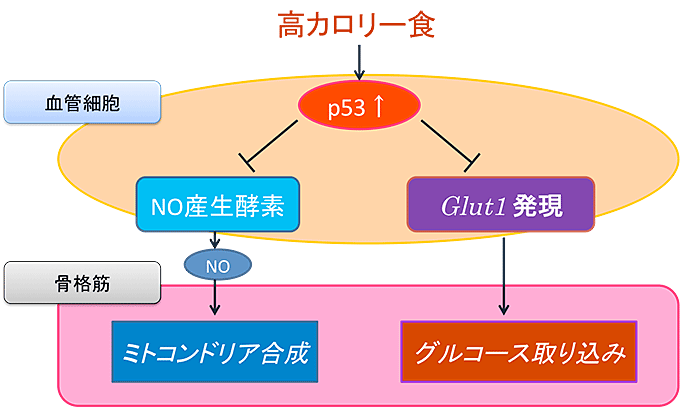
図7 血管細胞で活性化したp53が骨格筋のグルコース消費を抑える
- ① 一酸化窒素(NO)の産生を低下させることにより、筋肉細胞でのミトコンドリアの合成を阻害する。
- ② 糖輸送分子Glut1の産生を障害して筋肉細胞へのグルコース取り込みを妨げる。
- ③ 以上の結果として、エネルギー消費が低下する。
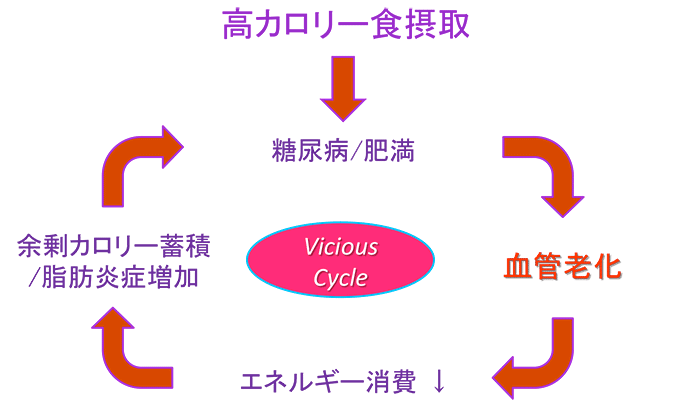
図8 糖尿病・肥満で合併する血管老化がさらに糖尿病・肥満を悪化させる悪循環
これまで、糖尿病と肥満に血管老化が合併することが知られていた。今回、血管の老化がエネルギー消費を低下させるため、余剰となったカロリーが脂肪として蓄積し脂肪炎症を促進。その結果、さらなる糖尿病と肥満の進行を誘導する悪循環(Vicious Cycle)を形成している可能性が示された。
<用語解説>
- 注1) メタボリックシンドローム
- 肥満(内臓脂肪の蓄積)に、糖代謝異常・高血圧・脂質代謝異常のいずれか2項目が当てはまる場合にメタボリックシンドロームと診断される。生活習慣に基づいて発症するこれらの異常は、心臓病や脳卒中といった重大な疾患の発症リスクを高める。メタボリックシンドロームを早期に治療することで、それらの重大な疾患の予防につながることから、最近では検診で早期に発見するよう厚生労働省なども呼びかけている。
http://www.mhlw.go.jp/bunya/kenkou/metabo02/
- 注2) ミトコンドリア
- 動物などが持つ細胞のほぼ全てに含まれる、細胞内小器官の1つ。主な機能は、糖分子や脂肪酸をもとに活動に必要なエネルギーであるATPの産生。
- 注3) 細胞老化
- 細胞が、一定の分裂回数を超えると増殖を停止し、細胞の形態や機能が障害される現象。遺伝情報が集められた染色体には、テロメアと呼ばれる保護領域が存在する。このテロメアが細胞分裂のたびに短縮していくことが細胞老化のメカニズムと考えられていたが、紫外線やがん遺伝子の活性化などテロメア短縮に依存しない染色体の障害でも細胞分裂が停止するとされる。
- 注4) p53
- 遺伝情報が保存されているDNAが傷害を受けた際に活性化されるたんぱく質。細胞内のDNAが、酸化ストレスや低酸素・テロメア短縮などの刺激により傷つくと、細胞が異常増殖を起こす場合がある。放置すると、がんとなる恐れがあることから、損傷を受けた細胞が増殖しないように作用するのがp53分子の役割。細胞の増殖を停止させる機能や細胞死を誘導する機能を発揮することから、がん抑制因子として知られる。最近では、がんを誘導する刺激のほかにもさまざまな疾患に関与することが報告されるなど、発見から30年が経過した現在でもその機能の全容は解明されていない。
- 注5) Glut1(グルコース・トランスポーター1)
- 細胞外から細胞内にグルコースを取り込むたんぱく分子。複数の種類が知られていてGlut1はその1つ。血管の内皮細胞などが持っている。骨格筋や心筋には、主にGlut4が発現している。
<論文タイトル>
“Inhibition of endothelial p53 improves metabolic abnormalities related to dietary obesity”
(血管内皮細胞p53の抑制により、食餌性肥満に関連した代謝異常が改善する)
doi: 10.1016/j.celrep.2014.04.046
<お問い合わせ先>
<研究に関すること>
南野 徹(ミナミノ トオル)
新潟大学 大学院医歯学総合研究科 循環器内科 教授
〒951-8510 新潟県新潟市中央区旭町通り一番町757番地
Tel:025-227-2182 Fax:025-227-0774
E-mail:
<JST事業に関すること>
松尾 浩司(マツオ コウジ)、川口 貴史(カワグチ タカフミ) 、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2064
E-mail:
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
新潟大学 広報室
〒950-2181 新潟県新潟市西区五十嵐2の町8050番地
Tel:025-262-7000