<ポイント>
- 安全なワクチンの開発には、自然免疫を活性化する安全なアジュバントの探索が必要。
- マウスだけでなくサルでもインフルエンザワクチンの効果増強を確認。
- インフルエンザなどの感染症やウイルス疾患の強力な予防薬への利用が期待。
JST 課題達成型基礎研究の一環として、独立行政法人 医薬基盤研究所の石井 健 プロジェクトリーダー(大阪大学 免疫学フロンティア研究センター兼任)や小檜山 康司 研究員らのグループは、北九州市立大学の櫻井 和朗 教授のグループと共同で、インフルエンザなどの感染症に対する強力なワクチンアジュバント(免疫活性化分子)注1)の開発に成功しました。
アジュバントは、ワクチンの効果を高める目的で抗原注2)とともに投与される物質または分子であり、安全で効果的なワクチン開発のために、全世界でアジュバントの開発競争が行われています。これまで、合成核酸CpGオリゴデオキシヌクレオチド(CpG ODN)注3)と呼ばれる、短い配列の特殊なDNAが強いアジュバント効果を持つことが知られていましたが、いくつかの効果の強いCpG ODNは生体内で凝集を起こし不安定であったり、霊長類では効果が少ないなど実用化に向けて課題がありました。
研究グループは今回、CpG ODNを多糖(β-1,3グルカン)で包んだ、新たなアジュバント(K3-SPG)の開発に成功しました。このナノ粒子のK3-SPGをインフルエンザワクチンと一緒に投与すると、マウスだけでなくカニクイザルでも強いアジュバント効果を発揮し、これまで懸念されていたマウスと霊長類での反応性の違いを克服できました。また、K3-SPGは接種後に速やかにリンパ節注4)へと移行し、リンパ節表面の細胞に特異的に取り込まれたあとに、強力に免疫細胞を活性化していることが明らかとなりました。
今回の成果は、新規アジュバントの開発を大きく前進させるとともに、これまで効果が乏しかった抗がん薬や抗アレルギー薬をはじめ、感染症以外のさまざまなワクチンでの利用も期待されます。
本研究成果は、2014年2月10日(米国時間)の週に米国科学誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「ナノ界面技術の基盤構築」
(研究総括:新海 征治 崇城大学 教授/九州大学 工学部 ナノサイエンス学科 名誉教授) |
| 研究課題名 |
「DDS粒子のナノ界面と鳥インフルエンザワクチン等への応用」 |
| 研究代表者 |
櫻井 和朗(北九州市立大学 国際環境工学部 教授) |
| 研究期間 |
平成20年10月~平成26年3月 |
JSTはこの領域で、異種材料・異種物質状態間の接合界面を扱う研究分野の融合によってナノ界面機能に関する横断的な知識を獲得するとともに、これを基盤として界面ナノ構造を自在に制御し、飛躍的な高機能化を可能にする革新的なナノ界面技術を創出することを目的としています。上記研究課題では、次世代のDDSナノ粒子に関して、粒子の内部構造、粒子内の疎水/親水界面における薬物の挙動と形態、生体膜との融合挙動を、放射光を用いて精密に解明し、この結果を利用して、遺伝子デリバリーやタンパク質製剤の分野に新しいDDS技術を提供することを目標としています。
<研究の背景と経緯>
ワクチンは病原体の感染や、感染による症状の重症化を防ぐために世界中で用いられています。ワクチンの中にはアジュバントと呼ばれる免疫活性化分子が含まれており、ワクチンの効果を高めるために80年以上もの長い間使用されてきています。しかし、従来のアジュバントでは防ぐことのできない感染症も存在し、より効果的な新規ワクチンの開発には新たなアジュバントの開発が重要とされています。
免疫システムには、自然免疫と獲得免疫があり、自然免疫は体内に進入した病原体に対して、迅速に対応するための防御反応で、以前にその病原体に感染したことがなくても排除できる、自然に備わっている能力です。一方、過去に1度感染したことのある病原体が再び体内に侵入してきた場合には、過去の記憶に頼る強力で効率の高い獲得免疫によって防御反応を示します。
最近の自然免疫研究の発展から、ワクチンが十分な効果を示す(獲得免疫を活性化する)ためには、自然免疫注5)の活性化が必須であることが明らかとなってきました(図1)。そのため自然免疫受容体注6)であるトル様受容体(TLR)(Toll様受容体:Toll-like receptor)注7)に結合する物質(リガンド)が、アジュバントとして期待され開発が行われています。特にTLR9のリガンドである合成核酸CpG ODNは強く自然免疫を活性化することから、アジュバントのみならず抗がん薬や抗アレルギー薬としても期待されています。これまでに大きく4種類(D型、P型、K型、C型)のCpG ODNが報告されていますが、効果の強いCpG ODNは凝集を起こすなど不安定であるために、実用化に向けての開発は困難でした。CpG ODNを幅広い免疫核酸医薬として応用するために、安定化によって効果を高くするための新たなアプローチが求められていました。
<研究の内容>
研究チームは今回、多糖(βグルカン)と合成核酸との複合体を形成させる独自技術を用いて、ヒトへの応用可能なワクチンアジュバントの開発を試みました(図2)。
研究チームはまず、核酸医薬として期待されているCpG ODN(K3)と多糖(βグルカン)との複合体(K3-SPG)を作製し、ヒト細胞で自然免疫を活性化するかどうかを調べました。その結果、これまでに報告されているCpG ODNに比べて、強く自然免疫応答を活性化していることが明らかとなりました。
次に、マウスインフルエンザワクチンモデルを用いて検討したところ、季節性インフルエンザワクチンとして用いられているスプリットワクチンにK3-SPGを添加するだけで、これまで効果が高いと考えられてきた全粒子ワクチン注8)よりもインフルエンザウイルス感染に対して強い防御効果を示しました(図3)。
ヒトへの応用を考え、霊長類であるカニクイザルで検討したところ、インフルエンザワクチンに対する免疫応答が強力に誘導されたことから、マウスと霊長類での反応性の違いを克服できたと考えられます。
さらにK3-SPGの作用機序、特に体内動態を明らかとするためにイメージング技術を用いて解析を行いました。その結果、K3-SPGはマウスに接種後、直ちにリンパ節表面の細胞(マクロファージ)に特異的に取り込まれることが明らかとなりました。その後、K3-SPGは異物の存在を教える免疫システムの司令塔である樹状細胞(抗原提示細胞)に取り込まれ、また強く活性化していることが明らかとなりました(図4)。
これらの結果から、新規免疫核酸医薬であるK3-SPGはマウスだけでなく、霊長類であるカニクイザルにおいてもアジュバントとして有用であることが示唆されるとともに、ヒト細胞を用いた結果からも、ヒトへの応用が可能であると見込まれます。
<今後の展開>
今回の成果は、ワクチンアジュバントとして新規核酸医薬の開発に成功しました。この新規アジュバントはマウスやカニクイザルだけでなく、ヒト細胞においても従来のCpG ODNより強い、自然免疫や獲得免疫の活性化を示しました。
本研究グループは、この新規アジュバントを実際にヒトへ応用するために、GMP準拠の製剤化を行うことが次の課題であると考えています。この新規アジュバントの製剤化に成功すれば、インフルエンザワクチンのアジュバントや、がんワクチンやほかの感染症のワクチンへの応用も可能であり、新規ワクチンまたは治療法の開発が期待されます。
<参考図>
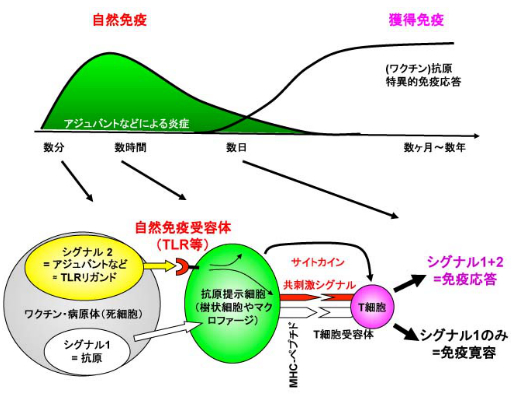
図1 獲得免疫の誘導には自然免疫活性化が必須
外来抗原のみ生体内に投与したときは、シグナル1が活性化されるが、免疫寛容となる。一方で、生体内に病原体が感染したときや、ワクチンを接種することでシグナル1と同時にアジュバントによって自然免疫応答が活性化される(シグナル2)。この2つのシグナルが抗原提示細胞に入ることで、抗原特異的な獲得免疫応答を誘導することができる。
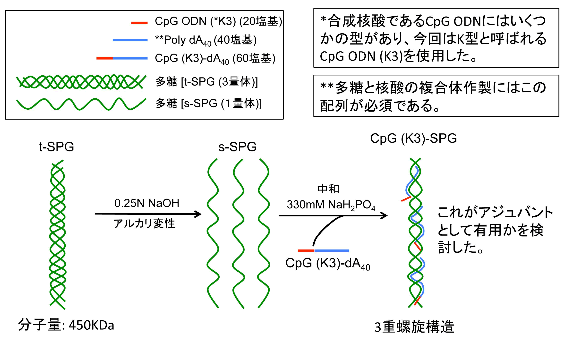
図2 核酸医薬と多糖の複合体作製技術
多糖(SPG)と核酸(CpG)が3重らせんの複合体を形成する。最適な粒子径となり、高次構造を取るために、自然免疫応答を強く活性化することが可能となる。
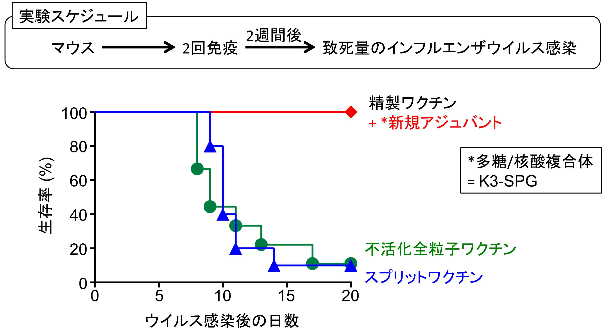
図3 インフルエンザワクチンアジュバントとしてのK3-SPG
従来の不活化全粒子ワクチン(生きたウイルスを化学的に処理し、感染性をなくしたワクチン)は、スプリットワクチン (現在予防接種で用いられている、インフルエンザウイルスの抗原たんぱく質のみを精製したワクチン)に比べて効果が高いとされているが、不活化全粒子ワクチン接種時でも致死量となるウイルス感染において、新規アジュバントをスプリットワクチンに加えることで、100%の生存率を示した。
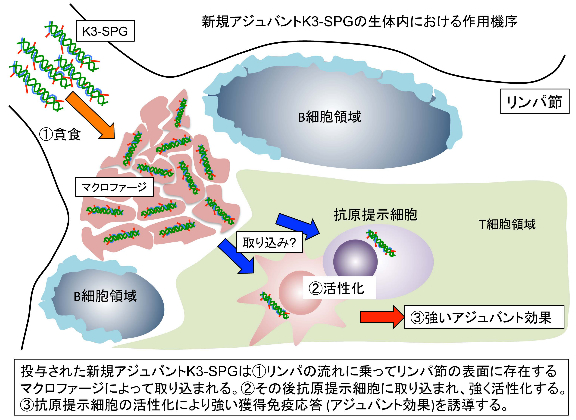
図4 新規アジュバントK3-SPGの生体内における作用機序
<用語解説>
- 注1)ワクチンアジュバント(免疫活性化分子)
- 抗原(ワクチン)の効果(免疫原性)を高める目的で抗原とともに投与される物質または因子の総称。自然免疫応答を活性化するものが多く、その中でも病原体由来のリポ多糖 (LPS)やDNAやRNAなどの核酸などが実験的によく使用されています。
- 注2)抗原
- ここでの抗原は病原体由来の生体内に非自己として認識されるたんぱく質のことである。抗原を認識し、アジュバントにより自然免疫応答を活性化することで、ワクチンの効果が発揮されます。
- 注3)CpG ODN
- 病原体にはCpGモチーフという、特殊な塩基配列が確認できます。CpG ODNはその特殊な塩基配列を持つ合成された核酸の総称。CpG ODNはTLR9注7)によって認識され、自然免疫応答を活性化することができます。また、アジュバントとしても働くことが報告されており、臨床への応用が期待されています。
- 注4)リンパ節
- T細胞や、B細胞、抗原提示細胞などから構成される免疫組織。
- 注5)自然免疫
- 病原体感染初期の感染防御を担う免疫機構。最近のToll様受容体注7)の発見、その機能解析により、自然免疫系が病原体の成分を特異的に認識すること、また感染後期の獲得免疫の誘導にも重要な役割を果たしていることがわかりました。
- 注6)自然免疫受容体
- 主に免疫細胞であるマクロファージや樹状細胞、B細胞などに発現しているたんぱく質で、病原体の特異的な成分を認識し、免疫細胞活性化を誘導します。活性化された細胞では病原体の貪食、排除が促進され、炎症性サイトカインなどを産生し、獲得免疫系への橋渡しを行っています。
- 注7)トル様受容体(TLR):Toll様受容体(Toll-like receptor)
- 自然免疫受容体の1種で、TLRと略されます。TLR1-13までが報告されており、それぞれ認識できる病原体の成分が異なっており、認識することで自然免疫系を活性化することができます。
- 注8)全粒子ワクチン
- 全粒子ワクチンは生きたインフルエンザウイルスに化学的な不活化処理を行い、感染性をなくしたワクチンです。インフルエンザウイルス由来のRNAが含まれており、このRNAが内因性のアジュバントとして働くことから、定期接種で用いられている不活化スプリットワクチンに比べ、効果が高いことがわかっています。
<論文タイトル>
“Nonagonistic Dectin-1 ligand transforms CpG into a multitask nanoparticlulate TLR9 agonist”
(非刺激性Dectin-1リガンドがCpG ODNを複数の機能を持つナノ粒子状のTLR9リガンドに変化させる)
doi: 10.1073/pnas.1319268111
<お問い合わせ先>
<研究に関すること>
石井 健 (イシイ ケン)
医薬基盤研究所 アジュバント開発プロジェクト プロジェクトリーダー
大阪大学 免疫学フロンティア研究センター ワクチン学 教授
〒567-0085 大阪府茨木市彩都あさぎ7-6-8
Tel:072-641-8043 Fax:072-641-8079
研究室ホームページ: http://www.nibio.go.jp/adjuvant/index.html
櫻井 和朗(サクライ カズオ)
北九州市立大学 国際環境工学部 教授
〒808-0135 福岡県北九州市若松区ひびきの1-1
Tel:093-695-3294 Fax:093-695-3390
研究室ホームページ: http://www.sakurai-lab.jp/
<JSTの事業に関すること>
古川 雅士(フルカワ マサシ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3531 Fax:03-3222-2066
E-mail:
<報道担当>
独立行政法人 科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432