<発表のポイント>
- 関節リウマチの炎症と骨破壊を強力に促進する新たなT細胞を同定しました。
- このT細胞が免疫を抑制する制御性T細胞から分化転換することを明らかにしました。
- 新しく発見された関節リウマチ発症の鍵をにぎるT細胞は、自己免疫疾患の新しい治療法や診断マーカーの確立に貢献すると期待されます。
<発表概要>
関節リウマチは、自己の免疫系が自分自身の細胞を攻撃することによって起きる自己免疫疾患の中でも発症頻度が高く、関節の炎症と骨の破壊が主な症状です。このような自己免疫疾患は、免疫の司令塔であるT細胞のうち、自己に対する免疫応答を抑制するT細胞と促進するT細胞のバランスが破綻すると発症すると考えられています。しかし、関節リウマチの発症原因は不明な点が多く、また自己免疫疾患を促進するT細胞の発生メカニズムもこれまでよく分かっていないため、根本的な治療法の確立が難しい状況にありました。
東京大学 大学院医学系研究科の高柳 広 教授と小松 紀子 客員研究員らの研究グループは、マウスを使った実験により自己免疫疾患の発症の鍵となるT細胞(exFoxp3Th17細胞)を新たに発見し、この細胞が免疫を抑制するT細胞からの分化転換により発生することを見いだしました。関節リウマチモデルマウスへの細胞移入実験やトランスクリプトーム解析注1)などの手法により、今回発見した新たなT細胞はこれまで知られていたT細胞よりも関節の炎症や骨破壊を強力に引き起こすとともに、他に類を見ない遺伝子群を発現することを明らかにしました。
本研究により新たに発見されたT細胞は、関節リウマチだけでなく多発性硬化症や全身性エリテマトーデスなどのさまざまな自己免疫疾患の治療標的となる可能性を持っており、新しい治療薬や診断マーカーの確立に繋がることが期待されます。
本研究は独立行政法人 科学技術振興機構(JST)課題達成型基礎研究「高柳オステオネットワークプロジェクト」との共同研究として行われ、2013年12月22日(米国東部時間)発行の米国科学誌Nature Medicineにオンライン掲載されます。
<発表内容>
①研究の背景
関節リウマチ(RA)は、関節の炎症と骨破壊を主症状とし、日本では推定70-80万人が発症している最も頻度の高い自己免疫疾患の一つです。疾患の進行は生活の質の低下や死亡率の上昇に繋がることから、RA治療法の確立は社会福祉向上のためにも喫緊の課題です。RAの発症に重要なサイトカイン注2)である腫瘍壊死因子TNF-αやインターロイキン(IL)-6を阻害する抗体製剤はRAの治療薬として世界で広く使用されていますが、大変高価であるとともに効果が現れない症例も存在します。RAの発症メカニズムは不明な点が多く、このため根本的な治療法もいまだ確立されていません。
T細胞は抗原を認識する能力や免疫反応の司令塔としての機能を持つ細胞であり、免疫応答を抑制する制御性T細胞注3)と促進するヘルパーT細胞注4)が存在します。病原体を排除するための適切な免疫応答の促進や、排除されたあとの不要な免疫応答の抑制は、健康を維持するために重要です。健康な状態では制御性T細胞とヘルパーT細胞の働きの均衡がとれていますが、このバランスが破綻するとアレルギーや自己免疫疾患が発症すると考えられています。RAにおいても、遺伝子解析や臨床所見などからT細胞の重要性は明らかにされており、制御性T細胞とヘルパーT細胞のバランスの制御が重要であると考えられています。
近年マウスを用いた実験により、サイトカインIL-17を産生するTh17細胞注5)と呼ばれるヘルパーT細胞が関節炎を含めた自己免疫疾患を引き起こすことが知られており、Th17細胞を標的とした治療法の開発が期待されています。しかしながら、RAが発症する過程におけるTh17細胞の分化のメカニズムはよく分かっていませんでした。一方で、制御性T細胞は転写因子Foxp3注6)を発現することで免疫抑制機能を発揮することが知られています。また、自己反応性の高い細胞としても知られており、そのような細胞が免疫抑制機能を持つことは、自分自身の細胞を攻撃しないという自己寛容を維持するための合理的なシステムであると考えられます。もし自己反応性の高いT細胞が免疫抑制機能を担う因子Foxp3の発現を消失したら、自己免疫疾患を引き起こす細胞へ転換してしまう可能性が考えられますが、この可能性はこれまで証明されていませんでした。
②研究内容
東京大学 大学院医学系研究科の高柳 広 教授、小松 紀子 客員研究員らの研究グループは、自己免疫疾患を促進するTh17細胞は制御性T細胞が免疫抑制機能を担う因子Foxp3の発現を消失することで生じるという仮説を立て、RAのモデルであるコラーゲン誘導性関節炎を発症させたマウスを使ってこの検証に取り組みました。
まず、Foxp3を発現するT細胞のうち、細胞表面分子CD25注7)の発現の低い細胞をマウスへ移入すると、関節炎の炎症環境下でFoxp3の発現を消失しTh17細胞(exFoxp3Th17細胞)に分化転換することを見いだしました。次に、Foxp3発現T細胞の運命を追跡できるようなマウスを作製し、このマウスに関節炎を発症させたところ、Foxp3を発現したT細胞から分化転換したexFoxp3Th17細胞が炎症関節に多く集積することが分かりました。さらに、DNAメチル化解析注8)や発現マーカーの解析により、関節炎環境下でFoxp3の発現を失ったT細胞は、もともと制御性T細胞としての性質を持っていたことが示されました。これらの実験結果はRAのような炎症環境下では、免疫を抑制するT細胞がFoxp3の発現を消失し、免疫を促進するT細胞へ転換することを意味します。また、制御性T細胞からexFoxp3Th17細胞への分化転換は、腫れた関節の炎症滑膜で増殖する滑膜線維芽細胞がサイトカインIL-6を産生することで引き起こされることが分かりました。
これまでTh17細胞の起源はナイーブT細胞注9)であると考えられており、ナイーブT細胞から分化したTh17細胞はRAの骨破壊を担う破骨細胞の分化を誘導することが分かっています。今回新しく同定した、免疫を抑制するT細胞を起源とするTh17細胞(exFoxp3Th17細胞)は、これまで知られていたTh17細胞よりも強力に破骨細胞を誘導することが分かりました。また、トランスクリプトーム解析の結果、exFoxp3Th17細胞はこれまで知られていたTh17細胞とは異なる遺伝子の発現パターンを持ち、関節炎の発症に関わる遺伝子群を高く発現していることから、新規の関節炎誘導性のTh17細胞であることが示唆されました。さらに、自己抗原であるコラーゲンに反応する細胞を含むFoxp3発現T細胞のうち、CD25の発現が低い細胞をマウスに移入した上で関節炎を誘導すると、Foxp3の発現の消失に伴い関節の炎症と骨破壊が増悪化することが見いだされ、exFoxp3Th17細胞の生体レベルでの関節炎誘導能が証明されました。以上はマウスを用いた実験結果ですが、症状が進行したRA患者の関節ではFoxp3とIL-17の両方を発現するT細胞が多く存在することから、RA患者においても制御性T細胞がexFoxp3Th17細胞へ転換する可能性が示されました。
以上の研究により、関節の炎症と骨破壊を強力に誘導するTh17細胞(exFoxp3Th17細胞)が新しく同定され、この細胞が免疫を抑制する細胞から分化転換することやユニークな遺伝子発現パターンを持つことが明らかになりました。
③社会的意義と今後の展望
本研究は、健康状態では自己寛容を維持するT細胞が、炎症環境下において自己免疫疾患を引き起こすT細胞へと分化転換する可能性を示すものであり、自己免疫疾患の新しい発症機構を提唱するものです。本研究グループが新たに発見した関節炎の炎症と骨破壊を引き起こす病原性Th17細胞(exFoxp3Th17細胞)は、RAだけでなく多発性硬化症や全身性エリテマトーデスなどさまざまな自己免疫疾患の治療標的となる可能性を持っています。また、exFoxp3Th17細胞は、とてもユニークな転写因子群や細胞表面分子群を発現しており、新しい分子標的治療に繋がる可能性があります。このためTh17細胞の病原性を司る分子基盤の解明は、RAをはじめとする自己免疫疾患の新しい治療薬や診断マーカーの確立に貢献するものと期待されます。
<参考図>
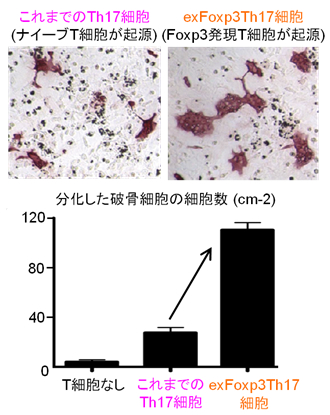
図1 新しい病原性Th17細胞による破骨細胞の分化誘導
(上:赤く染色された破骨細胞の像、下:破骨細胞の数)
新たに同定したTh17細胞(exFoxp3Th17細胞)はこれまで知られていたTh17細胞より3倍ほど強力に破骨細胞の分化を誘導することが示されました。
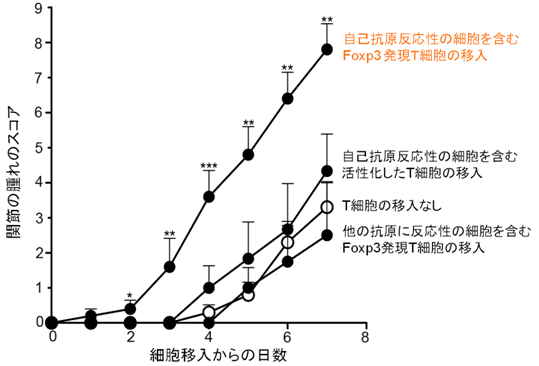
図2 自己抗原反応性のFoxp3発現T細胞の移入によるマウスの関節炎の増悪化
自己抗原であるコラーゲンに反応性を示す細胞を含むFoxp3発現T細胞のうち、CD25の発現の低い細胞をマウスに移入した上で関節炎を誘導すると、exFoxp3Th17細胞の発生に伴い関節炎の増悪化が認められました。
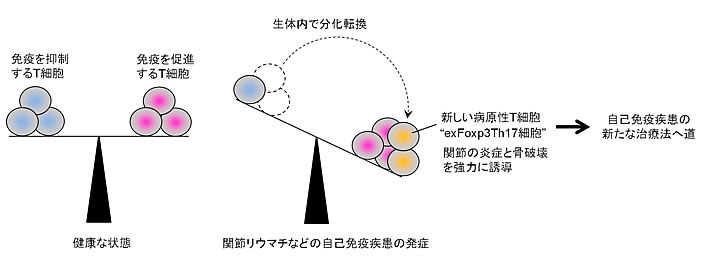
図3 本研究の研究成果の概要
健康な状態では免疫を抑制するT細胞と促進するT細胞の働きの均等がとれていますが、このバランスが破綻すると自己免疫疾患が発症すると考えられています。本研究により、新しい病原性T細胞(exFoxp3Th17細胞)を発見され、この細胞が免疫を抑制するT細胞からの分化転換により発生することが見いだされました。exFoxp3Th17細胞はこれまで知られていたT細胞より関節の腫れや骨破壊を強力に誘導することが明らかとなりました。この細胞は自己免疫疾患の治療標的となる可能性を持っており、新しい治療薬や診断マーカーの確立に繋がることが期待されています。
<用語解説>
- 注1) トランスクリプトーム解析
- 細胞内の遺伝子転写産物の発現を体系的かつ網羅的に調べる解析方法。
- 注2) サイトカイン
- 細胞から放出されるたんぱく質のうち、細胞間の情報伝達に関わるものの総称。
- 注3) 制御性T細胞
- 免疫応答を抑制するT細胞。Foxp3という転写因子を発現する。T細胞は異物や自己を抗原として認識する能力を持っている。異物に対する適切な免疫応答の促進は体内からの異物の除去に必要であり、異物がなくなったあとの不要な免疫応答の抑制も健康を維持するうえで大切である。免疫応答の促進と抑制のバランスがうまくコントロールされないとアレルギーや自己免疫疾患が引き起こされてしまうと考えられている。制御性T細胞は免疫応答を促進するT細胞の働きを抑制することにより、過剰な免疫応答や自己免疫疾患の発症を抑制するのに重要な役割を果たす。
- 注4) ヘルパーT細胞
- 免疫応答を促進するT細胞。抗原刺激を受けたことのない未分化な状態のT細胞(ナイーブT細胞)が、抗原とサイトカインの刺激を受けることで分化した細胞。さまざまな種類のヘルパーT細胞が存在する。
- 注5) Th17細胞
- 局所炎症を促進するサイトカインであるインターロイキン(IL)-17を産生するヘルパーT(Th)細胞。自己免疫疾患を引き起こす細胞と考えられている。これまで知られていたTh17細胞はナイーブT細胞から分化するものであった。
- 注6) Foxp3
- 制御性T細胞の分化や免疫抑制機能の発揮に必須のたんぱく質。Foxp3を発現できないヒトやマウスでは致死性の自己免疫疾患を発症することから、制御性T細胞がFoxp3を発現することは、自己免疫疾患の発症の抑制に重要であることが知られている。
- 注7) CD25
- 細胞表面に発現するたんぱく質。制御性T細胞を増やしたり、維持したりするのに必要なサイトカインIL-2の受容体を構成する要素の一つである。
- 注8) DNAメチル化解析
- 遺伝子発現を制御するDNA領域のうちCpG領域と呼ばれる特徴的なDNA領域のメチル化の頻度を明らかにする解析法。メチル化の頻度が高くなると遺伝子発現の不活性化が起こることから、遺伝子の発現のされやすさが推測できる。
- 注9) ナイーブT細胞
- 抗原刺激を受けたことのない未分化な状態にあるT細胞。免疫を促進する機能も抑制する機能も持たない。
<発表雑誌>
雑誌名:「Nature Medicine」
論文タイトル:Pathogenic conversion of Foxp3+T cells into TH17 cells in autoimmune arthritis
著者:Noriko Komatsu, Kazuo Okamoto, Shinichiro Sawa, Tomoki Nakashima, Masatsugu Oh-hora, Tatsuhiko Kodama, Sakae Tanaka, Jeffrey A. Bluestone & Hiroshi Takayanagi
<お問い合わせ先>
<本研究に関するお問い合わせ>
高柳 広(たかやなぎ ひろし)
東京大学 大学院医学系研究科 病因・病理学専攻 免疫学講座 免疫学教室 教授
Tel:03-5841-3373 Fax:03-5841-3450
E-mail:
ホームページURL:http://www.osteoimmunology.com
<JSTの事業に関するお問い合わせ>
坂本 祥純(さかもと よしずみ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: