ポイント
- アルツハイマー病の発症に関与するとされるアミロイドβペプチド(Aβ)を標的とした新たな治療戦略が求められている。
- ビタミンB2を含む光触媒を利用した酸化反応によってAβの凝集性と神経毒性を抑えることに成功。
- アルツハイマー病を始めとする難治性疾患の克服に貢献するものと期待される。
JST 課題達成型基礎研究の一環として、東京大学 大学院薬学系研究科 金井 求 教授、相馬 洋平 特任研究員(グループリーダー)、谷口 敦彦 特任研究員らの研究グループは、アルツハイマー病の発症に関与するとされるアミロイドβペプチド(Aβ)のみを選択的に酸化注1)する光触媒注2)(ビタミンB2とペプチドの複合体)を開発し、Aβの凝集注3)性および神経毒性を抑えることに成功しました。
アルツハイマー病の発症には、Aβの凝集体による神経毒性が関与していると考えられています。そのため、Aβを標的とした治療法の開発が盛んに進められてきました。しかし、アルツハイマー病はいまだ根治に至っておらず、病気の克服には新しい治療法の開発が望まれています。
本研究グループは、Aβそのものを変化させることで神経毒性が抑えられるのではないかと考え、光に反応するビタミンB2とペプチドを結合させた新たな光触媒を開発しました。この光触媒によってAβを選択的に酸化することに成功し、酸化されたAβは顕著に低い凝集性および神経毒性を示すことが明らかになりました。
今後、生体応用に向けて本成果で得られた触媒をさらに改良できれば、Aβを標的とするアルツハイマー病の新たな治療戦略につながることが期待されます。また、本研究のように、生体において人工的に触媒反応を起こすことで病気の治療につなげるというアプローチは、ほかの難治性疾患の治療にも適用できるものと期待されます。
本研究は、東京大学 大学院医学系研究科の岩坪 威 教授、同薬学系研究科の富田 泰輔 准教授のグループとの共同で行ったもので、研究成果はドイツ科学誌「Angewandte Chemie International Edition」のオンライン速報版で近日中に公開されます。
本成果は、以下の事業・プロジェクトによって得られました。
戦略的創造研究推進事業
| 研究プロジェクト |
「金井触媒分子生命プロジェクト」 |
| 研究総括 |
金井 求(東京大学 大学院薬学系研究科 教授) |
| 研究期間 |
平成23年8月~平成29年3月 |
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
<研究の背景と経緯>
アルツハイマー病は認知障害を主な症状とする難治性疾患です。高齢化社会を抱える日本における患者数は、発症前の予備軍も含めると800万人を超え、この疾患の克服は世界的にも極めて重要な課題となっています。これまでの研究から、アルツハイマー病患者の脳には、老人斑と呼ばれるたんぱく質の沈着が認められ、この主成分は40個程度のアミノ酸から成るアミロイドβペプチド(Aβ)であることが知られています。この老人斑が形成される過程で生じるAβの凝集体が神経細胞を傷付ける(神経毒性を示す)ことで、アルツハイマー病が発症・進行すると考えられているため、Aβの凝集を阻害する薬剤の開発が進められています。しかし、現在のところ研究開発は一進一退で、有望な治療薬は見つかっていません。そのような中で、本研究グループでは、化学的にAβそのものを変化させることによってAβを無毒化できれば、有望なアルツハイマー病の治療戦略になり得るのではないかと考え、研究を進めてきました。
<研究の内容>
本研究グループは、Aβそのものを変化させる反応の1つとしてAβの酸化に着目し、酸化を引き起こす化合物を検索しました。その結果、生体内の酸化還元反応に関与しているビタミンB2(リボフラビン)とAβの混合液に可視光注4)を照射することで、生体内に近い環境(酸素下、中性な液体下、かつ37度)において、Aβが酸化されることが分かりました(図1)。この酸化反応は、光によってビタミンB2の電子が励起し、溶液中の酸素がAβのアミノ酸に結合することで起こっていると考えられます。そのため、ビタミンB2は光を照射することで酸化反応を起こす、光触媒と言えます。
しかし、ビタミンB2は光を照射するとさまざまな生体分子を酸化してしまうため、治療戦略としての展開を見据えると、生体内のほかのたんぱく質などに作用することなく、選択的にAβの酸化を行う触媒が必要です。その実現のために、本研究グループではAβを選択的に認識できる「タグ」機能を持つペプチドとビタミンB2の複合体(光触媒)の開発に成功しました。この光触媒は、Aβを認識する部位と酸化を起こす部位で構成されており、触媒をAβに近づけることでAβを選択的に酸化できます。
また、この光触媒を用いて酸化されたAβは、Aβの凝集体の一種である線維が観測されませんでした(図2)。Aβそのものが酸化することで、Aβの凝集が阻害されていると考えられます。さらに、神経細胞存在下でAβ選択的な酸化反応が進行し(図3)、細胞毒性が軽減することも明らかとなりました。以上より、この光触媒は化学的にAβを酸化させることで、Aβの凝集を阻害し、かつ毒性を抑えることが示されました(図1)。
<今後の展開>
今後、より現実的な治療法へと展開するために、実際の動物生体内でAβの凝集を阻害できるかを明らかにすることを目指します。具体的には、可視光の中でもよりエネルギーの小さい光(長波長の光)で酸化を起こす光触媒の開発などを進めていきます。
また今回の研究成果のように、触媒反応によって生体内の分子の性質を変えることで、疾患原因分子の病態機能を変えることができれば、新たな疾患の治療法にもつながると期待されます。
<参考図>
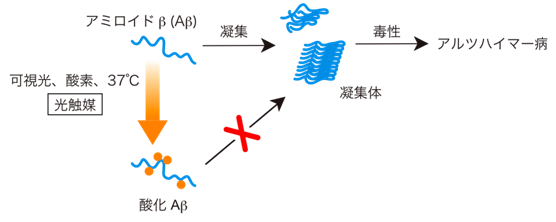
図1 Aβの光触媒反応の概念図
Aβ(青色)が光触媒によって酸化されると凝集が阻害される。円形のオレンジは酸素を示しており、Aβに酸素が結合して酸化Aβになる。

図2 酸化されていないAβ(左)と酸化されたAβ(右)の原子間力顕微鏡の画像
酸化されていない場合はAβの凝集体が線維のように観測されるが、Aβが酸化されると線維は観測されないことから、酸化されたAβは凝集しないと考えられる。
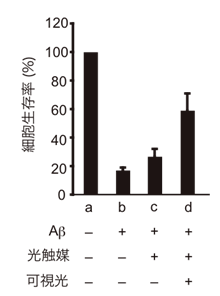
図3 光触媒によるAβの毒性軽減ル
酸化されていないAβを神経細胞と混ぜると、Aβの毒性により細胞生存率は下がる(aとbを比較)が、光触媒に可視光を照射することでAβが酸化されるとAβの毒性が下がり細胞生存率が上がる(bとcとdを比較)。
<用語解説>
- 注1)酸化
- 物質が酸素と結合する化学反応の一種。金属のさびは、金属に酸素が結合する酸化反応によって起こる。
- 注2)光触媒
- 光を照射することによって特定の反応を進行させやすくする分子。
- 注3)凝集
- 分子が集合して1つに固まること。
- 注4)可視光
- ヒトの目で見える波長の光。
<論文タイトル>
“Attenuation of the Aggregation and Neurotoxicity of Amyloid-β Peptide by Catalytic Photooxygenation”
(光酸化触媒によってアルツハイマー病に関与するアミロイドβペプチドの凝集性および神経毒性を抑制)
doi: 10.1002/anie.201308001
<お問い合わせ先>
<研究に関すること>
金井 求(カナイ モトム)
東京大学 大学院薬学系研究科 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-4830 Fax:03-5684-5206
E-mail:
<JSTの事業に関すること>
坂本 祥純(サカモト ヨシズミ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: