ポイント
- 根本的治療法のない肺線維症(特発性肺線維症:国内1万人以上)の病態形成には、悪玉細胞である線維芽細胞の活性化と細胞移動が重要
- 活性化線維芽細胞では、細胞外マトリックスたんぱく質の一種であるオステオポンチンなどの発現が上昇
- 線維芽細胞の活性化と移動の分子制御解明から肺線維症の新規治療に期待
JST 課題達成型基礎研究の一環として、東京大学 医学系研究科の津久井 達哉 日本学術振興会 特別研究員、上羽 悟史 講師、松島 綱治 教授らの研究グループは、肺線維症をもたらす活性化線維芽細胞が病変部位に集積するメカニズムの一端を明らかにしました。
肺線維症は、ガス交換を行う上皮組織が慢性炎症により、I型コラーゲンなどに置き換わり硬くなることで呼吸困難をきたす致死的疾患です。詳しいメカニズムはいまだに解明されておらず、多くの場合で薬剤による治療が困難であり、発症機序に基づく新たな診断マーカーおよび治療法の開発が望まれています。
線維化をもたらす原因として、活性化した線維芽細胞が線維化部位に集積し、I型コラーゲンを大量に産生することが明らかになっています。本研究グループは、I型コラーゲンを大量に産生する線維芽細胞の量的・質的変動の解明が肺線維症の予防・治療法の確立に不可欠と考え、マウス肺線維症モデルを解析しました。その結果、線維化の病態形成過程では活性化した線維芽細胞は、増殖と細胞死の動的平衡状態にあり、従来の考えとは異なり数的には増加せず、移動により線維化部位へ集積することが分かりました。さらに、活性化線維芽細胞ではオステオポンチンをはじめとする細胞外高分子や、細胞周期、細胞移動に関わる分子の遺伝子発現が高まっていることも分かりました。
線維芽細胞の活性化と、動的平衡状態、細胞移動に関わる分子制御を明らかにすることで、肺線維症の新たな診断・予防・治療法の開発につながることが期待されます。
本研究は、東海大学の稲垣 豊 教授、京都大学の戸村 道夫 准教授、金沢大学の橋本 真一 特任教授らの協力を得て行いました。
本研究成果は、2013年7月22日(米国東部時間)に米国科学誌「The American Journal of Pathology」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
| 研究領域 |
「炎症の慢性化機構の解明と制御に向けた基盤技術の創出」
(研究総括:宮坂 昌之 大阪大学 未来戦略機構 特任教授)
|
| 研究課題名 |
「慢性炎症に伴う臓器線維化の分子・細胞基盤」 |
| 研究代表者 |
松島 綱治(東京大学 大学院医学系研究科 教授) |
| 研究期間 |
平成23年4月~平成28年3月 |
JSTはこの領域で、炎症が慢性化する機構を明らかにし、慢性炎症を早期に検出し、制御し、消退させ、修復する基盤技術の創出を目指しています。上記研究課題では、慢性炎症に伴う臓器の線維化の仕組みを解明し、ヒト線維化疾患の予防・治療への応用を目指します。
<研究の背景と経緯>
臓器線維化注1)は、慢性炎症に伴って臓器の機能を担う上皮組織がI型コラーゲンなどの細胞外マトリックス注2)に置き換わる症状です。臓器線維化が進行すると最終的に臓器不全に至ります。代表的な線維化疾患として、肝硬変や糖尿病性腎症などがあり、臓器不全が死に直結する肺の線維化疾患では、国内で1万人以上の患者がいる特発性肺線維症が挙げられます。これらの線維化疾患に対しては臓器移植を除いて有効な治療法がなく、治療薬の開発に向けた線維化のメカニズム解明が急がれています。
線維化をもたらす原因として、活性化した線維芽細胞が線維化部位に集積し、I型コラーゲンを大量に産生することが明らかになっています。特に、α-SMA(α-smooth muscle actin)と呼ばれる平滑筋細胞に多く存在するたんぱく質を発現する線維芽細胞(筋線維芽細胞)が、細胞外マトリックスたんぱく質を高発現することが知られていました。しかし、筋線維芽細胞の起源となる細胞に関してはさまざまな議論があり、その分化経路や供給・維持機構は不明なままでした。技術的にも、線維芽細胞には特異的な表面マーカー分子が見つかっておらず同定が困難であり、また従来の線維化研究で主な研究手法であった病理組織解析では、細胞機能や遺伝子発現の変化を評価できなかったため、線維化の過程で活性化した線維芽細胞がどのように線維化部位へ集積するのか、その詳細は不明でした。
<研究の内容>
本研究グループは、稲垣 豊 教授(東海大学)、戸村 道夫 准教授(京都大学)、橋本 真一 特任教授(金沢大学)らとの共同研究で、ブレオマイシン注3)誘導性マウス肺線維症モデルにおける線維芽細胞の量的・質的変化を世界で初めて定量的に解析することに成功しました。
線維芽細胞数の経時的な変動を解析したところ、これまで線維化部位で増加すると考えられてきた線維芽細胞の肺全体における数は、実際には増加しないことが明らかになりました。また、線維芽細胞の一部はα-SMAを発現し、筋線維芽細胞に分化していました。線維化に伴う線維芽細胞の増殖と細胞死の関係を調べたところ、炎症のピーク時には細胞増殖と細胞死はどちらも高まりますが、線維化部位で集積している線維芽細胞で細胞増殖により増えた細胞はごく一部であり、線維芽細胞の集積に細胞移動が大きく関与している可能性が初めて示されました(図1)。
また、高度に純化した線維芽細胞について、次世代DNAシークエンサーを用いた包括的遺伝子発現解析を行い、線維化の進行に伴い肺線維芽細胞で発現変動する全ての遺伝子を世界で初めて明らかにしました。その結果、細胞外マトリックスや細胞周期、細胞移動に関わる分子の遺伝子発現が高くなっており、特に細胞外マトリックスたんぱく質の一種であるオステオポンチン(Osteopontin)が強く誘導され、新たな活性化線維芽細胞マーカーならびに病勢マーカーになる可能性を見いだしました(図2)。
以上の結果から、肺の線維化が進行する部位ではオステオポンチンを発現する繊維芽細胞が多く存在し、線維化領域の中央部ではα-SMAを発現する筋繊維芽細胞に分化することが明らかになりました。また、オステオポンチンが繊維芽細胞の線維化領域への移動を促進している可能性が示唆されました(図3)。
<今後の展開>
今回明らかになった線維芽細胞特異的な遺伝子発現と線維芽細胞集積のメカニズムに基づき、線維化の進行と不可逆性のメカニズムが細胞、分子レベルで明らかにされることで、肺線維症の新たな診断・予防・治療法の開発につながることが期待されます。
<参考図>
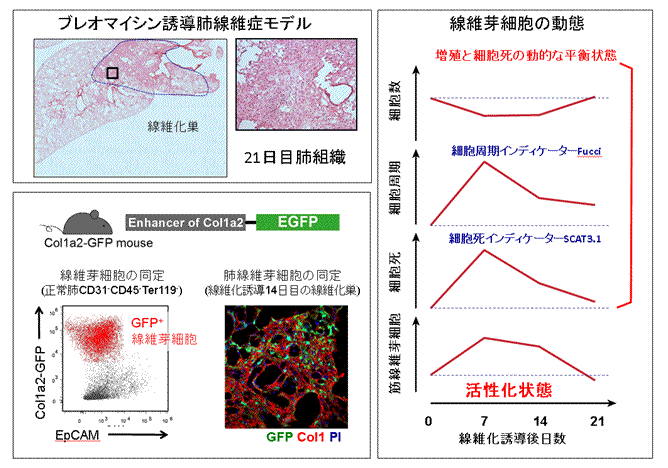
図1 定量的な線維芽細胞の動態解析
(左上)ブレオマイシン投与後21日目の肺のヘマトキシリン・エオシン染色。ブレオマイシンをマウスの気道内に投与すると投与後7日から28日にかけて肺線維症を引き起こす。
(左下)本研究で用いられたI型コラーゲン(Col1a2)のレポーターマウス。Col1a2 遺伝子の線維芽細胞特異的に働くエンハンサー領域制御下にGFPが発現する遺伝子改変マウスを用いることで、線維芽細胞を標識できる。このマウスの肺の細胞を分散した溶液をフローサイトメトリーにかけるとGFP陽性の線維芽細胞が同定できる(左パネル)。また、組織を観察するとI型コラーゲンが蓄積している線維化領域で、GFP陽性の線維芽細胞がクラスターを形成している様子が分かる(右画像)。
(右)このレポーターマウスや、細胞周期インディケーターFucciマウスと細胞死インディケーターSCAT3.1マウスを組み合わせることで、線維芽細胞の細胞周期(増殖)や細胞死を調べることができる。ブレオマイシン投与後7日をピークに細胞周期と細胞死が高まったが、線維芽細胞全体の細胞数は投与後21日まで大きな変化がなかった。

図2 次世代DNAシークエンサーを用いた分子機序の解明と線維化マーカーの探索
(上)セルソーターを用いて通常肺と線維化肺から線維芽細胞を単離し、mRNAを抽出した後に次世代シークエンサーを用いて遺伝子発現解析を行った。左の表は発現上昇した上位の遺伝子。右の表は発現上昇した遺伝子の機能を調べ、どのような役割を持った遺伝子が多いか解析したもの。線維症において臓器に蓄積する細胞外マトリックス関連の遺伝子が数多く上昇している。
(下)発現上昇していた遺伝子の中でも、オステオポンチン(OPN,Spp1 という遺伝子によってコードされる)という分子が最も劇的に上昇していた。オステオポンチンは線維化誘導後、肺胞洗浄液中にも見られる(左)。線維芽細胞におけるオステオポンチンの発現を調べたところ、活性化した大きな線維芽細胞で主に発現されていることが分かった(右)。
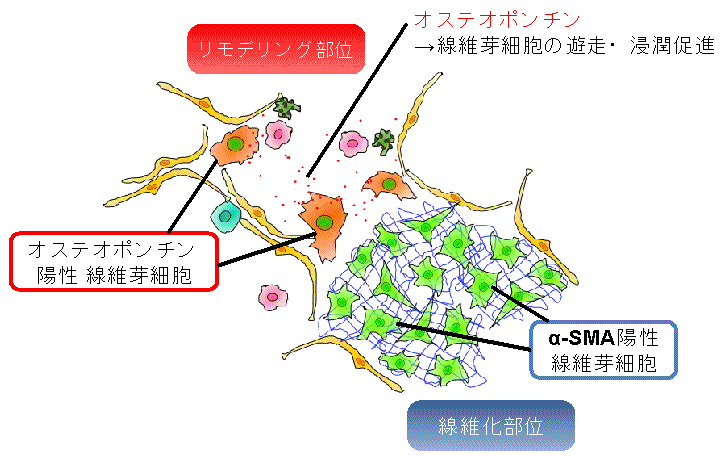
図3 オステオポンチン陽性活性化線維芽細胞は線維化の最前線に集積する
蛍光免疫染色でオステオポンチンを発現している線維芽細胞の肺における局在を調べたところ、線維芽細胞がクラスターを形成している線維化領域の最前線(リモデリング部位)に存在していることが明らかとなった。またα-SMAを発現している筋線維芽細胞は線維化領域の中央部に多く存在していた。このことはオステオポンチン陽性線維芽細胞が線維化領域の拡大に積極的な役割を果たしている可能性を示している。
<用語解説>
- 注1)臓器線維化
- 慢性的な炎症状態にある臓器で、I型コラーゲンなどの膠原線維が不可逆的に沈着し、再生が不可能になる疾患。国内において肝臓が線維化する肝硬変の患者は約40万人、糖尿病性腎症により透析を受けている患者は約10万人に及ぶ。
- 注2) 細胞外マトリックス
- 組織の細胞外領域に存在し、組織の構造を保ったり、細胞の足場を提供する役割を果たす分子群。結合組織を構成する主な分子でもある。細胞外マトリックスを構成する主な分子としてはコラーゲンやヘパラン硫酸、ヒアルロン酸などがある。
- 注3) ブレオマイシン
- 抗がん剤として臨床で用いられている薬。臨床においてもその副作用として肺の線維化が問題になっている。マウスの気道内にブレオマイシンを投与すると、劇的な上皮障害をもたらし肺線維症を引き起こす。この実験モデルは特発性肺線維症のモデルとしてよく用いられている。
<論文タイトル>
“Qualitative rather than quantitative changes are hallmarks of fibroblasts in bleomycin-induced pulmonary fibrosis”
(ブレオマイシン誘導性肺線維症における線維芽細胞の特徴は量的よりむしろ質的な変化である)
doi: 10.1016/j.ajpath.2013.06.005
<お問い合わせ先>
<研究に関すること>
松島 綱治(マツシマ コウジ)
東京大学 大学院医学系研究科 分子予防医学教室 教授
〒113-0033 東京都文京区本郷7-3-1
Tel:03-5841-3431 Fax:03-5684-2297
E-mail:koujim@m.u-tokyo.ac.jp
<JSTの事業に関すること>
川口 貴史(カワグチ タカフミ)
科学技術振興機構 戦略研究推進部
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail: