ポイント
- 初期化注1)における遺伝子の働きを評価するiPS干渉法を開発した
- iPS細胞への初期化を阻害する因子が分化誘導に重要な因子であることを明らかにした
- 分化細胞が初期化されるメカニズムの一端を解明した
引地 貴亮 研究員(京都大学 CiRA)、升井 伸治 講師(京都大学 CiRA/JST さきがけ注2)らの研究グループは、iPS細胞への初期化を阻害する(干渉する)因子が分化誘導を促進することを明らかにするとともに、分化細胞が初期化されるメカニズムの一端を解明しました。
転写因子注3)は細胞の中で遺伝子の働きを調整することで、細胞の分化を促したり、反対に分化した細胞の初期化を促したり、また分化した細胞を直接他の細胞へと変化させることもできます。しかし、各細胞内では様々な転写因子が働いており、どのようにしてその細胞の機能が発揮されているのか、分化した状態が維持されているのか、解明することは非常に困難でした。
升井講師は、「細胞を特徴づける決定的な因子(コア因子)が存在し、分化の方向性を決めると共に細胞の初期化を阻害する」という仮説を立て、分化した細胞をiPS細胞へと初期化する効率を指標にコア因子を同定するiPS干渉法を開発しました。
本研究では、神経細胞に特徴的な転写因子をリストアップし、それらを過剰発現させました。その中から特にiPS細胞へと初期化する効率が悪くなる(iPS細胞化を干渉する)因子をコア因子として同定しました。これらの因子を肝臓細胞などに導入したところ、神経細胞へと誘導することができました。また、同様に肝臓の細胞で初期化を阻害するコア因子を同定したところ、それらは既に肝臓細胞へと誘導することが知られている転写因子でした。これらの結果から、升井講師らの立てた仮説が正しいことが示され、iPS干渉法によって同定されたコア因子によって細胞種を直接変換できることが明らかとなりました。
今回確立したiPS干渉法を用いることで、様々な分化細胞を特徴づける因子を明らかにすることができ、それぞれの細胞についての理解が深まると共に、分化誘導方法の開発が進むことが期待されます。この研究成果は2013年4月1日の週(米国東部時間)に米国科学誌「Proceedings of the National Academy of Sciences」のオンライン版に掲載されます。
<研究の背景>
細胞の性質はその中で働く遺伝子の組み合わせによって決まりますが、その遺伝子を制御しているのは転写因子です。多能性に関する転写因子を過剰発現することで、体細胞をiPS細胞へと変化させることができますが、なぜiPS細胞へと初期化するのか、そのメカニズムは明らかにされていませんでした。しかし、より高品質なiPS細胞の作製や、目的の細胞へと効率的な分化を行うためには、初期化のメカニズムを明らかにすることが重要です。
これまで細胞を分化させる仕組みと、細胞を初期化させる仕組みとを関連付けた研究は行われていませんでした。升井講師らは、細胞の種類を決定づけるようなコアとなる転写因子が存在し、それらがどの種類の細胞へと分化するかを決定すると共に、過剰に働かせるとiPS細胞への初期化を阻害すると考えました。
<研究結果>
1)初期化における遺伝子の働きを評価するiPS干渉法
神経系の細胞(NSEB5-2C)に、初期化因子OSKM(Oct3/4、Sox2、Klf4、c-Myc)を導入するとiPS細胞へと初期化されます。初期化因子に加え、網羅的解析によって明らかにした神経系細胞に特徴的な因子のうちの1つを導入する実験を行いました。もしその因子が他の因子に影響を与えない因子であった場合、NSEB5-2CはOSKMによって通常通り初期化されiPS細胞になります。しかし他の因子にも影響をあたえて神経系細胞の特徴を決定づけるようなコア因子であった場合、OSKMの効果を打ち消し、iPS細胞になる確率が低くなると考えられます。
2)iPS細胞への初期化を阻害する因子が分化誘導に重要な因子であることを明らかにした
iPS干渉法を用いてNSEB5-2Cの初期化を強く阻害する6つの因子を同定しました。この因子をマウス胎児繊維芽細胞(MEF)や肝臓細胞(HNG2)などに導入したところ、細胞の形態がNSEB5-2Cに似た細胞へと変化しました。また、神経系細胞に特徴的な遺伝子であるNestinの発現も確認されました。さらには、肝臓の細胞(HNG2)でiPS干渉実験を行ったところ、肝臓細胞への分化を促進することが知られている4つの因子(Foxa2、Hnf4a、Foxa3、Hnf1a)は、いずれもHNG2のiPS細胞化を強く阻害しました。以上の結果から、初期化を阻害する因子は、細胞の分化の方向性を決める重要な因子であることが明らかになりました。
3)分化細胞が初期化されるメカニズムの一端を明らかにした
ここまでの実験から、通常ではOSKMにより初期化される細胞でも、その細胞に特異的な遺伝子を過剰発現させると、細胞の初期化が阻害されました。この事実から、分化細胞が初期化されるメカニズムとして、分化細胞に特徴的な遺伝子群が分化を維持する働き(初期化を阻害する働き)をしており、初期化因子であるOSKMを作用させると、分化細胞に特徴的な遺伝子の働きが弱くなることで初期化が進むことが明らかとなりました。
<まとめ>
今回の成果により、初期化のメカニズムと分化の種類を制御するメカニズムがつながっていたことがわかりました。iPS干渉法は、神経細胞以外の他の種類の細胞でも同様に利用することができ、細胞の初期化や分化のメカニズムを明らかにするために有効なツールとして利用できると考えられます。例えば、分化した細胞からiPS細胞が作製される仕組みの理解が進み、より高品質なiPS細胞を作る技術開発につながります。また、分化した細胞を特徴づける遺伝子の働きを明らかにすることで、各種細胞を効率よく作る技術の開発につながります。このように、高品質なiPS細胞作製や高効率な誘導方法の開発を通じて、iPS細胞を利用した新薬の創出や再生医療に貢献することが期待できます。
<参考図>
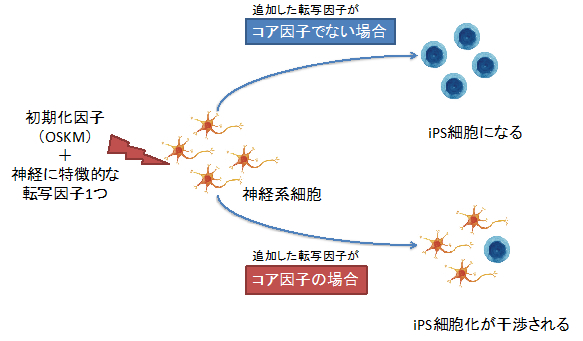
図1 iPS干渉法の考え方
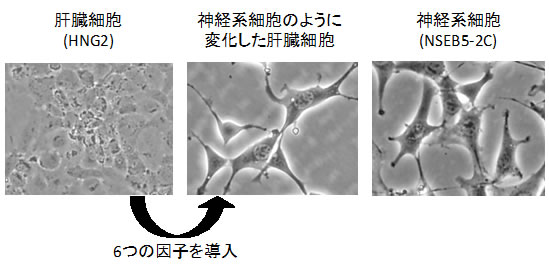
図2 iPS干渉法で同定した因子を肝臓細胞に導入し神経系細胞へと変化させた
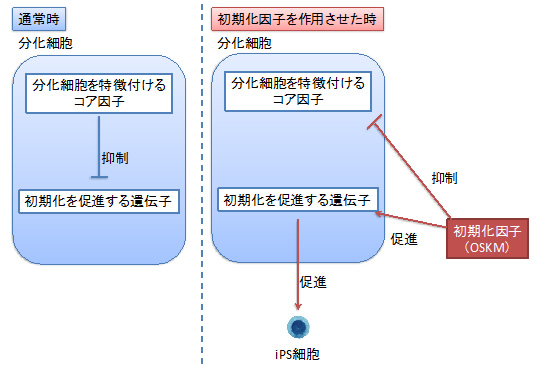
図3 分化細胞で初期化が生じる仕組み
<用語解説>
- 注1) 初期化
- 分化した体細胞の核がリセットされ受精卵のような発生初期の細胞核の状態に戻り、多能性幹細胞などに変化すること。
- 注2) JST 戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「iPS細胞と生命機能」
(研究総括: 西川 伸一 (独)理化学研究所 発生・再生科学総合研究センター 特別顧問/JT生命誌研究館 顧問)
|
| 研究課題名 |
「任意細胞の樹立法開発」 |
| 個人研究者 |
升井 伸治 (京都大学 iPS細胞研究所 講師) |
| 研究期間 |
平成20年6月~24年3月 |
- 注3) 転写因子
- タンパク質合成は、DNA上の遺伝子を鋳型としてメッセンジャーRNAが転写され、このメッセンジャーRNAが核外のリボソーム上で翻訳される過程で成り立っている。転写因子は、転写開始に関わるタンパク質因子で、DNAに結合して働くものや因子間の相互作用によって機能するものがある。
<論文名、著者およびその所属>
○論文名
“Transcription factors interfering with dedifferentiation induce cell type-specific transcriptional profiles”
doi: 10.1073/pnas.1220200110
○ジャーナル名
Proceedings of the National Academy of Sciences
○著者
Takafusa Hikichi1,2 , Ryo Matoba3 , Takashi Ikeda1,2, Akira Watanabe2, Takuya Yamamoto2, Satoko Yoshitake1, Miwa Tamura-Nakano1, Takayuki Kimura1, Masayoshi Kamon4,Mari Shimura1, Koichi Kawakami5, Akihiko Okuda4,8, Hitoshi Okochi1, Takafumi Inoue6, Atsushi Suzuki7,8,9 and Shinji Masui1,2,9,*
*) 責任著者
○著者の所属機関
1 国立国際医療研究センター研究所
2 京都大学 iPS細胞研究所(CiRA)
3 株式会社DNAチップ研究所
4 埼玉医科大学 ゲノム医学研究センター
5 国立遺伝学研究所
6 早稲田大学理工学術院
7 九州大学生体防御医学研究所
8 科学技術振興機構(JST) CREST
9 科学技術振興機構(JST) さきがけ
<本研究への支援>
本研究は、下記機関より資金的支援を受けて実施されました。
・科学技術振興機構 さきがけ
・文部科学省 科学研究費補助金(特定領域研究)DECODE
・文部科学省 科学研究費補助金(基盤研究C)
・武田科学振興財団
・かなえ医薬振興財団
・ノバルティス科学振興財団
・がん研究振興財団
<お問い合わせ先>
京都大学 iPS細胞研究所(CiRA)
研究支援部門 国際広報室
和田濵・遠山
TEL:075-366-7005 FAX:075-366-7023
E-mail: