ポイント
- 免疫を抑制するT細胞が作られる共通のメカニズムは不明であった。
- STIM分子を介したカルシウム流入が抑制機能を持つT細胞の成熟に必須。
- 新たな自己免疫疾患のマーカーや治療への応用に期待。
JST 課題達成型基礎研究の一環として、東京医科歯科大学 歯と骨のグローバルCOEプログラムの大洞 将嗣 特任准教授らは、免疫細胞の中でも、過剰な免疫反応を抑えるさまざまなT細胞注1)(抑制性T細胞)が作られる共通のメカニズムを発見しました。
抗原を認識して免疫反応を開始するリンパ球の一種のT細胞は胸腺で作られます。その成熟過程では一部、自分の体の成分(自己抗原)に反応する(自己反応性)ものが現れますが、危険であるためにその多くは選択的に排除されます。一方で、過剰な免疫反応を抑制し、生体の恒常性を維持する抑制性T細胞は、自己反応性を持っています。抑制性T細胞が自己反応性を持っていながら排除されずに作られてくる分子的なメカニズムについて、これまでにさまざまな研究が行われていますが、詳細は不明のままでした。
大洞特任准教授は今回、STIM1、2注2)というカルシウムの量を調整するたんぱく質を欠損したマウスが、抑制機能を持つT細胞を全く持たなかったことを発見しました。さらに、STIM1、2が働いて細胞内へのカルシウム流入が起きることが、抑制性T細胞の増加や成熟に必須であり、知られている抑制的なT細胞全てに共通した分化メカニズムであることを明らかにしました。
今後、抑制機能を持つT細胞を人工的に作製・誘導する場合にSTIM分子が必須因子として役立つものと考えられます。また、STIM分子の人為的制御による過剰な免疫応答を抑制する治療法開発につながる可能性があり、シェーグレン症候群注3)や運動麻痺を起こす多発性硬化症などの自己免疫疾患の治療に役立つことが期待されます。
本研究成果は、2013年3月14日(米国東部時間)に米国科学誌「Immunity」のオンライン速報版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 個人型研究(さきがけ)
| 研究領域 |
「炎症の慢性化機構の解明と制御」
(研究総括:高津 聖志 富山県薬事研究所 所長)
|
| 研究課題名 |
「イオンバランス破綻による自己免疫疾患の重症化機構の解明」 |
| 研究者 |
大洞 将嗣(東京医科歯科大学 歯と骨のグローバルCOEプログラム 特任准教授) |
| 研究実施場所 |
同上 |
| 研究期間 |
平成23年4月~平成26年3月 |
JSTはこの領域で、炎症の慢性化機構という現象の実体解明に向けた研究を行い、それに基づき、がん・動脈硬化性疾患・アレルギー・自己免疫疾患などの炎症の慢性化が関与するさまざまな疾患の予防や治療、創薬につながる新たな医療基盤の創出を目指しています。本研究課題では、生体の機能や正常な発生に非常に大切なカルシウムなどのイオンの免疫細胞における役割とそのバランスの破綻に伴う自己免疫疾患の発症や重症化メカニズムを解明し、新規治療法の開発につながる基盤技術の確立を目指します。
<研究の背景と経緯>
私達の身体に備わっている免疫系は、「自己」と「非自己」を識別し、「自己」である自身の組織は攻撃せず、「非自己」である細菌やウイルスなどの病原体による感染症から身を守る重要なシステムと考えられています。しかし、免疫応答が過剰になると、正常な細胞や組織をも攻撃するようになり、自己免疫疾患やアレルギーなどを引き起こします。そのため免疫応答は、活性化と抑制のバランスを保つことがとても重要です。
免疫応答の主役を担うのはリンパ球の1つである「T細胞」です。T細胞の表面にはT細胞受容体(TCR)注4)というたんぱく質があり、それが抗原を認識するとT細胞が活性化し、免疫反応が開始されます。TCRの構造は、T細胞クローン(同一のTCRを持つ集団)ごとに異なっており、このバリエーションこそが、さまざまな病原体に対して免疫反応が起きる秘訣と考えられています。
T細胞が持つTCRのバリエーションは、TCR遺伝子の再構成注5)などによってランダムに生じるので、胸腺内でできる未熟なT細胞クローンの中には「自己」である自身の抗原に反応するものも含まれます。そこで、T細胞の成熟過程において、自己抗原に対するTCRの反応性を検査し、不要な自己反応性のTCRを持つT細胞を排除する必要があります(図1)。自己抗原に反応した場合は排除されます。
最近になって、一部の自己反応性T細胞は除去されず、成熟することが分ってきました。このような自己反応性の成熟T細胞には、制御性T細胞(Treg細胞)などがあり、過剰な免疫応答や、活性化した免疫細胞による自身への攻撃を防ぐ重要な役割を担っています。そして、これらの細胞は、「アゴニスト注6)選択」と呼ばれる特殊な方式で選択されることが知られていましたが(図1)、自己反応性を保ちながらもどのようなメカニズムで選択されているのかは明らかになっていませんでした。
ところで、一般的にT細胞ではTCR刺激を受けると、細胞内のカルシウム濃度が増加することが知られていました。このカルシウム濃度の増加は2段階で行われます。第1段階として、細胞内(小胞体という細胞内小器官)に蓄えられていたカルシウムが、細胞質へ放出されます。小胞体のカルシウムがなくなったことを、カルシウムセンサーたんぱく質であるSTIMが感知すると、第2段階として長時間に大量のカルシウムが細胞外から流入されます(図2(A))。T細胞では、このカルシウム流入が主なカルシウム供給方法であり、T細胞の活性化や増殖に重要です。そして、長い間全てのT細胞の分化にも必須であると予測されてきましたが、その確たる証拠はありませんでした。
本研究グループは、これまでにT細胞においてのみSTIM1とSTIM2をなくした2重欠損マウス(以下、DKOマウス)で、代表的な抑制性T細胞である制御性T細胞(Treg細胞)の分化・機能不全によって、自己免疫疾患であるシェーグレン症候群と類似した症状を発症することを見いだしています。またマウスだけではなく、ヒトにおいても、シェーグレン症候群の疾患の重症度に比例してSTIM分子の発現が低下することを報告しています(文献1、2)。そこで、Treg細胞を始めとする抑制性T細胞の分化における、STIM分子によって制御されるカルシウム流入の役割を明らかにすることを目指しました。
<研究の内容>
本研究グループは、まずDKOマウス胎児の肝臓細胞(T細胞など全ての免疫担当細胞に分化する造血幹細胞が含まれている)を、T細胞が存在しないマウスに移植したマウスや、血球細胞のみにSTIM1とSTIM2をなくしたDKOマウスを作製し、T細胞の分化におけるSTIM分子の役割を検討しました。その結果、DKOマウスの成熟していないT細胞前駆細胞では、細胞外からのカルシウム流入は完全に抑制されていましたが(図2(B))、通常のT細胞の発生は正常でした。つまり、カルシウム流入が通常のT細胞の発生には重要な役割を果たさないことを意味しており、カルシウム流入が全てのT細胞の分化に重要であるというこれまでの予測を覆すものです。
さらに研究グループは、DKOマウスの全てのT細胞を解析した結果、全ての抑制性T細胞の分化が選択的に阻害されていることを発見しました。これらの細胞の分化は、まず「アゴニスト選択」された後、マスター転写因子注7)を発現するようになり、さらに刺激を受けて分化・増殖するという過程を踏みます(図3)。この過程を詳しく解析した結果、カルシウム流入がなくなることによって、マスター転写因子発現後の分化と増殖が選択的に抑制されていることが分かりました。
インターロイキン注8)2(IL-2)やIL-15は、抑制性T細胞の機能発現に重要な役割を果たすことが知られています。そこで、IL-2をDKOマウスに投与することによって、Treg細胞の増殖と機能が回復するかどうかを調べました。その結果、正常マウスより少ないTreg細胞の増加が認められた一方で、Treg細胞の抑制機能は回復されませんでした。これらの結果から、STIM分子によって制御されるカルシウム流入は、Treg細胞の成熟過程に必須であることが明らかとなりました。
最後に、カルシウム流入によって活性化することが知られている転写因子NFAT注9)が、抑制性T細胞の成熟に必須であるかどうかを調べました。胸腺細胞では、3種類のNFATが発現しています。全てのNFATを欠損した場合、全てのT細胞の分化が阻害されると予想されるため、そのうちの2つを欠損したマウスを作製して解析を行いました。その結果、やはり抑制機能を持つT細胞群の成熟のみが選択的に50%程度まで抑制されていました。
以上の結果から、STIMで活性化されるカルシウムの流入は、従来予想されていた通常のT細胞の選択ではなく、抑制機能を持つ全てのT細胞の最終分化、成熟に必須であり、過剰な免疫応答を抑制して生体の恒常性を維持している重要なメカニズムであることが初めて分りました(図4)。また、アゴニスト選択性の抑制性T細胞の分化において、TCR直下におけるNFATを介する共通のシグナル伝達経路が明らかとなりました。
<今後の展開>
これまで、抑制機能を持つT細胞の分化は、その細胞で発現する特徴的なたんぱく質の発現と機能で説明されてきました。しかし、本研究によって、カルシウム流入が全てのそれらT細胞の成熟過程に必須であることが分かったことにより、将来、抑制機能を持つT細胞を人工的に作製・誘導する場合にSTIM分子が必須因子として役立つものと考えられます。また、自己免疫疾患であるシェーグレン症候群患者では疾患の重症度に比例してSTIM1とSTIM2の発現レベルが減少することがすでに報告されているので、ほかの自己免疫疾患においてもSTIM分子の発現レベルが疾患の重症度を示すマーカーとして使用できる可能性があります。さらに進んで、人為的にSTIM分子の発現や機能を制御することができれば、自己免疫疾患に対する新たな治療法の開発につながるものと期待されます。
<参考図>
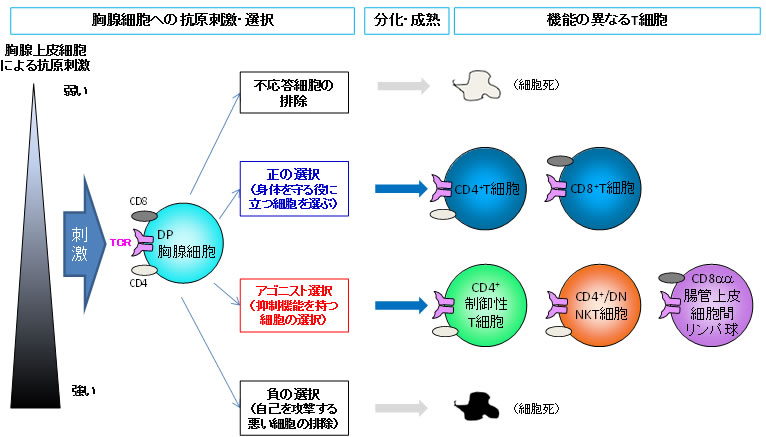
図1 胸腺におけるT細胞の選択と分化
胸腺内において、T細胞の前駆細胞はCD4とCD8と呼ばれる分子の両方を発現しており、DP胸腺細胞(CD4+CD8+double positive細胞)と呼ばれるが、成熟するとCD4のCD8のどちらか一方のみ、あるいはいずれも発現しなくなる。このDP胸腺細胞は、胸腺上皮細胞による自己抗原刺激に対する反応性の違いによって生死や分化の方向性が選択される。ほとんど反応しない細胞は不応答による細胞死となり、適度に反応する細胞は「正の選択」を受け免疫応答を担う通常のT細胞へ分化・成熟する。一方、非常に強く自己抗原と反応する細胞は「負の選択」を受け細胞死が誘導される。また、比較的強く反応する一部の細胞は「アゴニスト選択」によって分化し、成熟した細胞となる。これら「アゴニスト選択」を受けるT細胞として、制御性T細胞、NKT細胞、CD8αα+ 腸管上皮細胞間リンパ球があり、免疫抑制機能を持つ。
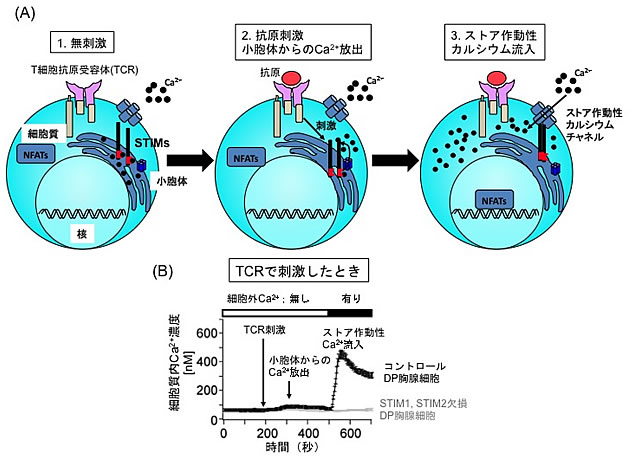
図2 T細胞刺激時のストア作動性カルシウム流入
(A)ストア作動性カルシウム流入のメカニズム。1.無刺激の状態では、STIM分子は小胞体内のカルシウムと結合している。2.抗原刺激を受けると、小胞体からカルシウムが細胞質へ放出される。3.カルシウムを失ったSTIM分子は、STIM分子同士で凝集結合し、細胞膜上に発現している「ストア作動性カルシウムチャネル」に結合して、チャネルを活性化する。その結果、細胞外から細胞質内に大量のカルシウムが流入する。このように、小胞体内のカルシウム貯蔵(ストア)の枯渇に応答した細胞質へのカルシウム流入をストア作動性カルシウム流入という。
(B)コントロールの正常なDP胸腺細胞のTCRを刺激すると、細胞質内のカルシウム濃度は200秒後にわずかに上昇し(小胞体からのカルシウム放出)、500秒後には急上昇する(ストア作動性カルシウム流入)が、STIM分子を欠損したDP胸腺細胞では、小胞体からのカルシウム放出は認められるが、ストア作動性カルシウム流入は見られない。このことから、STIM分子がDP胸腺細胞におけるストア作動性カルシウム流入に必須であることが分かる。
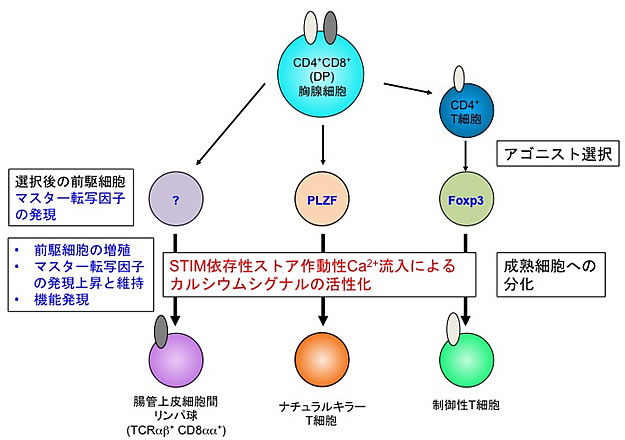
図3 ストア作動性カルシウム流入によるアゴニスト選択性T細胞の分化制御メカニズム
STIM分子を遺伝的に欠損したマウスにおけるアゴニスト選択性T細胞(抑制性T細胞)を調べたところ、それら細胞のマーカーとなるマスター転写因子を持つ細胞が著しく少なく、STIM分子で制御されるストア作動性カルシウム流入が、アゴニスト選択された後の各前駆細胞から成熟細胞への分化と増殖を制御していることが分かった。
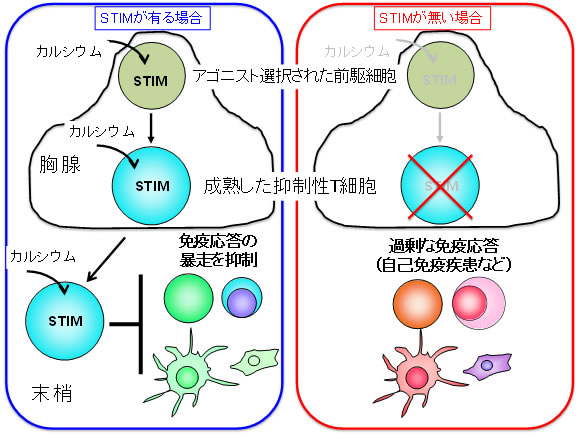
図4 STIM分子は抑制性T細胞の成熟に必須で免疫応答の暴走を抑制する
STIM分子がT細胞で発現していると、細胞内にカルシウム流入が起きて抑制性T細胞が成熟し、胸腺から末梢組織に移動して免疫応答の暴走が抑えられる。しかし、STIM分子がないと抑制性T細胞がいなくなり免疫応答が止められずに自己免疫疾患が起こる。
<用語解説>
- 注1) T細胞
- T細胞は、T細胞受容体(注4参照)と呼ばれるたんぱく質を細胞表面に持ち、この受容体を介して「非自己」である細菌やウイルスなどの病原体などを特異的に認識して活性化する。T細胞は異物認識の働き方から、キラーT細胞とヘルパーT細胞に大きく分類される。また、T細胞には、ほかの免疫担当細胞の活性化を抑制する機能を持つ制御性T細胞と呼ばれる集団が存在する。
- 注2) STIM1(Stromal interaction molecule 1)とSTIM2
- 小胞体(細胞内小器官の1つ)に存在し、休止期の細胞では小胞体に貯蔵されているカルシウムがSTIM分子と結合している。細胞が活性化し、小胞体からカルシウムが放出されると、STIM分子からカルシウムイオンがなくなるため、STIM分子は多量体を形成し、細胞膜上のストア作動性カルシウムチャネルと結合できるようになる。その結果、ストア作動性カルシウムチャネルが活性化され、チャネルが開口される。STIM1とSTIM2ではEF handモチーフのカルシウム結合性が異なり、STIM1の方が結合性が高い。
- 注3) シェーグレン症候群
- 自己免疫疾患の一種であり、涙腺の涙分泌を障害、唾液腺の唾液分泌などを障害する。代表的な症状は、涙が少なくなるために起こるドライアイや口腔が乾燥するドライマウスである。40~60歳の中年女性に好発する。自己抗体は、抗SS-A/Ro抗体・抗SS-B/La抗体である。
- 注4) T細胞受容体(TCR)
- T細胞の表面に発現しており、抗原と主要組織適合抗原と呼ばれるものの複合体を認識(結合)するとT細胞は刺激を受ける。TCRは、α鎖とβ鎖あるいはδ鎖とγ鎖の2本鎖から構成される。α鎖とβ鎖を発現するT細胞が圧倒的に多い。
- 注5) TCR遺伝子の再構成
- TCRは2種類のたんぱく質で構成されるが、元のDNA上にはそれらの断片領域(特にV,D,J領域)のそれぞれをコードする多くの遺伝子が用意されている。T細胞の発生分化段階では、それらの断片領域から1個ずつの遺伝子が選び出され、そのほかの遺伝子を切り捨てることにより、連続し再構成されたDNA鎖となる。これをTCR遺伝子の再構成という。また、VDJ結合部位には再構成時のDNA修復に伴うランダムな塩基の挿入が起こり、さらにこれらが2種類のたんぱくで起こるため、TCRの多様性は1018といわれている。
- 注6) アゴニスト
- もともとは、生体内の受容体分子に働いて、生理的な活性化物質と同じように活性化させる機能を持つ分子を示す。本研究での意味は、明らかに自己と反応するTCRを持つT前駆細胞を成熟T細胞へ分化させる抗原を意味する。
- 注7) マスター転写因子
- 遺伝情報に基づき分化プログラムのスイッチをオンにする役割を果たす分子。この分子が発現することで、特定の細胞に分化の方向が決定づけられる。
- 注8) インターロイキン
- 細胞の活性化、分化、増殖、および細胞間の相互作用などに関与する分子で、免疫担当細胞が産生する。現在、30種類以上が知られている。
- 注9) NFAT
- ほかの遺伝子の発現を制御する転写因子の1つ。また、さまざまな転写因子と協調して機能することによって、細胞依存性、あるいは刺激依存性に特異的な転写制御を行う。NFAT1からNFAT5までの5種類存在する。休止期では細胞質内に存在する。
- 免疫担当細胞には特に、NFAT1(別名NFATc2)、NFAT2(別名NFATc1)、NFAT4(別名NFATc3)が多く存在する。カルシウム流入によって活性化されて核へ移行し、転写因子として機能する。
<論文タイトル>
“Agonist-selected T cell development requires strong TCR/calcium signaling”
(アゴニスト選択性T細胞の分化には強いTCR/カルシウムシグナルが必要である)
<文献>
1.Oh-hora M, et al. Dual functions for the endoplasmic reticulum calcium sensors STIM1 and STIM2 in T cell activation and tolerance. Nat Immunol. 9, 432-443 (2008)
2.Cheng KT, et al. STIM1 and STIM2 protein deficiency in T lymphocytes underlies development of the exocrine gland autoimmune disease Sjogren's symdrome. Proc Natl Acad Sci USA. 109, 14544-14549 (2012)
<お問い合わせ先>
<研究に関すること>
大洞 将嗣(オオホラ マサツグ)
東京医科歯科大学 歯と骨のグローバルCOEプログラム 特任准教授
〒113-8549 東京都文京区湯島1-5-45
Tel:03-5803-5160 Fax:03-5803-0275
E-mail:
<JSTの事業に関すること>
石正 茂(イシマサ シゲル)、木村 文治(キムラ フミハル)、眞後 俊幸(シンゴ トシユキ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3525 Fax:03-3222-2067
E-mail:
<報道に関すること>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
東京医科歯科大学 総務部 総務企画課 広報掛
〒113-8510 東京都文京区湯島1-5-45
Tel:03-5803-5011 Fax:03-5803-0272
E-mail: