<ポイント>
- 臓器を欠損している動物に異なる動物由来の臓器を作らせることは、小型実験動物では成功しているが、大型動物ではできるのかがこれまでの課題。
- 体細胞クローニング技術を用いて、すい臓欠損クローンブタを作製、胚盤胞補完技術を用いて、正常ブタ由来のすい臓を持つキメラブタの作製に成功。
- 将来の再生医療にも大きく期待。
JST 課題達成型基礎研究の一環として、東京大学 医科学研究所の中内 啓光 教授とJST 戦略的創造研究推進事業 ERATO型研究「中内幹細胞制御プロジェクト」の松成 ひとみ 研究員、同プロジェクトチームの明治大学 農学部 生命科学科の長嶋 比呂志 教授らは、遺伝子導入と体細胞クローニング注1)技術を用いて、すい臓のないクローンブタを作ることに成功しました。さらに、このすい臓のないクローンブタに体細胞クローニング技術と胚盤胞補完技術を用いて、健常ブタの胚細胞由来のすい臓を作ることに成功しました。
研究チームはこれまで、臓器を欠損している動物に、ほかの動物の臓器を作らせることをマウスとラットの小型動物では成功しており、大型動物でも同じことができるかが次の課題でした。今回、体細胞クローニング技術によりすい臓を持たないクローンブタを作り、その胚(ホスト胚)に正常ブタ由来の胚(ドナー胚)を注入し、胚盤胞補完法注2)によって、キメラ注3)胚盤胞からすい臓欠損の遺伝子を持ち正常ブタ由来のすい臓を再生させたキメラブタを作ることに成功しました。
ブタのような大型動物においても、胚盤胞補完法による臓器再生の原理が証明されたことから、本研究成果を応用すればヒトの臓器がどのように形成されるのか、そのメカニズムを異種動物の体内で解析することが可能になります。さらに大型動物の体内でヒトの臓器を再生するといった、全く新しい再生医療技術の開発に大きく貢献するものと期待されます。
本研究は東京大学、明治大学と共同で行われ、本研究成果は、米国科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版で2013年2月18日の週(米国東部時間)に公開されます。
本成果は、以下の事業・研究プロジェクトによって得られました。
戦略的創造研究推進事業 ERATO型研究
| 研究プロジェクト |
「中内幹細胞制御プロジェクト」 |
| 研究総括 |
中内 啓光(東京大学 医科学研究所 教授) |
| 研究期間 |
平成19~24年度 |
JSTはこのプロジェクトで、臓器発生過程の基礎的研究と、その知見に基づいた臓器再生法確立のための新技術の研究を行っています。
<研究の背景と経緯>
多能性幹細胞注4)である胚性幹細胞(ES細胞)注5)や人工多能性幹細胞(iPS細胞)注6)から臓器を作り出すことは、再生医療の究極目標の1つです。しかし臓器を作るためには、その立体的な構造を生体外で再現しなければならず、困難を極めます。そこで本研究では「胚盤胞補完法(Blastocyst complementation)」の技術に注目しました。
胚盤胞補完法とは、特定の細胞を作る能力を欠損しているマウスの胚盤胞に正常なマウス由来の多能性幹細胞を注入し、キメラが成立すると、欠損した細胞が完全に多能性幹細胞由来のものに置き換えられるというもので、今から15年ほど前にリンパ球を欠損したマウスを用いてその原理が報告されています。その後、研究チームはこの原理を応用し、遺伝的にすい臓を欠損するマウスの胚盤胞に、ラットの多能性幹細胞を注入することによって、マウスの生体内でラットのすい臓を作ることに成功しました(Cell.2010)。
また、腎臓を欠損するマウスの胚盤胞に同種の多能性幹細胞を注入することで、欠損していた腎臓を外来性幹細胞から作り出すことにも成功しました。この成果によって、すい臓や腎臓のような固形臓器の生産にも胚盤胞補完法は応用が可能であること、さらにマウス、ラットという異種動物間にも胚盤胞補完原理が適用できることが示されました。
胚盤胞補完法によってヒト臓器の作製を目指すためには、マウスやラットという小型動物ではなく、ヒトの体格に近い大型動物を用いてサイズの大きな臓器を作ることが必要です。そこで、ヒトに類似した特徴を持つブタを用いて、大型動物を用いた胚盤胞補完法を行うための技術的基盤の構築を目指して本研究を行いました(図1)。
<研究の内容>
(1)すい臓欠損ブタの作出(図2)
本研究ではまず、すい臓を持たないブタを作り出すことに取り組みました。マウスの実験では、Pdx1遺伝子の破壊という方法を選択しましたが、ブタでは遺伝子破壊に時間がかかるために、Pdx1-Hes1遺伝子注7)の過剰発現によってすい臓形成を阻害するという方法を採用しました。Pdx1-Hes1遺伝子を顕微授精法注8)でブタ卵に注入することによって、すい臓のないブタを作りました。大型動物で初めて、臓器のない個体を作り出すことを実現したものです。
(2)胚盤胞補完法を用いてすい臓欠損ブタの体内に健常ブタ由来のすい臓を作る(図3)
すい臓のないブタは、生後まもなく重度の高血糖症状などによって死亡するため、成長後に繁殖させ、胚(受精卵)を採取することは不可能です。そこで、すい臓のないブタの細胞から、体細胞クローニング技術によってクローン胚(ホスト胚)を作り、ホスト胚に健常なブタから作り出したクローン胚の細胞(ドナー胚)を注入するという胚盤胞補完を行いました(図1)。そのとき、健常なブタとして、赤色蛍光たんぱく(humanized Kusabira-Orange)遺伝子を持つブタと褐色の毛色を持つブタを用いることで、胚盤胞補完によって得られるキメラ個体が、蛍光発現と毛色によって識別できるように工夫しました。その結果、すい臓のない遺伝子を持ったホスト胚と健常なブタドナー胚のキメラ胚盤胞により、キメラ状態になった産仔が複数得られました。これらのキメラブタでは、ないはずのすい臓がドナーである健常ブタ(赤色蛍光たんぱく遺伝子を持つブタ、あるいは褐色の毛色を持つブタ)胚由来の細胞で完全に形成されていることが確認されました。胚盤胞補完によって得られたこのキメラブタは正常に成長し、すい臓機能や繁殖能力も正常であることが確認されました。
これによって、マウスやラットなどの小型実験動物で開発された胚盤胞補完システムが、大型動物であるブタにも適用可能であることが証明されました。また、体細胞クローニング技術が臓器欠損個体の胚を大量に生産するためには非常に有用であることが示されました。
<今後の展開>
ブタで胚盤胞補完の原理が証明されたことは、次の研究の焦点である、すい臓欠損ブタ胚に対する異種間胚盤胞補完が可能であるかを試みることができます。今回得られたキメラブタは生殖年齢になれば自然交配が可能となります。これにより、これらの個体を用いて、すい臓を欠損する性質を持った受精卵を採取できることで、Pdx1-Hes1遺伝子を持つブタ胚に、ウシ、ヒツジ、サルなどの多能性幹細胞を注入した大動物における異種キメラの作製・臓器置換を試みることが可能になります。
また、胚盤胞補完で得られたキメラブタの次世代の胎仔は、ヒトの臓器再生医療に向けた研究の1つとして役立つものと期待しています。それは、キメラブタから生まれたすい臓欠損ブタ胎仔の体内にヒト多能性幹細胞由来のすい臓を形成する実験です。現在の研究では、倫理上、ヒトの多能性幹細胞を注入したブタ胚をブタの子宮に移植して、胎仔期以後の発育を調べる研究を行うことができません。そこで、すい臓欠損ブタ胎仔の体内に、すい臓への分化を誘導したすい臓の前駆細胞を移植することによって、ヒトのすい臓を作り出す試みです。ブタ胎仔のすい臓欠損という特徴は、ヒト細胞からすい臓を作るための「あき空間(ニッチ)」として有利に働くことが期待されます。また、ブタ胎仔の免疫機構は妊娠中期以前には未発達なので、その時期にヒトの細胞を移植しても拒絶反応が起こりません。患者由来の多能性幹細胞や、そこから生体外で分化させた細胞や組織を大型動物の個体の中に適切なタイミングと場所に移植することで、自身の臓器を作ることも可能になるかもしれません。
本研究成果から、胚盤胞補完法によって、ヒト臓器作製にチャレンジするための技術基盤が構築されました。しかしながら、現在の日本のガイドラインではヒト多能性幹細胞を注入した動物の胚を子宮に入れて発育させることが禁じられているため実験を進めることができません。今後、生命倫理や法律についての議論が進むことが期待されます。
<参考図>
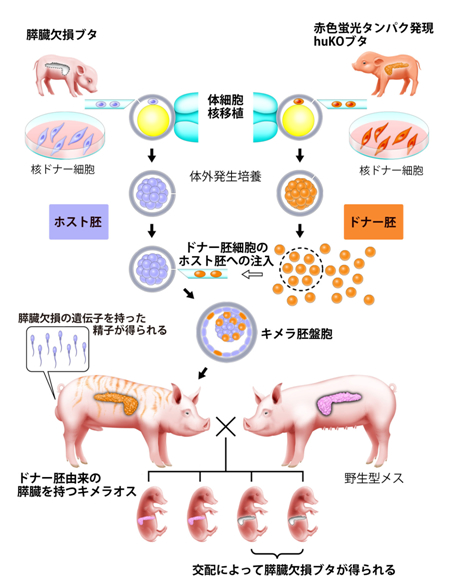
図1 研究内容全体を示す模式図
Pdx1-Hes1遺伝子を持つ、すい臓(膵臓)欠損ブタ由来の胚(ホスト胚)に赤色蛍光タンパク遺伝子(humanized Kusabira-Orange,huKO)を持つ正常ブタ由来の胚(ドナー胚)を注入し、仮親の体内で成長させたところ、ドナー由来のすい臓を持ったキメラブタ(雄)が誕生した。このキメラブタ(雄)は、正常に発育し、野生型雌ブタと自然交配することにより、常に一定の割合ですい臓を欠損する個体を得ることができる。またこのキメラブタの精子はすい臓欠損の性質を引き継いでいるので、今後この精子を利用することで、すい臓欠損ブタの再生産が容易になる。
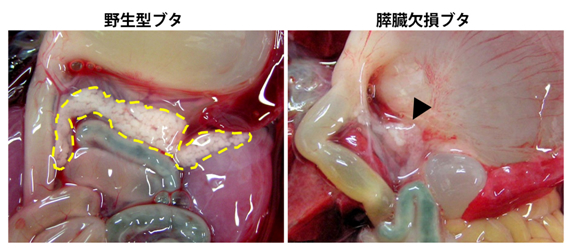
図2 野生型ブタとすい臓(膵臓)欠損を誘導したブタ胎仔の内臓所見
胎齢約80日の胎仔におけるすい臓の所見。野生型(左)ではすい臓が明瞭に見えるが(黄色点線)、欠損ブタ(右、黒矢印)ではすい臓が喪失している。
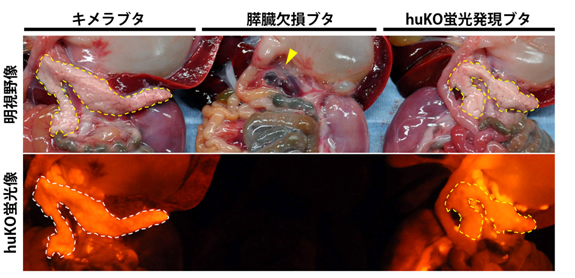
図3 キメラ・すい臓(膵臓)欠損・健常ブタの内臓所見・蛍光観察
(左)健常ブタ由来のすい臓で補完されたキメラブタ胎仔
(中央)Pdx1-Hes1遺伝子を持つすい臓欠損ブタ由来の胎仔
(右)健常ブタ(huKO蛍光発現ブタ)由来の胎仔
(上段)明視野観察像
(下段)蛍光観察像
キメラブタは、健常ブタ由来のすい臓が明瞭に見え(左上、黄色点線)、強いオレンジ色の蛍光を呈している(左下)。すい臓欠損ブタは、すい臓が喪失しており(中央上、黄色矢印)、蛍光発現も認められない(中央下)。健常ブタは、すい臓が明瞭に見え(右上、黄色点線)、全身に一様にオレンジ色の蛍光発現が認められる(右下)。
<用語解説>
- 注1) 体細胞クローニング(体細胞核移植)
- 体細胞核を未受精卵に移植することによってクローン個体を作出する方法。1997年に英国のウィルマット博士らによってクローン羊「ドリー」の誕生が初めて報告された。核ドナーとなる体細胞にあらかじめ外来遺伝子を導入しておくことによって、遺伝子組み換えクローン動物の作出も可能となる。
- 注2) 胚盤胞補完法
- 1993年にチェン博士らによって報告された方法。彼らは免疫グロブリンの構成に必要な酵素Rag2を欠損し、成熟したリンパ球を持たないRag2ノックアウト(KO)マウスの胚盤胞に正常なES細胞(注5参照)を注入することでキメラマウスを作製した。それらを解析したところ、成熟したリンパ球は全てES細胞由来のものであった。このことから胚盤胞注入後に発生に寄与したES細胞由来の細胞が欠損している細胞系譜を補完できることを示した。
- 注3) キメラ
- 胚同士の接着、もしくはES細胞(注5参照)を胚盤胞に注入することで得られる個体で、2種類以上の遺伝的に異なる細胞からなる。マウスではこのことを利用し、古くからノックアウトマウス作製に用いられてきた。
- 注4) 多能性幹細胞
- 試験管内などの人工的に構成された条件下で無限の増殖能を持ち、生体の全ての組織の細胞に分化が可能な細胞。
- 注5) 胚性幹細胞(ES細胞:Embryonic Stem cell)
- 受精後の胚盤胞(受精後4日程度の胚)に存在する内部細胞塊から樹立される多能性幹細胞。マウスでは1983年にエバンス(英国)らによって、ヒトでは1998年にトムソン(米国)らによって、その樹立が報告された。
- 注6) 人工多能性幹細胞(iPS細胞:induced Pluripotent Stem cell)
- 生体に存在する体細胞に特定の遺伝子(初期の報告ではOct3/4、Sox2、Klf4、c-Mycの4つ)を導入することで誘導される多能性幹細胞。マウスでは2006年に、ヒトでは2007年に、それぞれ京都大学の山中 伸弥 教授らによって樹立が報告された。
- 注7) Pdx1-Hes1遺伝子
- Pdx1はすい臓の発生に中心的な役割を持つ転写因子で発生の初期から発現している。Pdx1遺伝子のプロモーターに同じくすい臓発生に重要な転写因子のHes1遺伝子を連結することによって、Hes1遺伝子をすい臓発生初期から強制的に発現させることが可能となる。Hes1遺伝子を過剰発現するとすい臓形成が抑制される。
- 注8) 顕微授精法
- 未受精卵の細胞質中に精子を注入して、受精を成立させる技術。遺伝子組み換え動物の作出に応用可能なことが、1999年ペリー(米国)によってマウスで報告された。外来遺伝子を動物精子と一緒に培養することによって、精子頭部に外来遺伝子を付着させる。この精子を未受精卵に注入することにより遺伝子組み換え受精卵を作ることができる。作製した受精卵を動物体内に胚移植すると、遺伝子組み換え個体が誕生する。
<論文名>
“Blastocyst complementation generates exogenic pancreas in vivo in apancreatic cloned pigs”
(胚盤胞補完を利用したすい臓欠損ブタ内における外来性細胞由来すい臓の作出)
doi: 10.1073/pnas.1222902110
<お問い合わせ先>
<研究に関すること>
中内 啓光(ナカウチ ヒロミツ)
東京大学 医科学研究所 幹細胞治療研究センター 教授
〒108-8639 東京都港区白金台4-6-1
Tel:03-5449-5450
E-mail:
<JSTの事業に関すること>
坂本 祥純(サカモト ヨシズミ)
科学技術振興機構 研究プロジェクト推進部
〒102-0076 東京都千代田区五番町7 K’s五番町ビル
Tel:03-3512-3528 Fax:03-3222-2068
E-mail: