本研究成果のポイント
- 「iPS細胞は自家移植注1)でも拒絶反応を引き起こす」という米国研究チームの研究成果が報告されたが、それを覆す結果を得た。
独立行政法人 放射線医学総合研究所(以下、放医研) 研究基盤センター 荒木 良子 室長、安倍 真澄 特別上席研究員らの研究チームは、鶴見大学 歯学部 二藤 彰 教授らとの共同研究において、iPS細胞とES細胞の免疫原性注2)について解析を行い、両者に差がないことを明らかにしました。この成果は、英国科学雑誌「Nature」オンライン版に2013年1月10日3時(日本時間)に掲載される予定です。
iPS細胞は、拒絶反応が生じない移植医療を提供できる夢の細胞として注目されています。しかしながら、2011年5月、米国の研究チームは、マウスiPS細胞を元のマウスに移植すると、免疫反応が誘導され、移植細胞が拒絶されたという研究結果を報告しました。この報告により、iPS細胞が本当にES細胞と同様の性質を持っているのか、改めて慎重に調べ直す必要性が指摘されました。
このような状況の中、当研究チームは、高品質のiPS細胞およびES細胞を同系マウスより多数樹立し、iPS細胞・ES細胞由来の皮膚および骨髄細胞を用いて同系移植注3)実験を行いました。その結果、両細胞群ともに、免疫反応はほとんど誘導されず、生じても極めて軽微であることを明らかにしました。
本研究は、完全に分化した細胞を用いる場合には、拒絶反応を考慮する必要性がないことを示しました。本成果によりiPS細胞利用研究を加速するものと考えられます。なお、本研究の一部はJST 戦略的創造研究推進事業 個人型研究「さきがけ」の支援を受けました。
<研究の背景と目的>
山中 伸弥 京都大学 教授らが開発したiPS細胞(誘導性多能性幹細胞)は、ES細胞(胚性幹細胞)と同様、あらゆる組織に分化する能力を持っており、病気の研究・薬の開発への利用、更には再生医療の材料として期待されています。
iPS細胞の再生医療における最大の利点は、受精卵を使うES細胞と異なり、皮膚などの体細胞から作れるという点です。免疫反応は、外部から侵入した細菌やウイルスなどを異物とみなし排除しようとする機構ですが、この機構は、治療のために移植された他人の細胞に対しても多くの場合反応してしまいます(拒絶反応)。自分の体細胞から作ったiPS細胞を利用することにより、拒絶反応が起きない再生医療の実現が可能であると期待されました。ところが2011年5月、米カリフォルニア大サンディエゴ校のチーム注4)より、その期待を裏切るかのような実験結果が報告されました。マウスのiPS細胞を元のマウスに移植したときに、異物として認識され、リンパ球による免疫反応が誘導されました。一方でES細胞ではそのような現象は観察されなかったため、iPS細胞の異常性がクローズアップされ、再生医療への利用に慎重さが求められる状況となりました。しかし、彼らの実験にはES細胞が1株しか用いられていないこと、また、実際に医療に用いる場合は分化細胞を移植するにもかかわらず、iPS細胞そのものを移植したこと(iPS細胞・ES細胞を移植すると様々な分化細胞を成分とする奇形腫という腫瘍を形成する)などの解析手法の問題点、そして更なる解析の必要性が議論されていました。
<研究手法と結果>
当研究チームは、iPS細胞とES細胞の様々な性状比較を行う目的で、遺伝的に均一と考えられる近交系マウス(個体が違っても自家移植のモデルとして使うことができる)からiPS細胞とES細胞を多数樹立していました。iPS細胞樹立には腫瘍形成リスクが高いウイルスベクターを用いず、山中教授のグループが報告したプラスミドベクターによる方法により、ゲノムにベクターが入り込んでいない細胞株を選別しました。そして、樹立したiPS・ES細胞については多分化能を確認した上で実験に用いました。
まず、上述した米国チームによる研究と同様、奇形腫形成率を比較しました。iPS細胞7株とES細胞5株について、同じ系統のマウスの皮下に10回ずつ未分化の細胞を移植し、腫瘍の出現頻度、出現した場合は腫瘍の大きさの変化を調べたところ、両者に有意な差は見られませんでした(出現頻度はiPS細胞82.9±2.9%、ES細胞74.0±5.1%)。また、移植による免疫反応を確認するために、腫瘍へリンパ球がどれぐらい集まっているかを定量的に解析しました。その結果、両者ともリンパ球による免疫反応はほとんど誘導されず、生じても極めて軽微であることがわかりました。このことは、先行研究とは異なりiPS細胞とES細胞に対する免疫反応に差がないことを示しています。
次に、完全に分化させた組織を用いた移植実験による比較を試みました。移植利用を想定すると、試験管内でES細胞やiPS細胞から分化させた組織・臓器を移植する方法が実際的ですが、その方法はまだ研究途上で確立されてはいません。そのため分化の不完全性が免疫反応を引き起こすファクターとして加わりかねないことから、研究チームは、正常組織を作るために、iPS細胞・ES細胞からマウス個体を作成し、個体から皮膚および骨髄細胞を採取しました。このようにして得られた組織を同じ系統のマウスへ移植し、観察を行ったところ、iPS細胞とES細胞から分化させた細胞の両者において皮膚および骨髄共に、長期間定着していることが確認されました。
さらに、上述した米国チームによる先行研究においてiPS細胞における免疫反応を引き起こす原因として挙げられていたHormad1やZg16という遺伝子についても解析しました。先行研究の解析では、iPS細胞やES細胞の移植に伴い、拒絶を受けて縮小しているように見える奇形腫や皮膚組織が観察され、それらの組織において、Hormad1やZg16遺伝子が異常に活性化するというデータが示されています。しかし、今回の研究チームの解析では、自家移植組織において、Hormad1やZg16遺伝子の活性化をほとんど検出することはできませんでした。
<本研究成果と今後の展望>
本研究の特徴は、ヒトでは行うことができない実験を、iPS細胞・ES細胞からマウスの個体を作成し、そのマウス個体から得た組織を用いるという理想的な条件で実験を行ったことです。本研究成果により、iPS細胞も、自家移植の場合に拒絶を考慮する必要がないことが示され、臨床応用の前提条件が確認できたといえます。このことにより、iPS細胞を利用した治療、例えば、重度の放射線障害のように、骨髄の機能不全により血液細胞の減少が生じ、感染症や出血が原因で死に至る場合への血液の細胞の再生による治療などの応用が期待されます。
今回の研究では、iPS細胞とES細胞に有意な差は認められませんでしたが、研究チームは、今後も様々な角度から両者の性質の違いについて調べる予定です。
<参考図>
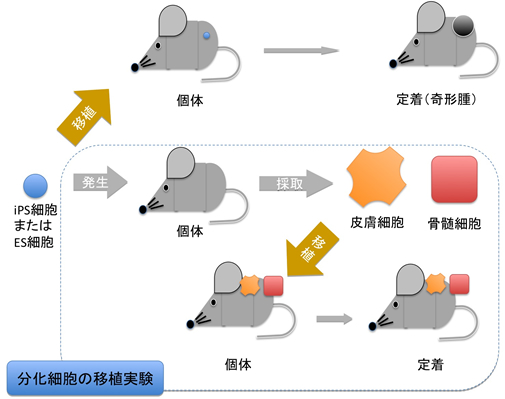
青い点線の枠で囲った部分が今回のメインの実験
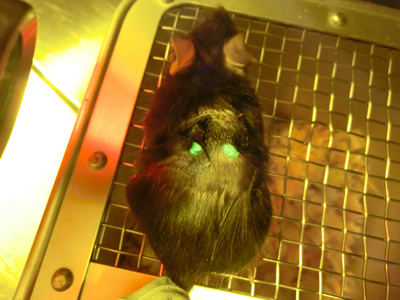
実験のマウス
GFP(緑色蛍光蛋白質)を作るiPS細胞からマウス個体を作出し、その皮膚(5mm×5mm)を同系マウス(GFPを作らない)の背部2箇所に移植した。
長期間の定着が観察された。写真は移植後約1ヶ月。緑色に光る部分が移植片。
<用語解説>
- 注1) 自家移植
- 同一個体内での移植。遺伝的に同一の細胞の移植となるため、免疫による拒絶反応は生じない。
- 注2) 免疫原性
- 移植された際、免疫細胞による反応(攻撃を受けたり、抗体を誘導するなど)を引き起こす細胞の性質。
- 注3) 同系移植
- 同じ遺伝的背景を持つ近交系マウス間の移植。ヒトでは一卵性双生児間の移植に相当する。自家移植のモデル。
- 注4) 米カリフォルニア大サンディエゴ校のチーム
- 以下の論文になります。
Zhao T, Zhang ZN, Rong Z, Xu Y (2011). “ Immunogenicity of induced pluripotent stem cells.” Nature 474 (7350): 212-5.
doi: 10.1038/nature10135
日本では、2011年5月14日から15日にかけて各紙で報道されました。
<お問い合わせ先>
独立行政法人 放射線医学総合研究所 企画部 広報課
Tel:043-206-3026 Fax:043-206-4062
E-mail:
<研究に関すること>
独立行政法人 放射線医学総合研究所 研究基盤センター
研究基盤技術部 生物研究推進課 遺伝子・細胞情報研究室 室長
荒木 良子
Tel:043-206-3220 Fax:043-251-4593
E-mail:
<JSTの事業に関すること>
独立行政法人 科学技術振興機構 戦略研究推進部
石正 茂、木村 文治
Tel:03-3512-3525 Fax:03-3222-2067
E-mail: